清肠温中方对溃疡性结肠炎大鼠干扰素γ诱导蛋白10的影响*
2017-03-27毛堂友谢添弘贾博宜刘佳丽韩亚飞丁庞华李军祥
毛堂友,史 瑞,谢添弘,郭 一,陈 晨,石 磊,贾博宜,刘佳丽,谭 祥,韩亚飞,丁庞华,李军祥
(北京中医药大学东方医院脾胃肝胆科 北京 100078)
溃疡性结肠炎(ulcerative colitis,UC)是一种病因尚不十分清楚的结肠和直肠的慢性非特异性炎症性疾病[1,2],好发于年轻人,其腹痛、腹泻、黏液脓血便的临床主症严重影响患者的生活质量,被世界卫生组织列为现代难治病之一[3]。本课题组前期研究[4]发现,清肠温中方能够明显改善溃疡性结肠炎患者的临床症状,抑制炎症反应,修复肠粘膜损伤,总有效率为93.48%。但具体的作用机制尚不清楚。研究[5]显示,干扰素γ诱导蛋白10(Interferon gamma inducible protein 10,IP10)介导的炎症反应,是导致溃疡性结肠炎发病的主要机制之一。因此,本研究将从IP10及IL-1α、IL-1β、IL-6、TNF-α、INF-γ等炎症因子入手,探讨清肠温中方治疗溃疡性结肠炎的作用机制。
1 材料与方法
1.1 实验动物
健康SD大鼠,雄性,SPF级,体重(200±20)g,购自斯贝福(北京)生物技术有限公司(许可证号:SCXK(京)2011-0004),常规饲养于中国中医科学院中药研究所SPF级动物房,12小时光照/黑夜循环,温度(20-24)℃,湿度50-60%;自由饮食饮水饲养。
1.2 药物
清肠温中方的方药组成:黄连,炮姜,苦参,三七,青黛,煨木香,地榆炭,炙甘草,剂型为配方颗粒,由北京中医药大学东方医院配方颗粒药房统一购自于北京康仁堂药业有限公司,保证所用药品为同一批次,并进行鉴定质控。按实验动物与人体体表面积比等效量核算比率,计算动物的等效剂量。实验时以烧开的去离子水配制成所需浓度,放冰箱保存,每天配药一次。美沙拉嗪肠溶片(mesalazine,商品名:莎尔福)购自德国Losan Pharma GmbH公司。
1.3 试剂与仪器
葡聚糖硫酸钠(MW36-50KDa;MP Biomedical,Burlingame,CA,USA),便潜血试纸(珠海贝索生物技术有限公司);大鼠IL-1α酶联免疫试剂盒(Multiscience,EK301A2/2),大鼠IL-1β酶联免疫试剂盒(Multiscience,EK301B2/2),大鼠IL-6酶联免疫试剂盒(Multiscience,EK3062/2),大鼠TNF-α酶联免疫试剂盒(Multiscience,EK3821/2),大鼠INF-γ酶联免疫试剂盒(Multiscience,EK3802/2),IP10抗体(abcam,Ab7206),Beta actin抗体(中杉金桥,TA-09)PV9000超敏二步法免疫组化检测试剂购于北京中杉金桥生物技术有限公司。UCT型超薄切片机(德国莱卡公司),显微镜(尼康显微镜ECLIPSE LV100POL/50IPOL,日本),全自动多功能酶标仪(MULTISKAN MK3,美国),电热恒温培养箱(DH4000A,天津)等。
1.4 分组、造模及标本采集
本课题组的动物模型建立方法如前期研究[6],继续采用自由饮用4.5%DSS溶液制备溃疡性结肠炎大鼠模型,将70只健康SPF级雄性SD大鼠(体重200±20 g)适应性饲养1周后,以4.5%DSS(MW:36 000-50 000,MP Biomedical)溶液自由饮水7天,普通饲料喂养,昼/夜12/12 h交替,温度25℃,湿度60%。同时运用随机数字表法将大鼠随机均等分为6组:正常组,模型组,清肠温中方低剂量组(0.3 g/kg/day),清肠温中方中剂量组(0.6 g/kg/day),清肠温中方高剂量组(1.2 g/kg/day),美沙拉嗪组(0.03 g/kg/day)。造模的同时各组均以相应药物灌胃治疗7天。每日称取大鼠体重,检测便潜血,确保造模7天中大鼠均维持便血状态,造模结束后查看大鼠结肠病理,结肠黏膜病变不超过黏膜下层,炎症细胞侵润明显,使得模型维持在炎症阶段,避免异型增生的干预。各组大鼠,末次给药后,禁食不禁水,24 h后取材,分离远端结肠10 cm,-80℃冻存备用。
1.5 ELSIA法检测结肠组织炎症因子(IL-1α、IL-1β、IL-6、TNF-α、INF-γ)的表达
将冻存的结肠解冻后,在研钵里用眼科剪切成小片,并转入匀浆器中加入3倍生理盐水充分匀浆,1000r,4℃离心10 min,取上清液用于检测。
1.6 免疫组化检测结肠IP10的表达
4 μm厚的石蜡切片经过脱蜡、复水、高压修复、封闭后,按照试剂盒说明进行免疫组织化学染色(IP10抗体浓度1:5 000,Beta actin抗体浓度1:1 000),以PBS为阴性对照,200倍镜视野下采集图片,应用image pro plus 6.0软件分析图像,计算光密度(IOD)和染色区域总面积(area),其中以IOD表示目的蛋白表达量,以area表示目的蛋白分布及表达总面积,最后用平均光密度(IOD/area的比值)来进行统计分析。
1.7 统计学处理
所有的数据均采用SPSS 17.0统计软件(IBM Corp,Armonk,NY,USA)分析,数据以均值±标准差 (±s)表示。符合正态分布且方差齐进行单因素方差分析(One-way ANOVA),不符合正态分布或方差不齐进行非参数检验,均为组间比较,P<0.05为有统计学差异。
2 结果
2.1 结肠IL-1α、IL-1β
与正常组比较,模型组大鼠结肠IL-1α、IL-1β的表达水平显著增高(P<0.01);与模型组比较,清肠温中方中剂量组、高剂量组和美沙拉嗪组大鼠结肠的IL-1α、IL-1β表达水平均降低(P<0.05,P<0.01),清肠温中方低剂量组大鼠结肠IL-1β表达水平较模型组降低(P<0.05),清肠温中方低剂量组大鼠结肠IL-1α表达水平较模型组降低,但无统计学意义,见表1。
2.2 结肠IL-6、TNF-α
与正常组比较,模型组大鼠结肠IL-6、TNF-α的表达水平显著增高(P<0.05,P<0.01);与模型组比较,清肠温中方中剂量组、高剂量组和美沙拉嗪组大鼠结肠的IL-6表达水平均降低(P<0.05,P<0.01),清肠温中方低剂量组大鼠结肠IL-6表达水平较模型组降低(P<0.01),清肠温中方低剂量组大鼠结肠TNF-α表达水平较模型组降低,但无统计学意义,见表2。
2.3 结肠INF-γ
与正常组比较,模型组大鼠结肠IFN-γ的表达水平显著增高(P<0.01);与模型组比较,清肠温中方中剂量组、高剂量组和美沙拉嗪组大鼠结肠的IFN-γ表达水平均降低(P<0.05,P<0.01),清肠温中方低剂量组大鼠结肠IFN-γ表达水平较模型组降低,但无统计学意义,见表3。
2.4 结肠IP10
正常组大鼠结肠组织中的IP10阳性表达很少,模型组中IP10阳性表达区域主要在肠黏膜层、黏膜肌层、肌层、浆膜层等,经过治疗后,各治疗组较模型组的表达相对较少,其组织切片阳性表达染色主要为深棕黄色或褐色,见图1。与正常组相比,模型组IP10的平均光密度明显升高(P<0.01);而经过干预后,清肠温中方各剂量组和美沙拉嗪组大鼠结肠的IP10平均光密度较模型组显著降低(P<0.01,P<0.05),见表4。
表1 清肠温中方对DSS诱导的UC大鼠结肠IL-1α、IL-1β的影响(±s)
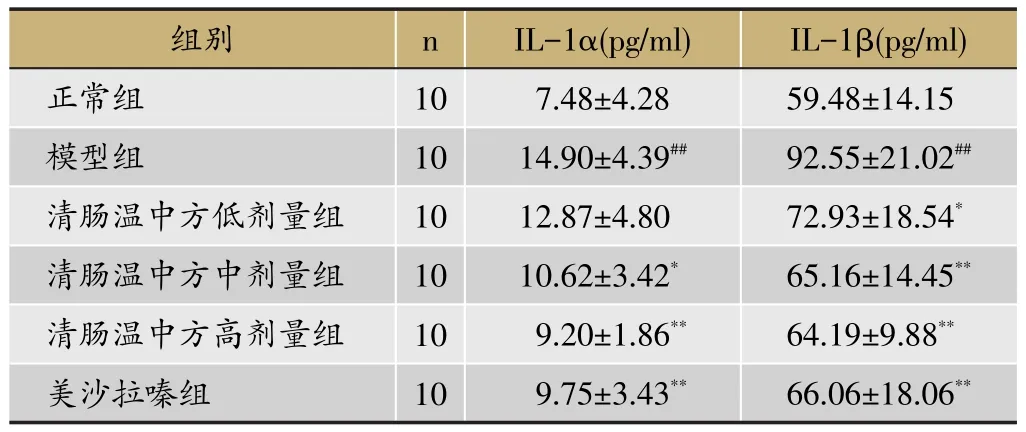
表1 清肠温中方对DSS诱导的UC大鼠结肠IL-1α、IL-1β的影响(±s)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
表2 清肠温中方对DSS诱导的UC大鼠结肠IL-6、TNF-α的影响 (±s)
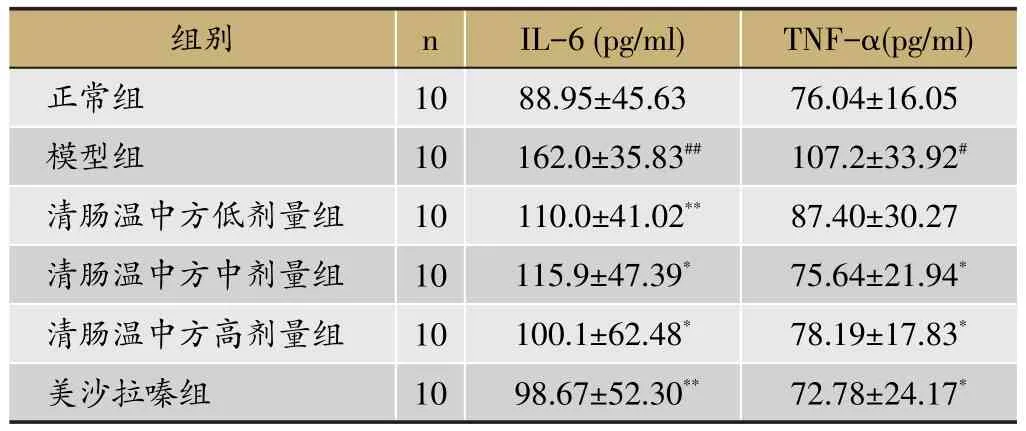
表2 清肠温中方对DSS诱导的UC大鼠结肠IL-6、TNF-α的影响 (±s)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01
表3 清肠温中方对DSS诱导的UC大鼠结肠IFN-γ的影响 (±s)
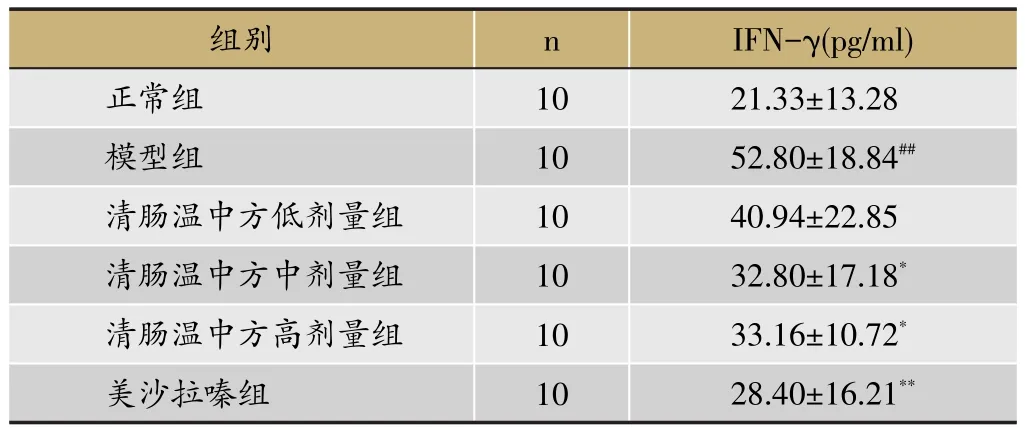
表3 清肠温中方对DSS诱导的UC大鼠结肠IFN-γ的影响 (±s)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
表4 清肠温中方对DSS诱导的UC大鼠结肠IP10的影响 (±s)
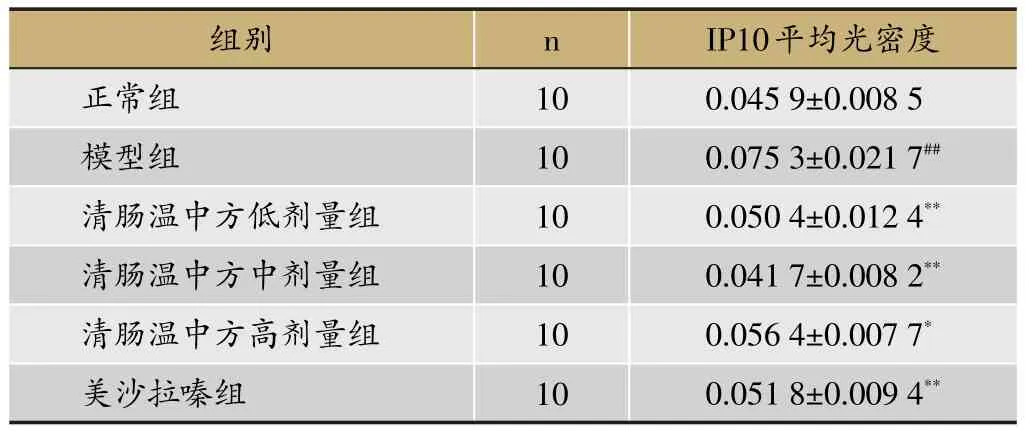
表4 清肠温中方对DSS诱导的UC大鼠结肠IP10的影响 (±s)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
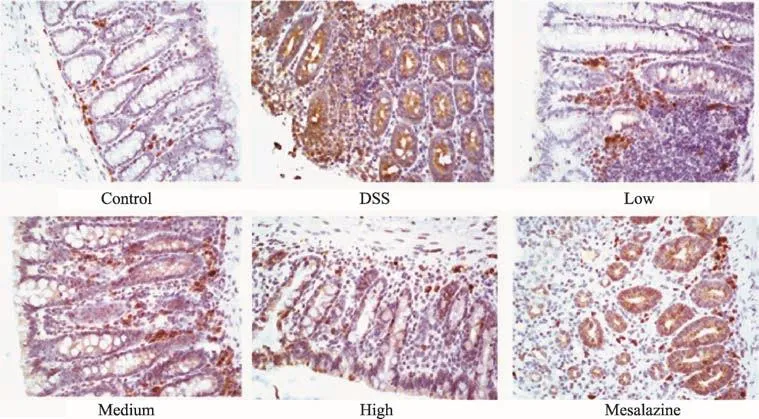
图1 清肠温中方对UC大鼠结肠IP10蛋白的影响(IHC,×200)
3 讨论
目前,UC的发病机制仍未完全阐明,目前大多学者认为持续肠道感染、肠黏膜屏障缺损、肠黏膜免疫调节异常、遗传和环境等因素共同参与了疾病发生过程[7]。其中,持续的肠道感染是导致UC发病的关键因素。
干扰素γ诱导蛋白10在UC的发生发展过程中发挥着重要作用。IP10属于ELR阴性的CXC亚家族的内生趋化因子,在IFN-γ诱导下由多种细胞如成纤维细胞、内皮细胞、单核细胞、T淋巴细胞等分泌[8],也可以在脂多糖、前炎症因子如IFN-α/β及TNF-α等刺激下分泌[9]。CXCR3是IP10唯一的受体,IP10与CXCR3特异性结合后,能够促进CXCR3+细胞的趋化活性[10],从而触发多步骤的信号转导通路,使CXCR3阳性靶细胞T细胞、B细胞、单核/巨噬细胞、树突细胞、NK细胞等向局部炎症病灶趋化。其中,被募集的T细胞在活化后主要分泌IL-2、TNF-β、IFN-γ;巨噬细胞主要分泌TNF-α、IL-1β、IL-6、IL-18、IL-12、IL-23、IFN-γ等炎性因子[11];而局部分泌增加的TN F-α、IFN-γ等炎症因子一方面刺激产生更多IP10,进一步募集更多的免疫细胞,形成恶性循环;另一方面可直接或间接损伤肠黏膜屏障,从而损伤肠黏膜[12],促进溃疡性结肠炎的发生发展。
本次实验中,模型组大鼠结肠IP10的表达水平较正常组大鼠显著增高,这与这与既往实验结果相一致[13,14],同时,结肠组织的炎症因子(IL-1α、IL-1β、IL-6、TNF-α、INF-γ)也呈现高表达,表明DSS能够诱结肠IP10的表达,促进炎症因子的产生,从而加强炎症反应,加重肠黏膜的损伤;而经过干预后,清肠温中方各剂量组的IP10及炎症因子(IL-1α、IL-1β、IL-6、TNF-α、INF-γ)的表达水平均下降,说明清肠温中方能够通过抑制IP10的表达,下调结肠炎症因子(IL-1α、IL-1β、IL-6、TNF-α、INF-γ)的水平,从而抑制肠道抑制炎症。
本次研究通过动物实验探讨了IP10对溃疡性结肠炎大鼠的调控机制,对清肠温中方治疗溃疡性结肠炎的作用机制做了初步研究,进一步深化了溃疡性结肠炎发病机制的认识,为临床运用清肠温中方治疗溃疡性结肠炎提供了良好的实验依据,但深入的作用机制有待于进一步研究。
1 Moon W.Golimumab Therapy in Ulcerative Colitis.Korean J Gastroenterol.2016.67(2):64-73.
2 Hao Y,Nagase K,Hori K,et al.Xilei San ameliorates experimental colitis in rats by selectively degrading pro-inflammatory mediators and promoting mucosal repair.Evid Based Complement Alternat Med.2014,2014(2014):569587.
3 Sclano G,Asthma.nasal polyposis and ulcerative colitis:a new perspective.Clin Exp Allergy.2002,32:1144-1149.
4 毛堂友,程佳伟,魏仕兵,等.清肠温中方治疗溃疡性结肠炎84例.环球中医药,2016,9(4):479-481.
5 Lloyd M,William J S,Yuriy S,et al.Anti-IP-10 antibody(BMS-936557)for ulcerativecolitis:a phase II randomised study.Gut.2014,63(3):442-50.
6 Mao T Y,Shi R,Zhao W H,et al.Decoction Ameliorates Dextran Sulphate Sodium-Induced Ulcerative Colitis in Rats by Downregulating the IP10/CXCR3 Axis-Mediated Inflammatory Response.Evid Based Complement Alternat Med,2016,2016(3):1-10.
7 刘占举.炎症性肠病发病机制新进展.内科理论与实践,2013,8(1):5-8.
8 Badige R,Mitchell J A,Gashaw H,et al.Effect of Different Interferonα 2 Preparations on IP10 and ET-1 Release from Human Lung Cells.PLoS One,2012,7(10):e46779.
9 Takano S,Ishikawa E,Matsuda M,et al.Interferon-β inhibits glioma angiogenesis through downregulation of vascular endothelial growth factor and upregulation of interferon inducible protein 10.Int J Oncol,2014,45(5):1837-1846.
10 Liu M L,Guo S C,Jacqueline M,et al.CXCL10/IP-10 in Infectious Diseases Pathogenesis and Potential Therapeutic Implications.Cytokine Growth Factor Rev.2011,22(3):121-130.
11 Xu J M,Shi G P.Emerging Role of Mast Cells and Macrophages in Cardiovascular and Metabolic Diseases.Endocr,2012,33(1):71-108.
12 Ostvik A E,Granlund A V,Bugge M,et al.Enhanced expression of CXCL10 in inflammatory bowel disease:potential role of mucosal Tolllike receptor 3 stimulation.Inflamm Bowel Dis,2013,19(2):265-74.
13 Lloyd M,William J S,Yuriy S,et al.Anti-IP-10 antibody(BMS-936557)for ulcerativecolitis:a phase II randomised study.Gut.2014,63(3):442-50.
14 Singh,U,P.Singh,S,Singh,R,et al.CXCL10-producing mucosal CD4+T cells,NK cells,and NKT cells are associated with chronic colitis in IL-10mice,which can be abrogated by anti-CXCL10 antibody inhibition.J Interferon Cytokine Res.2008,28(1):31-43.
