地下生态系统中氮素的循环及影响因素
2017-03-27蔡义民陈有军陈冬明孙飞达裴姝婷周春梅申旭东
曾 凯,刘 琳,蔡义民,陈有军,陈冬明,孙飞达,裴姝婷,周春梅,申旭东
(1.四川农业大学动物科技学院草业科学系,四川 成都 611130;2.日本畜产草地研究所,日本 东京 329-2793; 3.西南民族大学青藏高原研究院,四川 成都 610041)
地下生态系统中氮素的循环及影响因素
曾 凯1,刘 琳1,蔡义民2,陈有军3,陈冬明1,孙飞达1,裴姝婷1,周春梅1,申旭东1
(1.四川农业大学动物科技学院草业科学系,四川 成都 611130;2.日本畜产草地研究所,日本 东京 329-2793; 3.西南民族大学青藏高原研究院,四川 成都 610041)
氮素是陆地生态系统初级生产力的主要限制因子之一。地下生态系统中绝大部分氮素以不溶的聚合物形式存在,不能直接被植物吸收,因此其转化为可吸收的离子氮的生态过程受到人们越来越多的关注。本文主要综述了土壤生物与非生物两个自然因素在地下生态系统氮素循环过程中发挥的重要作用。土壤生物通过自身代谢和分泌各种酶类来加速各种形态氮素相互转化;植物根系可以通过影响土壤物理结构和分泌大量有机物质,实现与地下生态系统氮素循环之间的“相互交流”;而由于生物生存与环境因子有直接联系,二者之间的相互作用也对土壤氮素循环起着特殊作用。目前,由于土壤生物种类繁多、营养流通途径复杂、分子生物学实验技术较昂贵以及在全球气候变化背景下对许多自然规律的响应变化认识有限,因此,尚不能完全在分子水平形成一张氮素在地下生态系统的流通网络图,这应该成为今后相关研究工作的方向和重点。
地下生态系统;氮素循环;生物因子;环境因子
地下生态过程对于陆地生态系统有着极其重要的意义,不仅为地上植物提供有效的水和养分,而且其中丰富多样的生物类群也是维持生态系统功能的必要条件,保证了土壤养分循环的高效运转[1-3]。氮素是植物体内蛋白质、核酸以及叶绿素等生物大分子的重要组成物质,缺乏氮素常导致植物的光合作用速率显著降低,其对植物的生存、发展及初级生产力形成至关重要。并且,植物对氮素的吸收往往还与碳、硫、磷等元素的吸收相互耦合[4]。
尽管有些植物能直接从土壤中吸收有机氮,但由于微生物的竞争等因素[5],植物能够吸收利用的氮素主要还是无机氮(包括NH4+和NO3-),而这只占土壤全氮的1%,其余大部分氮(93%~97%)以有机氮的形式存在[6]。因此,土壤氮素循环不仅是整个生态系统生物地化循环的重要环节之一,更是限制生态系统生产力的重要因素。陆地生态系统中,土壤氮素的来源主要有生物固氮、施肥、大气氮沉降等途径,经过氨化及硝化等作用被植物利用,同时也可能通过反硝化作用转化为硝态氮经淋洗与侵蚀等作用流失或者作为NH3、NO、N2O等气体挥发。地下生态系统中,众多的生物和非生物因子均对土壤氮循环产生着复杂的影响。土壤微生物是促进氮素循环主要的动力[2],不仅通过自身代谢极大地推动氮素循环进程,还是土壤酶的主要来源之一[7-8]。微生物还能与植物根系相互共生形成菌根[9],这种共生体不仅能显著提高植物抗病与抗旱等抗逆能力,并且对包括氮素在内的土壤养分循环也发挥着重要作用[10]。土壤动物的活动和生理代谢也常常显著影响土壤氮循环。此外,植物根系不仅利用自身结构及分布等特点来影响土壤物理结构[11],还能通过根系分泌物和凋落物等形式来决定土壤氮素循环过程[12]。综上所述,土壤氮循环是一个受微生物驱动,由土壤酶介导催化的生物地化过程,这一过程同时受土壤温湿度、土壤理化性质、微型动物以及根系生长发育等生物和非生物因子的综合影响[6,12-13]。由于土壤氮循环发生紊乱,流入与输出不协调是导致许多生态问题出现的关键因素[14],因此深入了解地下生态过程中氮素循环的机制以及影响因素,对实现生态系统健康管理和维持生态系统的可持续发展至关重要。
1 地下生态系统中氮循环的主要过程
氮素循环是地下生态系统元素循环的核心过程之一,深入研究其主要反应过程和机制,对于调控土壤氮素循环的过程以及提高其利用效率都具有积极的作用[15]。氮素在土壤中的转化主要包括生物固氮作用、氨化作用、硝化作用和反硝化作用等,均由微生物所驱动,且在各种土壤酶蛋白的催化下进行[2](表1)。由于这个过程主要靠生物因子来驱动,因此能够影响生物因素的环境因子均能改变这一过程的方向和速率[29]。
1.1 生物固氮作用
固氮微生物体内含有将大气中稳定性高的分子态氮转化成植物可利用的铵态氮的固氮酶,这种氮素转化方式成为生物固氮,并且这是自然环境中土壤氮素的主要来源[30]。根据微生物和植物之间相互固氮方式的不同,可以将它们分为共生固氮、自生固氮和联合固氮微生物3类[31]。自然界存在大量的兼性类型和需氧类型的固氮微生物,其种类涉及广泛包括各类细菌、真菌、放线菌以及少量古菌。这些微生物主要通过分泌一些由nifD、nifK和nifH基因编码的钼铁(MoFe)固氮酶和少许由vnf、anf基因编码的钒铁(VFe)固氮酶和铁铁(FeFe)固氮酶[16-17],进而催化完成对大气中氮素的直接吸收。一些固氮细菌(如固氮螺菌)还可分泌生长素、赤霉素等一些生长激素,促使植物更好地吸收土壤环境中的水分和养分,调控植生长发育[32]。而且通过影响植物根系生长和生理特性等行为,固氮微生物还可以间接扩大根系分布范围,以提高植物获取土壤有效氮的能力,加快氮素在土壤中的转化进程[30]。另外,固氮微生物与土壤中生物与非生物因素有着密切的联系,其不仅受植被差异的影响,还与土壤条件、当地气候以及管理措施有关[33]。

表1 参与氮素循环的微生物及其分泌的酶
1.2 氨化作用
氨化作用是氮素矿化的第一步,也是给植物提供可利用有效氮素的关键一步。按照分子量的大小,可溶性有机氮分为高分子量与低分子量两种,后者虽然占总有机氮的比例不足5%,远低于前者(75%),但极易被微生物吸收转化[34]。胞外酶将高分子量有机氮分解成小分子量有机氮后,才能更有效地被微生物吸收利用,且这个过程往往是氨化过程的限速步骤[35]。微生物在氨化过程中起到巨大的推动作用,这不仅因为有机氮物质经过微生物体内代谢过程能产生铵态氮,而主要是由于微生物分泌的各种蛋白酶是氨化作用的主要介导者[23]。其中,真菌不仅能在土壤中相对较大的区域内活动,而且还可以分泌对高分子含氮化合物解聚有重要贡献的胞外酶[35]。研究发现,微生物和胞外酶的活性与氨化速率呈明显的正相关关系,在氨化过程中蛋白酶起着极其重要的作用,而且部分氨基酸脱氨酶能在胞外对低分子量有机氮进行分解并释放铵态氮[36]。但也有研究发现,长期施有机肥虽能提高土壤中氮素矿化的速率,但与精氨酸脱氨酶等转移酶并无明显相关性,这可能与土地利用状况和养分水平有关[37]。
1.3 硝化作用
硝化作用是土壤氮素转化过程的中心环节[15],主要分为两个步骤,即氨氧化过程和亚硝酸盐氧化过程,且前者为整个反应过程的限速步骤[38]。氨氧化过程主要由微生物内在基因amoA、amoB和amoC编码的氨单加氧酶(AMO)来完成[39]。普遍认为,氨氧化细菌(AOB)和氨氧化古菌(AOA)是催化氮素硝化作用的主要微生物[39]。在某些条件下,AOA数量还要高于AOB数千倍成为主导氨氧化作用的微生物类群[40]。目前已经发现的AOA主要有广古菌门(Euryarchaeota)、泉古菌门(Crenarchaeota)、奇古菌门(Thaumarchaeota)三大类群,且都具有与AOB类似的编码AMO的基因[26]。土壤性质和土地利用方式等因素都可影响主导硝化作用微生物类群。如随pH下降,土壤中AOA数量明显高于AOB,甚至检测不到AOB存在[41],并且pH增加与硝化速率升高有着明显的线性关系[42]。这可能是因为二者对氨氧化的途径以及电子传递系统有明显的差异,且此过程中AOA更有利于减少能量的消耗,因此保证了AOA在恶劣条件下表现出更强的生命力[43]。此外,不同的氮素浓度、肥料施加以及耕作方式也会明显改变氨氧化微生物群落特征[44]。
1.4 反硝化作用
土壤反硝化作用就是NO3-在一系列化学反应下经过NO2-→NO→N2O转化最后生成N2的过程,主要有生物反硝化和化学反硝化两种形式。目前的研究热点主要集中于前者。已发现的参与生物反硝化过程的微生物有80多个属的细菌和部分古菌、真菌和放线菌[15]。这些微生物能分泌4种相关的酶来逐步催化反硝化反应,包括硝酸还原酶(Nar)、亚硝酸还原酶(Nir)、一氧化氮还原酶(Nor)以及氧化亚氮还原酶(Nos)。土壤环境因子能显著影响反硝化过程。例如,中性与碱性土壤中的反硝化速率明显高于酸性土壤2.6至16.6倍[16]。而不同种类的反硝化微生物对环境变化的响应有差异,在同样施肥条件下,黑土中含有nirS基因的微生物能较好的解释土壤反硝化速率的变化,但与含有nirK基因的微生物无明显关系[45];而红壤中长期施肥仅对该微生物群落结构产生较大的影响,这种差异可能与环境条件,以及施肥种类不同有关[46]。另外,土壤反硝化作用还与氨氧化微生物的丰富度有明显的线性关系[47]。
目前对土壤中参与氮素循环的各微生物类群、相关酶类以及转化过程均有较为清晰的认识。然而,参与此过程的生物种类和反应步骤极其复杂,其对各环境因子变化的响应规律还认识较少,且对引起变化的内在机理认识更存在严重不足。在当前全球气候变化影响下,增强对这一机理的认识已迫在眉睫。
1.5 地下生态系统氮素源汇格局
自工业革命以来,由于化石燃料燃烧、化肥的使用以及森林砍伐等人类活动严重破坏了土壤氮素循环的动态平衡,导致陆地生态系统(主要包括森林、草地和农田生态系统)氮素的源汇格局发生了显著变化[48]。人类活动导致大气氮素沉降量增加[49-50],进而加快土壤NO与N2O等温室气体的排放,从而形成恶性循环[50-51]。因此,近年来关于陆地生态系统土壤氮素的源汇格局成为了国内外研究的焦点[52]。
森林作为最大的陆地生态系统,占有近90%的土壤氮素[52],其氮素流动的动态变化一直是研究的热点。据专家预测,至2050年全球大气氮沉降将达到200 kg N·(hm2·a)-1,这将对森林土壤氮素循环产生显著影响[49]。适当的氮增加有利于森林土壤氮素转化;但过量则会严重影响森林生态系统的健康发展[52]。森林土壤释放N2O量的增加,是大气氮沉降的一个主要负面效应。据估计,全球森林土壤大约可以释放氮素(N2O)0.47 kg N·(hm2·a)-1[53]。在全球尺度上看,气候是影响森林温室气体通量的主要驱动因子。局部地区,不同植被类型也对含N温室气体(主要是N2O的排放)有显著影响。我国亚热带马尾松(Pinusmassoniana)林地每年每公顷平均向大气中释放超过1.6 kg N(N2O),并且季节之间有显著的差异[54]。加拿大北部(苔原气候)山杨(Populusdavidiana)、黑云杉(Piceamariana)和斑克松(Pinusbanksiana)3种林地土壤向大气中释放氮(N2O)的速率分别为0.065、0.055和0.13 kg N·(hm2·a)-1[55]。在英国西加云杉(Sitkaspruce)林地两年的试验测得N2O净通量为0.62 kg N·(hm2·a)-1[56]。目前,对于土壤氮素源汇的定位研究大多局限于某个特定的气候带,且试验年限均较短,因此很难看出土壤氮素在较大时空下的动态关系。
2 地下生态过程中氮循环的主要影响因素及机制
2.1 植物及其根系与土壤氮元素的关系
2.1.1 根系凋落物的分解对土壤氮素循环的影响 土壤不仅通过改善生物活性和化学循环发生的环境来加快土壤养分循环速率,植物根系也是陆地生态系统矿质元素的重要储存库,并以此实现植被与土壤之间养分的交换[57]。根系从土壤中吸收的氮素,在植物体内经过一系列转化形成各种复杂的大分子物质以供植物生长[58],再经过死根的分解又重新回归土壤。这一转化过程不仅对氮素在生态系统中的循环有极大的推动作用,还能提高土壤质量、促进微生物增殖以及增加土壤酶来源,这对加速土壤氮素矿化有极其重要的意义[57]。如欧洲山毛榉(Fagussylvatica)根系在土壤中凋落能显著提高土壤有效氮含量,且微生物对根系氮源的利用效率要明显高于叶片[59]。然而,近年来研究发现,根系周转过程中释放的化感物质对氮素转化表现出有较强的负面效应。多种林木以及草本植物在根系周转过程中释放出来的单宁酸和环二肽等化感物质会通过络合蛋白质、抑制微生物繁殖以及降低酶活性等方式对土壤氮素的有效性产生不利的影响[60-61]。由于凋落物的分解与其自身性质也有较大的关系,因此植被根系对土壤氮素循环产生的影响还因植被种类不同而有较大的差异[62]。
2.1.2 植物根系分泌物对氮素循环的影响 根系分泌物对土壤产生的生态效应也是当前研究的重点。根系通过向周围释放大量低分子有机物、高分子聚合糖以及有机酸等,对土壤理化性质、生物地球循环过程产生极大的影响。主要包括几个方面:1)根系能分泌对土壤颗粒有很强粘着力的高分子多糖,能显著改善土壤微团聚体的稳定性及大小分布等物理性质,间接促进土壤养分的循环[63];2)分泌的低分子量有机酸,能明显降低土壤pH[64],这可以螯合以及活化土壤中难溶的含氮物质,从而能被植被根系吸收[65];3)植物根系分泌物也是土壤酶重要的来源之一,包括磷酸酶、转氨酶、淀粉酶、蛋白酶、多聚半乳糖醛酸酶等,可作为土壤碳、氮元素转化的催化剂[66];4)另外向土壤中添加植物根系分泌物既能显著提高其氮素矿化速率,降低氮素流失量[12],又能促进土壤氮素从无机态向有机态转化[67]。5)根系分泌物不仅能通过供给更养分促进微生物繁殖[64],还能选择性的增加与氮素循环相关微生物的增长速度[68],因此对氮素循环产生影响。然而根系分泌物对土壤氮素循环产生的影响与其种类也有显著的关系[69-70],准确测定不同植被根系分泌物的成分、各自对环境产生的生态效应以及与气候变化之间的规律,对进一步认识根系分泌物的作用有重要的意义。
2.1.3 植物根系参与形成的菌根在氮素循环中的作用 菌根(Mycorrhiza)是土壤真菌与植物根系形成的共生体。不仅能增加植物根系干重、根瘤数量以及微生物活性,还会显著提高植物氮素吸收的效率,因此也是影响地下生态系统氮素循环的重要环节[3,71]。菌根对氮素循环的促进作用与真菌种类以及组合方式有关[3]。菌根种类繁多,其中丛枝菌根(Arbuscularmycorrhiza)和外生菌根(Ectomycorrhizas)是最重要的两种形式[9]。
目前的研究表明,菌根主要通过以下几个方面来影响氮素的循环过程:1)菌根产生的菌丝能够扩大植物根系吸收土壤氮素的范围。用摩西球囊霉(Glomusaggregatum)接种玉米(Zeamays)后发现,产生的菌丝对土壤中的无机氮有明显的吸收作用,且对铵态氮吸收效果较好[72]。2)通过改变土壤微生物群落结构和生物量,能够间接对氮素循环产生影响。如根内球囊霉(G.intraradices)产生的菌丝不仅增加了细菌数量,还可以中和洋葱伯克霍尔德菌(Burkholderiacepacia)对真菌的抑制影响[73]。研究发现,AMF可以解释土壤中大概10%的微生物群落变化,对厚壁菌门细菌产生积极作用而对丛毛单胞菌和放线菌表现出抑制作用,并认为这可能正是其影响土壤氮素输出的一种潜在机制[74]。此外,丛枝菌根真菌还可以通过增强细菌对无机氮源的利用从而加速有机氮降解[10];3)菌根自身对氮素的吸收转化。目前已发现了大量存在于菌根中与各种形态氮素吸收相关的基因(表2);并有研究发现,从土壤中吸收到的氮素有部分将留在菌根菌丝中[72]。这些研究都证明了菌根真菌在地下生态系统氮素循环中的重要性。
虽然,植物根系在土壤氮素循环中的重要性已被广泛认同,并围绕几个主要的方面也做了大量研究,但是缺乏系统综合的深入研究。比如,根系分泌物对根围微生物影响显著,而微生物也通过根系影响植物的生理活动,但它们相互影响的具体机制以及与环境条件之间的关系仍需进一步的研究探明。此外,不同植物种根系生长情况及其根系分泌物的成分、含量和分泌速率的规律不尽相同,也需要进行大量研究工作。
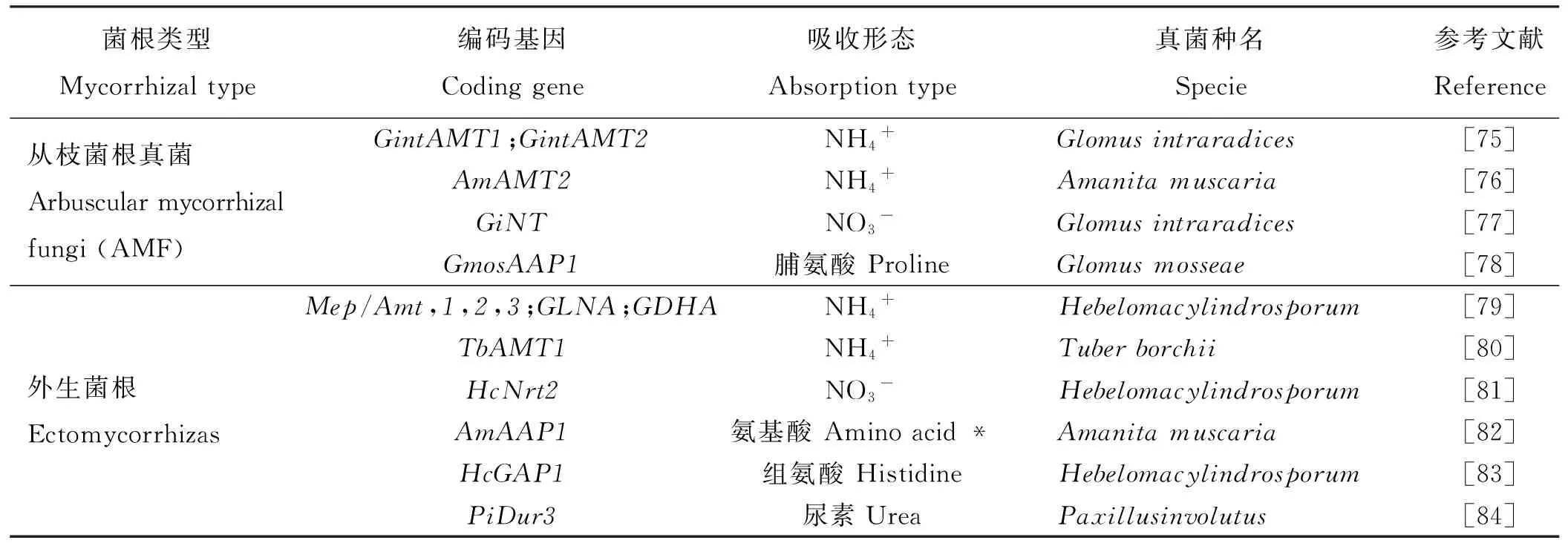
表2 菌根真菌中与氮素吸收的相关基因
注:*的具体表示氨基酸种类未知。
Note: The specific amino acid type is unknown.
2.2 土壤微型动物与氮元素的关系
陆地生态系统中,土壤微型动物不仅数量庞大并且分布非常广泛,生态功能极其重要[85],其中原生动物与线虫是最典型的两类。原生动物具有快速分布的能力,有时甚至风吹亦可促进其传播,并且还可以通过脱包囊快速生存下来[86]。线虫世代周期较短,在外界干扰下容易恢复,并且在受到逆境干扰时常通过脱水和禁食等方式来规避外界的伤害[87]。
2.2.1 土壤微型动物对氮素矿化的影响 原生动物和线虫等微型动物不仅能提高土壤氮素矿化速率,还能有效促进植物对其吸收的效率[1]。微型动物不仅能显著促进微生物对土壤氮素的矿化速率,并增加其氮素的生物固定[88];还能有效提高植被对土壤氮素的吸收效率,增加地上植被的初级生产力[89]。植物寄生性线虫破坏一些植物根系,释放更多的营养物质而有利于提高微生物活性和氮素矿化速率,但破坏过度又会对微生物产生明显的负面影响[13]。然而不同种类和体型的微型动物在土壤氮素矿化中起到的作用并不完全一致[90]。例如,线虫促进氮素矿化的速率不仅决定于物种差异,还与其体型大小有密切的关系[91]。蚯蚓对土壤氮素循环的影响不仅取决于土壤物理条件的差异,还归结于其自身的生物活性[92]。
2.2.2 土壤微型动物影响氮素矿化的机制 土壤微型动物主要通过与氮循环相关的微生物来对土壤氮素循环产生间接影响。一方面,土壤动物可通过特定的捕食习惯打破微生物物种之间的平衡关系,影响其群落结构[1,13]。如食细菌性线虫通过改变氨氧化细菌的群落结构,提高其土壤中NH4+和NO3-的含量[7],但食细菌性线虫对氨氧化古菌没有明显的影响[13]。另一方面,微型动物取食能够刺激微生物活性。由于微型动物体内碳氮比要高于微生物,加上呼吸过程碳元素的损失,会造成前者体内氮素过剩而排出体外[7]。这不仅显著促进了氮素矿化速率还给其它微生物提供了充足的养分[1]。而且,微型动物取食的往往都是“年老体弱”的个体,因此给其它生命旺盛的微生物提供了更加充足的生存条件[1]。如线虫的捕食虽然减少了28%的微生物生物量,但反而增加了18%的微生物活性[89]。此外,土壤微型动物通过新陈代谢不断向体外分泌养分和多种酶[8],并且其迁移过程加快微生物在土壤中的扩散,这对于促进地下生态系统氮素循环的速率都有积极的意义[93]。
尽管人们对土壤动物与氮素循环的关系已有清晰认识,但土壤动物物种类较多,且结构和功能均极其复杂。今后的工作还需进一步加强对养分在物种和营养级之间的流通特点,以及在全球气候变化背景下其对大气氮沉降做出的响应及其机制的了解。
2.3 土壤非生物环境与氮元素的关系
研究发现,不同地区的土壤因温度、湿度等环境条件,以及质地和类型等理化性质的不同,其氮素循环过程往往会产生显著的差异[94-95]。虽然不直接参与氮素循环的过程,但是土壤理化性质明显改变影响氮素循环的生物与非生物因素,如空气、水分以及与氮素转化相关的微生物、微型动物以及酶活性等。
2.3.1 土壤湿度与土壤温度 土壤温、湿度条件对氮素循环的影响主要表现在对微生物、微型动物以及其释放的酶活性等方面。土壤温度过低将不利于微生物生存以及增加铵态氮的积累,导致硝化作用降低[96]。适当增加土壤含水量可以促进氮素矿化[97],并降低土壤pH以利于植物对氮素的吸收。但过高的含水量如遇到极端降水反而会增加土壤淋溶和反硝化作用,造成氮素的流失[98]。一般土壤最大持水量在60%~80%,土壤温度在0~35 ℃范围内,土壤微生物活性和氮素矿化速率与二者呈正相关关系[95]。
气候极端地区的季节性温度和水分条件变化能较好的说明这一问题。在高纬度或高海拔地区,季节性的土壤冻融交替能显著改变土壤氮素循环的过程[94]。由于低温冰冻使植物根系和微生物死亡而释放了大量有机物质,随后气温回升,微生物利用这些物质迅速繁殖,因此加快了生长季(暖季)土壤中氮素矿化的速率[95,99]。但相关结论并不一致,也有研究发现土壤冻融交替反而显著降低了氮素的矿化速率[100]。这有可能是不同区域的土壤微生物耐冻融处理的能力不同,不适当的低温可能对微生物产生不利影响的结果。此外,温度还能通过影响根系分泌物分泌速率来改变土壤中与氮素循环相关的微生物增长速度,从而间接影响氮素循环速率[68]。
2.3.2 土壤类型与团聚体结构 不同土壤类型的水、气、热以及养分状况有明显差异,这也是影响土壤氮循环的重要因素。土壤容重过大会明显降低氮素矿化速率,且这种抑制作用随着水分含量的上升而增加[101],这可能与高容重土壤中氧气含量较少有一定关系。此外,由高容重造成土壤孔隙度降低限制了微型动物的活动范围,影响其对微生物的取食[13],因此影响着微生物体内固定的氮素在土壤氮素循环过程中流动[101]。土壤酶活性与土壤颗粒大小的分布显著相关,如在黑土和棕壤中脲酶主要分布于团聚体结构较小的部分[102],可能是这部分土壤能够固定较多的碳、氮和有机质[103],为各类微生物的生存提供了大量的营养物质。此外,还有研究发现与氮素循环密切相关的丛枝菌根真菌在不同的土壤类型如始成土、冲积土和薄层土中,其群落结构有明显的差异且具有各自的特点[104]。
2.3.3 土壤pH 土壤pH对地下生态系统中氮素循环的限制主要与对微生物和酶活性的影响有关。1)不同的酶有各自最适的pH[105],过酸过碱性的条件都不利于酶功能的发挥。如在珠江三角洲酸性土壤中施加石灰能明显提高土壤酶活力,并因此增加该地区水稻产量[106]。反硝化酶最适偏碱性的土壤条件(pH为8.4),且土壤pH是影响反硝化产物产生的最主要的因素[107-108]。2)土壤有机质的可溶性与土壤pH也有密切的联系,这又直接影响到微生物的生长速度以及其分泌酶的能力,从而改变土壤氮素循环的进程[109]。3)土壤pH还能影响某些与土壤氮素循环相关的微生物群落结构。如极端的酸性条件甚至检测不到AOB的存在[110]。
2.3.4 土壤有机质含量 土壤有机质不仅能促进土壤团聚体形成、降低容重以及增加土壤保水保肥能力,还能调节土壤固、液、气三相的量和结构,影响地下生态系统氮循环的各个过程[111]。土壤有机质通过促进土壤微型动物和微生物群落发育[112],增加土壤酶的来源和活性从而间接加快土壤氮素矿化速率[113]。施加生物碳和凋落物能明显提高土壤有机质含量来改善土壤理化性质,从而有效提高与氮素循环相关的微生物数量和改变土壤中细菌与真菌的比例[114-115]。在各种土壤环境中,土层深度造成的微生物数量与种类的差异,常常也是由于不同土层有机质含量不同引起的[103]。此外,有机质是氮素储存的重要形式之一,在一些氧化酶的催化下可以从中释放出来,因此土壤有机质与全氮和碱解氮之间表现出了显著的正相关关系[116]。
3 结语及展望
氮素对植物生长发育过程极其重要,且在土壤中生物地化反应过程十分复杂。虽然,国内外学者围绕地下生态过程对氮循环的影响已进行了大量的研究并取得了显著进展。但目前对于地下生态过程对氮循环影响的具体机制仍有不少环节不甚清楚:1)由于目前宏基因组测序费用昂贵,该方法使用范围严重受限。因此无法精准描述环境变化条件下土壤微生物各物种的变化规律;2)当环境因素引起微生物群落结构变化后,对行使其功能的酶活性变化的深层机理还认识不足;3)目前对根系分泌物的收集及其成分的鉴定存在较大困难,且虽已认识到根系分泌物是地上植被与地下生态系统“相互交流”的纽带,但这种交流的具体机制还缺乏认识;4)受限于地下生态过程难于直接观测,过去一直缺乏精准的研究技术手段,且现有的研究手段花费较高,比如植物根系研究对试验设备的要求较高,因此系统全面的研究较少。综上所述,为了更加深入的了解影响土壤氮素循环的具体机制,需要在分子等微观层面和各种不同生态系统中开展更具体更系统的研究。
References:
[1] Ronn R,Vestergard M,Ekelund F.Interactions between bacteria,protozoa and nematodes in Soil.Acta Protozoologica,2012,51(3):223-235.
[2] Nannipieri P,Giagnoni L,Renella G,Puglisi E,Ceccanti B,Masciandaro G,Fornasier F,Moscatelli M C,Marinari S.Soil enzymology:Classical and molecular approaches.Biology and Fertility of Soils,2012,48(7):743-762.
[3] Abd A H,Enany A W,Nafady N A,Khalaf D M,Morsy F M.Synergistic interaction ofRhizobiumleguminosarumbv. viciae and arbuscular mycorrhizal fungi as a plant growth promoting biofertilizers for faba bean (ViciafabaL.) in alkaline soil.Microbiological Research,2014,169(1):49-58.
[4] Zhou X J,Liang Y,Chen H,Shen S H,Jing Y X.Effects of rhizobia inoculation and nitrogen fertilization on photosynthetic physiology of soybean.Photosynthetica,2006,44(4):530-535.
[5] 蔡瑜如,傅华,陆丽芳,王静.陆地生态系统植物吸收有机氮的研究进展.草业科学,2014,31(7):1357-1366. Cai Y R,Fu H,Lu L F,Wang J.Research progress on the uptake of organic nitrition by terresterial plants.Pratacultural Science,2014,31(7):1357-1366.(in Chinese)
[6] Bowles T M,Raab P A,Jackson L E.Root expression of nitrogen metabolism genes reflects soil nitrogen cycling in an organic agroecosystem.Plant and Soil,2015,392(1-2):175-189.
[7] Xiao H,Griffiths B,Chen X,Liu M,Jiao J,Hu F,Li H.Influence of bacterial-feeding nematodes on nitrification and the ammonia-oxidizing bacteria (AOB) community composition.Applied Soil Ecology,2010,45(3):131-137.
[8] 陈小云,刘满强,胡锋,毛小芳,李辉信.根际微型土壤动物——原生动物和线虫的生态功能.生态学报,2007(8):3132-3143. Chen X Y,Liu M Q,Hu F,Mao X F,Li H X.Contributions of soil micro——fauna(protozoa and nematodes) to rhizosphere ecological functions.Actaecology Since,2007(8):3132-3143.(in Chinese)
[9] He X H,Critchley C,Bledsoe C.Nitrogen transfer within and between plants through common mycorrhizal networks (CMNs).Critical Reviews in Plant Sciences,2003(6):531-567.
[10] Johansen A,Jakobsen I,Jensen E S.Hyphal transport of15N-labelled nitrogen by a vesicular-arbuscular mycorrhizal fungus and its effect on depletion of inorganic soil N.New Phytologist,1992,122(2):281-288.
[11] 周艳松,王立群.星毛委陵菜根系构型对草原退化的生态适应.植物生态学报,2011(5):490-499. Zhou Y S,Wang L Q.Ecological adaptation of root architecture to grassland degradation inPotentillaacaulis.Chinese Journal of Plant Ecology,2011(5):490-499.(in Chinese)
[12] Fisk L M,Barton L,Jones D L,Glanville H C,Murphy D V.Root exudate carbon mitigates nitrogen loss in a semi-arid soil.Soil Biology and Biochemistry,2015,88:380-389.
[13] Jiang Y,Jin C,Sun B.Soil aggregate stratification of nematodes and ammonia oxidizers affects nitrification in an acid soil.Environmental Microbiology,2014,16(10):3083-3094.
[14] Schlesinger W H,Reynolds J F,Cunningham G L,Huenneke L F,Jarrell W M.Biological feedbacks in global desertification.Science,1990,247:1043-1048.
[15] 贺纪正,张丽梅.土壤氮素转化的关键微生物过程及机制.微生物学通报,2013(1):98-108. He J Z,Zhang L M.Key processes and microbial mechanisms of soil nitrogen transformation.Microbiology China,2013(1):98-108.(in Chinese)
[16] Lan T,Han Y,Cai Z.Denitrification and its product composition in typical Chinese paddy soils.Biology and Fertility of Soils,2014,51(1):89-98.
[17] Zou Y,Zhang J,Yang D,Chen X,Zhao J,Xiu W,Lai X,Li G.Effects of different land use patterns onnifHgenetic diversity of soil nitrogen-fixing microbial communities inLeymuschinensissteppe.Acta Ecologica Sinica,2011,31(3):150-156.
[18] 宋成军,马克明,傅伯杰,曲来叶,刘杨.固氮类植物在陆地生态系统中的作用研究进展.生态学报,2009(2):869-877. Song C J,Ma K M,Fu B J,Qu L Y,Liu Y.A review on the functions of nitrogen-fixers interrestrial ecosystems.Acta Ecologica Sinica,2009(2):869-877.(in Chinese)
[19] Jonathan P Z,Jenkins B D,Short S M,Steward G F.Nitrogenase gene diversity and microbial community structure:A cross-system comparison.Environmental Microbiology,2003,69(7):539-554.
[20] Mcglynn S E,Boyd E S,Peters J W,Orphan V J.Classifying the metal dependence of uncharacterized nitrogenases.Frontiers In Microbiology,2013,3:doi:10.3389/fmicb.2012.00419.
[21] Morrissey J P,Walsh U F,O’Donnell A,Moёnne L Y,O’Gara F.Exploitation of genetically modified inoculants for industrial ecology applications.Antonie van Leeuwenhoek,2002(1-4):599-606.
[22] Li X.Quantifying biological nitrogen fixation of different catch crops and residual effects of roots and tops on nitrogen uptake in barley using in-situ15N labelling.Plant and Soil,2015,395(1-2):273-287.
[23] Marzadori C,Antisari L V,Gioacchini P,Sequi P.Turnover of interlayer ammonium in soil cropped with sugar beet.Biology and Fertility of Soils,1994,18(1):27-31.
[24] Bach H J,Hartmann A,Schloter M,Munch J C.PCR primers and functional probes for amplification and detection of bacterial genes for extracellular peptidases in single strains and in soil.Journal of Microbiological Methods,2001,44(2):173-182.
[25] Rao M B,Tanksale A M,Ghatge M S,Deshpande V V.Molecular and biotechnological aspects of microbial proteases.Microbiology and Molecular Biology Reviews,1998,62(3):597-635.
[26] Brochier A C,Boussau B,Gribaldo S,Forterre P.Mesophiliccrenarchaeota:Proposal for a third archaeal phylum,theThaumarchaeota.Nature Reviews Microbiology,2008,6(3):245-252.
[27] Head I M,Hiorns W D,Embley T M,Mccarthy A J,Saunders J R.The phylogeny of autotrophic ammonia-oxidizing bacteria as determined by analysis of 16S ribosomal RNA gene sequences.Journal of General Microbiology,1993,139(3):1147-1153.
[28] Teske A,Alm E,Regan J M,Toze S,Rittmann B E,Stahl D A.Evolutionary relationships among ammonia- and nitrite-oxidizing bacteria.Journal of Bacteriology,1994,176(21):6623-6630.
[29] Kirstein K,Bock E.Close genetic relationship betweenNitrobacterhamburgensisnitrite oxidoreductase andEscherichiacolinitrate reductases.Archives of Microbiology,1993,160(6):447-453.
[30] Hirofumi S,Du H K,Hiroo U,Junta S.Denitrification by fungi.Fems Microbiology Letters,1992,73(3):277-281.
[31] Shoun H,Kano M,Baba I,Takaya N,Matsuo M.Denitrification by actinomycetes and purification of dissimilatory nitrite reductase and azurin fromStreptomycesthioluteus.Journal of Bacteriology,1998,180(17):4413-4415.
[32] Philippot L.Denitrifying genes in bacterial andArchaealgenomes.Biochimica Et Biophysica Acta,2002,1577(3):355-376.
[33] 呼和,陈先江,程云湘.撂荒地亚硝酸还原酶基因nirK和nirS丰度动态.草业科学,2016,33(7):1253-1259. Hu H,Chen X J,Cheng Y X.The dynamics for abundance of nitrite reductase genesnirKandnirSin abandoned land.Pratacultural Science,2016,33(7):1253-1259.(in Chinese)
[34] Jones D L,Kielland K.Amino acid,peptide and protein mineralization dynamics in a taiga forest soil.Soil Biology and Biochemistry,2012,55:60-69.
[35] Schimel J P,Bennett J.Nitrogen mineralization:Challenges of a changing parading.Ecology,2004,85(3):591-602.
[36] Zaman M,Di H J,Cameron K C,Frampton C M.Gross nitrogen mineralization and nitrification rates and their relationships to enzyme activities and the soil microbial biomass in soils treated with dairy shed effluent and ammonium fertilizer at different water potentials.Biology and Fertility of Soils,1999,29(2):178-186.
[37] Stark C H,Condron L M,O’Callaghan M,Stewart A,Di H J.Differences in soil enzyme activities,microbial community structure and short-term nitrogen mineralisation resulting from farm management history and organic matter amendments.Soil Biology and Biochemistry,2008,40(6):1352-1363.
[38] 贺纪正,张丽梅.氨氧化微生物生态学与氮循环研究进展.生态学报,2009(1):406-415. He J Z,Zhang L M.Advances in ammonia-oxidizing microorganisms and global nitrogen cycle.Acta Ecology Sinica,2009(1):406-415.(in Chinese)
[39] Venter J C,Remington K,Heidelberg J F,Halpern A L.Environmental genome shotgun sequencing of the Sargasso Sea.Science,2004,304:84-87.
[40] Leininger S,Urich T,Schloter M,Schwark L,Qi J,Nicol G W,Prosser J I,Schuster S C,Schleper C.Archaea predominate among ammonia-oxidizing prokaryotes in soils.Nature,2006,442:806-809.
[41] Reigstad L J,Richter A,Daims H,Urich T,Schwark L,Schleper C.Nitrification in terrestrial hot springs of Iceland and Kamchatka.FEMS Microbiol Ecology,2008,64(2):167-174.
[42] Chen J,Zhao X Q,Xue Z,Jia Z J,Ren F S.High pH-enhanced soil nitrification was associated with ammonia-oxidizing bacteria rather than archaea in acidic soils.Applied Soil Ecology,2015,85:21-29.
[43] Shen X Y,Zhang L M,Shen J P,Li L H,Yuan C L,He J Z.Nitrogen loading levels affect abundance and composition of soil ammonia oxidizing prokaryotes in semiarid temperate grassland.Journal of Soils and Sediments,2011,11(7):1243-1252.
[44] WaIker C B,Torre J R,Klotz M G,Urakawa H,Pinela N,Arp D J,Brochier A C,Chain P G,Chan P P,GoIIabgir A,Hemp J,HügIer M,Karr E A,Könneke M,Shin M,Lawton T J,Lowe T,Martens H W,Sayavedra L A,Lang D.Nitrosopumilus maritimus genome reveals unique mechanisms for nitrification and autotrophy in globally distributed marine crenarchaea.Proceedings of the National Academy of Sciences,2010,107(19):8818-8823.
[45] Yin C,Fan F,Song A,Cui P,Li T,Liang Y.Denitrification potential under different fertilization regimes is closely coupled with changes in the denitrifying community in a black soil.Applied Microbiology and Biotechnology,2015,99(13):5719-5729.
[46] Chen Z,Luo X,Hu R,Wu M,Wu J,Wei W.Impact of long-term fertilization on the composition of denitrifier communities based on nitrite reductase analyses in a paddy soil.Microbial Ecology,2010,60(4):850-861.
[47] Paranychianakis N V,Tsiknia M,Giannakis G,Nikolaidis N P,Kalogerakis N.Nitrogen cycling and relationships between ammonia oxidizers and denitrifiers in a clay-loam soil.Applied Microbiology Biotechnology,2013,97(12):5507-5515.
[48] Pachouri P K,Meyer L A.IPCC,2014:Climate Change 2014:Synthesis Report.Geneva:Contribution of Working Groups Ⅰ,Ⅱ and Ⅲ to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change,2014:151.
[49] Galloway J N,Townsend A R,Erisman J W,Bekunda M,Cai Z,Freney J R,Martinelli L A,Seitzinger S P,Sutton M A.Transformation of the nitrogen cycle:Recent trends,questions,and potential solutions.Astronomy and Astrophysics,2008,565(9):89-93.
[50] Luo Y.Responses of ecosystem nitrogen cycle to nitrogen addition:A meta-analysis.New Phytologist,2011,189(4):1040-1050.
[51] Cheng S,Wang L,Fang H,Yu G,Yang X,Li X,Si G,Geng J,He S,Yu G.Nonlinear responses of soil nitrous oxide emission to multi-level nitrogen enrichment in a temperate needle-broadleaved mixed forest in Northeast China.Catena,2016,147:556-563.
[52] Zhu X,Zhang W,Chen H,Mo J.Impacts of nitrogen deposition on soil nitrogen cycle in forest ecosystems:A review.Acta Ecologica Sinica,2015,35(3):35-43.
[53] Lin H,Ge W,Wei W,Xi Z.Factors affecting global forest soil N2O emission flux.Chinese Journal of Ecology,2012,31(2):446-452.
[54] Chen D,Fu X Q,Wang C,Liu X L,LI H,Shen J L,Wang Y,Li Y,Wu J S.Nitrous Oxide Emissions from a masson pine forest soil in subtropical central China.Pedosphere,2015,25(2):263-274.
[55] Matson A,Pennock D,Bedard H A.Methane and nitrous oxide emissions from mature forest stands in the boreal forest,Saskatchewan,Canada.Forest Ecology and Management,2009,258(7):1073-1083.
[56] Zerva A,Mencuccini M.Short-term effects of clearfelling on soil CO2,CH4,and N2O fluxes in a Sitka spruce plantation.Soil Biology and Biochemistry,2005,37(11):2025-2036.
[57] 胡雷,王长庭,阿的鲁骥,字洪标.高寒草甸植物根系生物量及有机碳含量与土壤机械组成的关系.西南民族大学学报:自然科学版,2015,41(1):6-11. Hu L,Wang C T,Ade L J,Zi H B.Relationship between root biomass,soil organic carbon and soil mechanical composition in alpine meadow.Journal of Southwest University for Nationalities:Natural Science Edition,2015,41(1):6-11.(in Chinese)
[58] Lea P J,Azevedo R A.Nitrogen use efficiency:Uptake of nitrogen from the soil.Annals of Applied Biology,2006,149(3):243-247.
[59] Guo C,Dannenmann M,Gasche R,Zeller B,Papen H,Polle A,Rennenberg H,Simon J.Preferential use of root litter compared to leaf litter by beech seedlings and soil microorganisms.Plant and Soil,2013(1-2):519-534.
[60] Kraus T C,Dahlgren R A,Zasoski R J.Tannins in nutrient dynamics of forest ecosystems:A review.Plant and Soil,2003,256(1):41-66.
[61] Kong C H,Chen L C,Xu X H,Wang P,Wang S L.Allelochemicals and activities in a replanted Chinese fir (Cunninghamialanceolata(Lamb.)) tree ecosystem.Journal of Agricultural and Food Chemistry,2008,56(24):11734-11739.
[62] Uselman S M,Quails R G,Lilienfein J.Quality of soluble organic C,N,and P produced by different types and species of litter:Root litter versus leaf litter.Soil Biology and Biochemistry,2012,54(6):57-67.
[63] 罗永清,赵学勇,李美霞.植物根系分泌物生态效应及其影响因素研究综述.应用生态学报,2012(12):3496-3504. Luo Y Q,Zhao X Y,Li M X.Ecological effect of plant root exudates and related affecting factors:A review.Chinese Journal of Applied Ecology,2012(12):3496-3504.(in Chinese)
[64] Neumann G.Root Exudates and Nutrient Cycling.Heidelberg:Springer,2006:123-157.
[65] Long L,Li S,Zhou L.Diversity enhances agricultural productivity via rhizosphere phosphorus facilitation on phosphorus-deficient soils.Proceedings of the National Academy of Sciences of the United States of America,2007,104(27):11192-11196.
[66] Feth Z H,Catherine S,Thierry H,Wafa A.Root exudates mediated interactions belowground.Soil Biology and Biochemistry,2014,56:69-80.
[67] Nardi S,Sessi E,Pizzeghello D,Sturaro A,Rella R,Parvoli G.Biological activity of soil organic matter mobilized by root exudates.Chemosphere,2002(7):1075-1081.
[68] Zhangac Z,Qiaoac M,Liab D,Yina H,Liua Q.Do warming-induced changes in quantity and stoichiometry of root exudation promote soil N transformations via stimulation of soil nitrifiers,denitrifiers and ammonifiers? European Journal of Soil Biology,2016,74:60-68.
[69] Landi L,Valori F,Ascher J,Renella G,Falchini L,Nannipieri P.Root exudate effects on the bacterial communities,CO2evolution,nitrogen transformations and ATP content of rhizosphere and bulk soils.Soil Biology and Biochemistry,2006,38(3):509-516.
[70] Renella G,Egamberdiyeva D,Landi L,Mench M,Nannipieri P.Microbial activity and hydrolase activities during decomposition of root exudates released by an artificial root surface in Cd-contaminated soils.Soil Biology and Biochemistry,2006,38(4):702-708.
[71] Guo W,Zhao R,Zhao W,Fu R,Guo J,Bi N,Zhang J.Effects of arbuscular mycorrhizal fungi on maize (ZeamaysL.) and sorghum (SorghumbicolorL.) grown in rare earth elements of mine tailings.Applied Soil Ecology,2013,83:85-92.
[72] Tanaka Y,Yano K.Nitrogen delivery to maize via mycorrhizal hyphae depends on the form of N supplied.Plant,Cell and Environment,2005,28(10):1247-1254.
[73] Albertsen A,Ravnskov S,Green H,Jensen D F,Larsen J.Interactions between the external mycelium of the mycorrhizal fungusGlomusintraradicesand other soil microorganisms as affected by organic matter.Soil Biology and Biochemistry,2006,38(5):1008-1014.
[74] Nuccio E E,Hodge A,Pett R J,Herman D J,Weber P K,Firestone M K.An arbuscular mycorrhizal fungus significantly modifies the soil bacterial community and nitrogen cycling during litter decomposition.Environmental Microbiology,2013,15(6):1870-1881.
[75] Perez T J,Testillano P S,Balestrini R,Fiorilli V,Azcon A C,Ferrol N.GintAMT2,a new member of the ammonium transporter family in the arbuscular mycorrhizal fungusGlomusintraradices.Fungal Genetics and Biology,2011,48(11):1044-1055.
[76] Willmann A,Wei M,Nehls U.Ectomycorrhiza-mediated repression of the high-affinity ammonium importer geneAmAMT2 inAmanitamuscaria.Current Genetics,2007,51(2):71-78.
[77] Montanini B,Gabella S,Abbà S,Peter M,Kohler A,Bonfante P,Chalot M,Martin F,Ottonello S.Gene expression profiling of the nitrogen starvation stress response in the mycorrhizal ascomyceteTuberborchii.Fungal Genetics and Biology,2006,43(9):630-641.
[78] Cappellazzo G,Lanfranco L,Fitz M,Wipf D,Bonfante P.Characterization of an amino acid permease from the endomycorrhizal fungusGlomusmosseae.Plant Physiology,2008,147(1):429-437.
[79] Javelle A,Morel M,Rodríguezpastrana B R,Botton B,André B,Marini A M,Brun A,Chalot M.Molecular characterization,function and regulation of ammonium transporters (Amt) and ammonium-metabolizing enzymes (GS,NADP-GDH) in the ectomycorrhizal fungusHebelomacylindrosporum.Molecular Microbiology,2003,47(2):411-430.
[80] Montanini B,Moretto N,Soragni E,Percudani R,Ottonello S.A high-affinity ammonium transporter from the mycorrhizal ascomyceteTuberborchii.Fungal Genetics & Biology,2002,36(1):22-34.
[81] Jargeat P,Rekangalt D,Verner M C,Gay G,Debaud J C,Marmeisse R,Fraissinettachet L.Characterisation and expression analysis of a nitrate transporter and nitrite reductase genes,two members of a gene cluster for nitrate assimilation from the symbiotic basidiomyceteHebelomacylindrosporum.Current Genetics,2003,43(3):199-205.
[82] Nehls U,Kleber R,Wiese J,Hampp R.Isolation and characterization of a general amino acid permease from the ectomycorrhizal fungusAmanitamuscaria.New Phytologist,1999,144(2):343-349.
[83] Wipf D,Benjdia M,Tegeder M,Frommer W B.Characterization of a general amino acid permease fromHebelomacylindrosporum.FEBS Letters,2002,528(1-3):119-124.
[84] Morel M,Jacob C,Fitz M,Wipf D,Chalot M,Brun A.Characterization and regulation ofPiDur3,a permease involved in the acquisition of urea by the ectomycorrhizal fungusPaxillusinvolutus.Fungal Genetics and Biology,2008,45(6):912-921.
[85] Gregory P J.Roots,rhizosphere and soil:The route to a better understanding of soil science?European Journal of Soil Science,2006(1):2-12.
[86] Griffiths B S,Caul S.Migration of bacterial-feeding nematodes,but not protozoa,to decomposing grass residues.Biology and Fertility of Soils,1993,15(3):201-207.
[87] Bongers T,Ferris H.Nematode community structure as a bioindicator in environmental monitoring.Trends in Ecology and Evolution,1999,14(6):224-228.
[88] Woods L E,Col C V,Elliott E T,Anderson R V,Coleman D C.Nitrogen transformations in soil as affected by bacterial-microfaunal interactions.Soil Biology and Biochemistry,1982(2):93-98.
[89] Djigal D,Brauman A,Diop T A,Chotte J L,Villenave C.Influence of bacterial-feeding nematodes (Cephalobidae) on soil microbial communities during maize growth.Soil Biology and Biochemistry,2004(2):323-331.
[90] Fu S,Ferris H,Brown D,Plant R.Does the positive feedback effect of nematodes on the biomass and activity of their bacteria prey vary with nematode species and population size?Soil Biology and Biochemistry,2005,78(11):1979-1987.
[91] Ferris H,Venette R C,Meulen H Rvd,Lau S S.Nitrogen mineralization by bacterial-feeding nematodes:Verification and measurement.Plant and Soil,1998(2):159-171.
[92] Costello D M,Lamberti G A.Biological and physical effects of non-native earthworms on nitrogen cycling in riparian soils.Soil Biology and Biochemistry,2009,41(10):2230-2235.
[93] Jiang Y,Sun B,Li H,Liu M,Chen L,Zhou S.Aggregate-related changes in network patterns of nematodes and ammonia oxidizers in an acidic soil.Soil Biology and Biochemistry,2015,88:101-109.
[94] Urakawa R,Shibata H,Kuroiwa M,Inagaki Y,Tateno R,Hishi T,Fukuzawa K,Hirai K,Toda H,Oyanagi N.Effects of freeze-thaw cycles resulting from winter climate change on soil nitrogen cycling in ten temperate forest ecosystems throughout the Japanese archipelago.Soil Biology and Biochemistry,2014,74:82-94.
[95] Griffin T,Honeycutt C,He Z.Effects of temperature,soil water status,and soil type on swine slurry nitrogen transformations.Biology and Fertility of Soils,2002,36(6):442-446.
[96] Smith J,Wagner R C,Dunfield K.Season and management related changes in the diversity of nitrifying and denitrifying bacteria over winter and spring.Applied Soil Ecology,2010,44(2):138-146.
[97] Bai Y,Wu J G,Clark C M.Tradeoffs and thresholds in the effects of nitrogen addition on biodiversity and ecosystem functioning:Evidence from Inner Mongolia grasslands.Global Change Biology,2010,16(2):889-899.
[98] Xiao T L,Han X G.Nutrient resorption responses to water and nitrogen amendment in semi-arid grassland of Inner Mongolia,China.Plant and Soil,2010(1-2):481-491.
[99] Zhao H,Zhang X,Xu S,Zhao X,Xie Z,Wang Q.Effect of freezing on soil nitrogen mineralization under different plant communities in a semi-arid area during a non-growing season.Applied Soil Ecology,2010,45(3):187-192.
[100] Hentschel K,Borken W,Matzner E.Repeated freeze-thaw events affect leaching losses of nitrogen and dissolved organic matter in a forest soil.Journal of Plant Nutrition and Soil Science,2008,171(5):699-706.
[101] Breland T A,Hansen S.Nitrogen mineralization and microbial biomass as affected by soil compaction.Soil Biology and Biochemistry,1996,28(4):655-663.
[102] 索南吉.青藏高原东缘土壤酶活性空间格局变化及对干扰的响应研究.兰州:兰州大学硕士学位论文,2012. Suo N J.Spatial variation of siol enzyme activity in eastern Qing-Tibet Plateau—— Effect of fertilization and grazing.Master Thesis.Lanzhou:Lanzhou University,2012
[103] 李贵才,韩兴国,黄建辉,唐建维.森林生态系统土壤氮矿化影响因素研究进展.生态学报,2001(7):1187-1392. Li G C,Han X G,Huang J H,Tang J W.A review of affecting factors of soil nitrogen mineralization in forest ecosystems.Acta Ecologica Sinica,2001(7):1187-1392.(in Chinese)
[104] Oehl F,Laczko E,Bogenrieder A,Stahr K,Bösch R,Heijden M,Sieverding E.Soil type and land use intensity determine the composition of arbuscular mycorrhizal fungal communities.Soil Biology and Biochemistry,2010,42(5):724-738.
[105] Renella G,Landi L,Ascher J,Ceccherini M T,Pietramellara G,Nannipieri P.Phosphomonoesterase production and persistence and composition of bacterial communities during plant material decomposition in soils with different pH values.Soil Biology and Biochemistry,2006,38(4):795-802.
[106] Ai C,Liang G,Sun J,He P,Tang S,Yang S,Zhou W,Wang X.The alleviation of acid soil stress in rice by inorganic or organic ameliorants is associated with changes in soil enzyme activity and microbial community composition.Biology and Fertility of Soils,2015,51(4):465-477.
[109] Curtin D,Campbell C A,Jalil A.Effects of acidity on mineralization:pH-dependence of organic matter mineralization in weakly acidic soils.Soil Biology and Biochemistry,1998,30(1):57-64.
[110] Zhang L M,Hu H W,Shen J P,He J Z.Ammonia-oxidizing archaea have more important role than ammonia-oxidizing bacteria in ammonia oxidation of strongly acidic soils.The ISME Journal,2012,6(5):1032-1045.
[111] Chertov O G,Komarov A S,Bykhovets S S,Kobakc K I.Simulated soil organic matter dynamics in forests of the Leningrad administrative area,northwestern Russia.Forest Ecology and Management,2002(1-2):29-44.
[112] Treonis A M,Austin E E,Buyer J S,Maul J E,Spicer L,Zasada I A.Effects of organic amendment and tillage on soil microorganisms and microfauna.Applied Soil Ecology,2010,46(1):103-110.
[113] Scott N A,Binkley D.Foliage litter quality and annual net N mineralization:Comparison across North American forest sites.Oecologia,1997,113(2):151-159.
[114] Anderson C R,Condron L M,Clough T J,Fiers M,Stewart A,Hill R A,Sherlock R R.Biochar induced soil microbial community change:Implications for biogeochemical cycling of carbon,nitrogen and phosphorus.Pedobiologia,2011,54(5-6):309-320.
[115] Pisani O,Lin L,Lun O,Lajtha K,Nadelhoffer K,Simpson A,Simpson M.Long-term doubling of litter inputs accelerates soil organic matter degradation and reduces soil carbon stocks.Biogeochemistry,2016,127(1):1-14.
[116] Kieloaho A J,Pihlatie M,Carrasco M D,Kanerva S,Parshintsev J,Riekkola ML,Pumpanen J,Heinonsalo J.Stimulation of soil organic nitrogen pool:The effect of plant and soil organic matter degrading enzymes.Soil Biology and Biochemistry,2016,96:970-106.
(责任编辑 苟燕妮)
The nitrogen cycle and factors affecting it in the belowground ecosystem
Zeng Kai1, Liu Lin1, Cai Yi-min2, Chen You-jun3, Chen Dong-ming1,Sun Fei-da1, Pei Shu-ting1, Zhou Chun-mei1, Shen Xu-dong1
(1.Department of Grassland Science, Animal Science and Technology College of Sichuan Agricultural University, Chengdu 611130, China;2.National Institute of Livestock and Grassland Science, Tokyo 329-2793, Japan 3.Institute of Qinghai-Tibetan Plateau, Southwest University for Nationalities, Chengdu 610041, China)
Nitrogen (N) is one of the main factors limiting primary productivity in terrestrial ecosystems due to its role in plant growth and development. In belowground ecosystems, most nitrogen exists in the form of complex polymers, but these forms of nitrogenous compounds cannot be absorbed and assimilated directly by plants. Hence, the ecological process from complex polymers to simple inorganic substances has always been a focus of research; this process is regulated and controlled by a series of complex biogeochemical reactions that occur belowground via symbiotic associations between plant roots and bacteria (e.g., biological nitrogen fixation). In this paper, we summarize the effects of soil biotic and abiotic factors on the belowground nitrogen cycle. Soil organisms promote the belowground nitrogen cycle through metabolism and release of various enzymes; Plant roots change the soil properties and secrete organic matter. The development of soil organisms is strongly restricted by abiotic factors, so the interaction between organisms and some abiotic factors also exerts important influences on the belowground nitrogen cycle. Currently, due to the high abundance of soil organism species, the complexity of nutrient circulation patterns, the limited understanding regarding the response of nature to global climate change, and the expense of molecular biotechnology, it is still difficult to define the whole nitrogen nutrition circulation network in the belowground ecosystem at the molecular level. This review summarizes our current understanding regarding the belowground nitrogen cycle and how it is regulated by biotic and abiotic factors.
belowground ecosystem; nitrogen cycle; biotic factor; abiotic factor
Liu Lin E-mail:liulinsky@126.com
10.11829/j.issn.1001-0629.2016-0342
2016-06-24 接受日期:2016-11-17
教育部“春晖计划”合作科研项目(Z2015078);四川省科技厅国际合作项目(2016HH0087);四川省科技厅重大专项(2015SZ0062)
曾凯(1991-),男,湖南益阳人,在读硕士生,研究方向为草地生态。E-mail:514995903@qq.com
刘琳(1978-),女,四川成都人,副教授,博士,研究方向为草地生态。E-mail:liulinsky@126.com
S154.1
A
1001-0629(2017)3-0502-13*
曾凯,刘琳,蔡义民,陈有军,陈冬明,孙飞达,裴姝婷,周春梅,申旭东.地下生态系统中氮素的循环及影响因素.草业科学,2017,34(3):502-514.
Zeng K,Liu L,Cai Y M,Chen Y J,Chen D M,Sun F D,Pei S T,Zhou C M,Shen X D.The nitrogen cycle and factors affecting it in the belowground ecosystem.Pratacultural Science,2017,34(3):502-514.
