COPD营养不良大鼠下丘脑瘦素受体活化后STAT3、SOCS3的表达研究
2017-03-24徐志波陈芳江劲
徐志波 陈芳 江劲
COPD营养不良大鼠下丘脑瘦素受体活化后STAT3、SOCS3的表达研究
徐志波 陈芳 江劲
目的 通过检测慢性阻塞性肺疾病(COPD)合并营养不良大鼠血清瘦素及其下丘脑受体活化后信号传导转录活化因子3(STAT3)、细胞因子信号传导抑制因子3(SOCS3)的表达,推测其在介导类似于恶病质的COPD营养不良出现的可能机制。方法 将30只SD大鼠分为两组:正常组、COPD组各15只。两组大鼠在自制熏烟箱内被动吸烟24周,并在第30、45天于气道内滴入脂多糖(LPS)0.2ml。观察各组大鼠的一般情况,检测血清瘦素、TG、低密度脂蛋白(VLDL)水平,制作肺组织HE病理切片,Western-blot法测定下丘脑STAT3、SOCS3相对表达量。 结果 COPD组大鼠肺细支气管管壁厚度、管壁面积、管壁面积/腔周长均较正常组增加,差异均有统计学意义(t=7.633、18.843、8.470,均P<0.01),COPD组体重、TG、VLDL、瘦素、SOCS3的表达均低于正常组,差异均有统计学意义(t=-8.199、-16.736、-4.043、-6.235、-8.738,均P<0.01),而STAT3表达水平则高于正常组(t=18.860,P<0.01)。结论COPD大鼠合并营养不良的出现,可能与瘦素作用于下丘脑受体后引起信号转导分子STAT3表达上调和SOCS3表达下调有关。
瘦素 慢性阻塞性肺疾病 营养不良 信号传导转录活化因子3 细胞因子信号传导抑制因子3
慢性阻塞性肺疾病(COPD)是呼吸系统的常见慢性疾病,病情反复、迁延发展过程中往往会合并营养不良,导致患者在COPD终末期出现类似恶病质的情况。虽其发生机制是多方面的,但众多研究表明,瘦素在介导COPD合并营养不良的发生、发展中具有不可忽视的作用。鉴于有关瘦素作用于下丘脑受体后信号分子的变化文献报道较少,笔者对COPD合并营养不良大鼠血清瘦素水平及下丘脑受体活化后信号传导转录活化因子3(STAT3)、细胞因子信号传导抑制因子3(SOCS3)表达的变化进行了研究,从而推测其在介导类似于恶病质的COPD营养不良中的可能机制,现将结果报道如下。
1 材料和方法
1.1 实验动物、试剂及仪器 成年清洁级SD大鼠30只,均为雄性,体重(217±13)g;由浙江中医药大学动物实验中心提供,每笼5只,饲养于浙江中医药大学动物实验中心,控制室温(20±2)℃,湿度40%~70%,12h交替采光,普通饲料喂养,自由饮水进食。实验用烟为雄狮牌过滤嘴香烟(浙江中烟工业有限责任公司出品,焦油量8mg,烟气烟碱量0.7mg)。脂多糖(LPS)购自美国Sigma公司,瘦素、TG、低密度脂蛋白(VLDL)酶联免疫吸附测定试剂盒均购自武汉新启迪生物科技有限公司。抗STAT3抗体(anti-STAT3 antibody)试剂盒购于美国Santa Cruz公司,批号:A7224。抗SOCS3抗体(anti-SOCS3 antibody)试剂盒购于美国Santa Cruz公司,批号:Sc-9023。甲醇、水合氯醛等常规试剂购置于华东医药集团有限公司。自制熏烟机为浙江平湖宏利公司生产;AllegraX-15R大容量离心机购于美国贝克公司;超净工作台购于苏州安泰有限公司;酶标仪购于芬兰Thermo公司;酶标仪分析软件购于芬兰Thermo公司;蛋白紫外分光光度计购于德国Eppendorf公司;Mini-PROTEAN电泳和转膜系统购于美国Bio-Rad公司;定量PCR仪器购于美国ABI公司;CO烟雾浓度监测仪购于英思科传感仪器(上海)有限公司。
1.2 方法
1.2.1 动物分组及造模方法 30只SD大鼠按照随机数字表法分成正常组、COPD组各15只。采用和改进宋一平等[1]的造模方法,COPD组大鼠每天在自制熏烟机里吸烟2h(上、下午各1h),维持烟箱内烟雾浓度450~500bPm。在造模第30、45天分别予COPD组大鼠气道滴入LPS 0.2ml,滴入LPS当天不吸烟,共吸烟24周。正常组与COPD组饲养环境相同,但不吸烟。最后以肺组织病理切片所见作为COPD造模成功的金标准。据Congleton的研究[2],笔者在造模过程中,每周2次固定时间动态监测大鼠体重,以COPD组低于正常组90%的体重为营养不良的判断标准。
1.2.2 标本采集 大鼠吸烟24周,常规称重后予10%水合氯醛(0.3ml/100g)腹腔内注射麻醉,腹主动脉取血5ml,置于预冷的负压真空采血管中,静置30min后,于离心机中以2 000r/min,4℃离心10min,收集上清液分装至-70℃冰箱中保存;大鼠处死后开胸分离肺组织,迅速于10%中性甲醛溶液中固定。并按照张殿全等[3]方法,在枕骨大孔处迅速剪断延髓,去颅骨,完全暴露脑组织,取出脑组织,在冰冷平皿上去大脑、小脑,分离出下丘脑后在冰冷生理盐水中洗去残留血液,置于无菌冻存管后迅速放入液氮罐中冻存。
1.2.3 肺组织病理检查 将在甲醛溶液中固定24h的肺组织,常规取材脱水、石蜡包埋、切片,行HE染色,中性树胶封片。在显微镜100倍视野下观察肺组织结构变化,包括炎症细胞浸润、管壁纤维增生程度及管腔变形狭窄程度,计算其管壁厚度、管壁面积、管壁周长及管壁面积/管壁周长比值。
1.2.4 大鼠血清瘦素、TG、VLDL的测定 取出冷冻的血标本常温解冻后,于超净台上采用ELISA法测定两组血清瘦素、TG、VLDL水平,操作步骤严格按照试剂盒说明书进行。
1.2.5 下丘脑STAT3、SOCS3测定 采用Wester-blot法将分离的下丘脑解冻后进行总蛋白的提取和定量,SDS-PAGE电泳分析、蛋白质转膜、转印膜和封闭、一抗孵育、二抗孵育、显影及定影等步骤。具体要求依据蛋白质印迹技术及试剂盒说明书操作。最后采用Bandscan 5.0软件分析条带的光密度值,每个条带重复3次,目的蛋白相对表达量=目的蛋白(光密度值)/内参β-actin(光密度值),再乘以系数进行校正。
1.3 统计学处理 采用SPSS 17.0统计软件,计量资料以表示,其中管壁厚度、管壁面积、管壁面积/管壁周长比值均采用e为底的对数进行校正。组间比较采用独立样本t检验。
2 结果
2.1 两组大鼠肺组织病理检查所见及支气管管壁厚度、管壁面积、管壁面积/腔周长比较 见图1、表1。
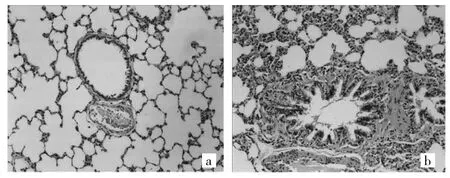
图1 两组大鼠肺组织病理检查所见(a:正常组,b:COPD组;HE染色,×100)

表1 两组大鼠细支气管管壁厚度、管壁面积、管壁面积/腔周长比较
由图1可见,正常组肺组织结构清楚,肺泡间隔清晰,气道管壁无纤维增生,管腔无变形狭窄,内无黏液附着,基本无炎症细胞浸润;而COPD组肺组织结构紊乱,肺泡间隔明显破坏,气道管壁纤维增生,管腔严重变形狭窄,大量黏液阻塞管腔,炎症细胞弥漫浸润。
由表1可见,COPD组大鼠肺细支气管管壁厚度、管壁面积、管壁面积/腔周长均较正常组增加,差异均有统计学意义(t=7.633、18.843、8.470,均P<0.01)。
2.2 两组大鼠体重变化及血清瘦素、TG和VLDL水平比较 见图2、表2。
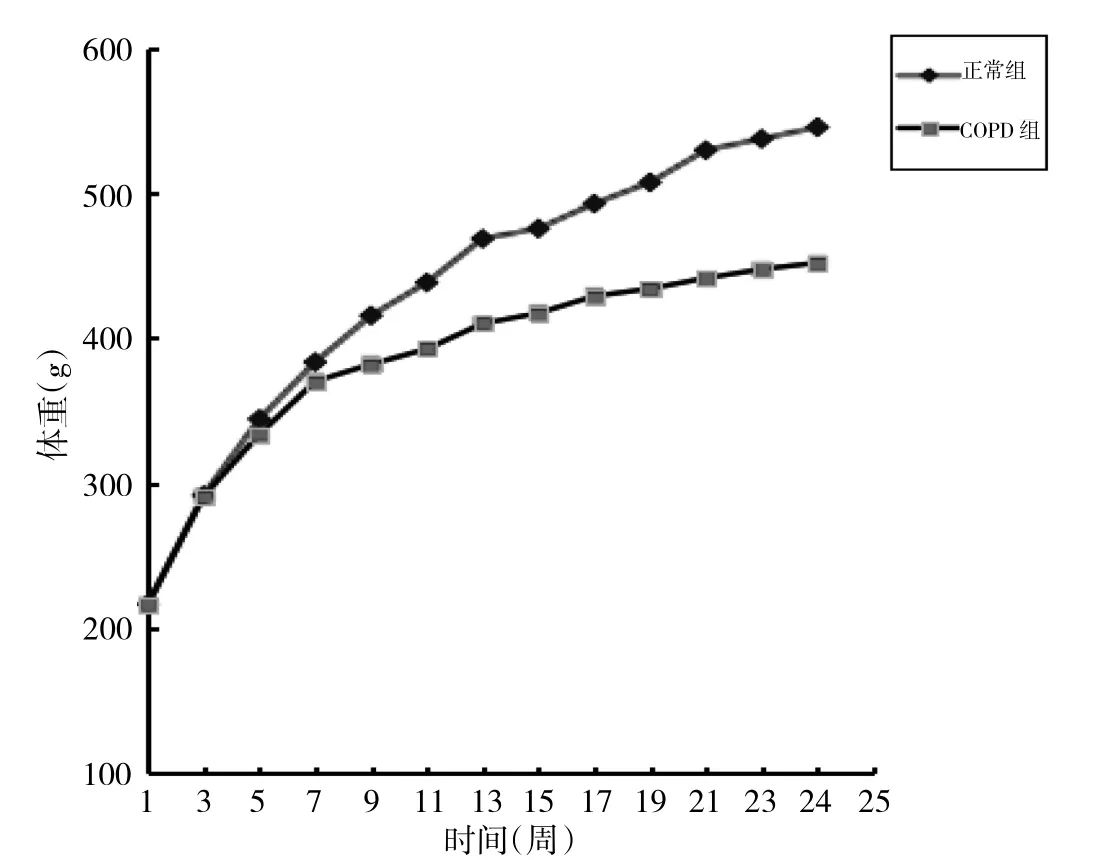
图2 两组大鼠体重变化的比较
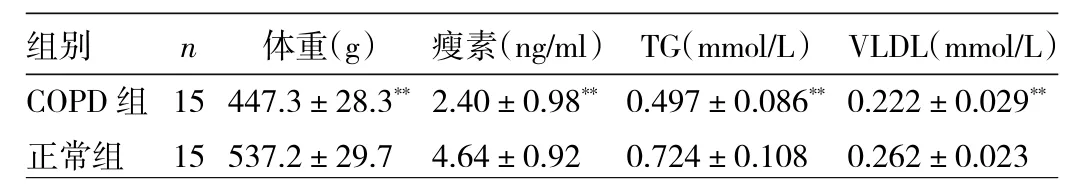
表2 两组大鼠体重及瘦素、TG、VLDL表达水平的比较
由图2、表2可见,从第4周开始,COPD组体重增速即开始较正常组减慢。至第24周,COPD组体重较正常组下降约14.3%,COPD组体重低于正常组90%,差异有统计学意义(t=-8.199,P<0.01)。而COPD组大鼠血清瘦素、TG、VLDL表达水平均低于正常组,差异均有统计学意义(t=-6.235、-16.736、-4.043,均P<0.01)。
2.3 两组大鼠下丘脑STAT3、SOCS3相对表达量比较 见图3。
由图3可见,COPD组STAT3相对表达量(31.96± 1.94),高于正常组(19.38±1.57),差异有统计学意义(t=18.860,P<0.01),COPD组SOCS3相对表达量(18.20± 0.78),低于正常组(23.04±1.92),差异有统计学意义(t=-8.738,P<0.01)。
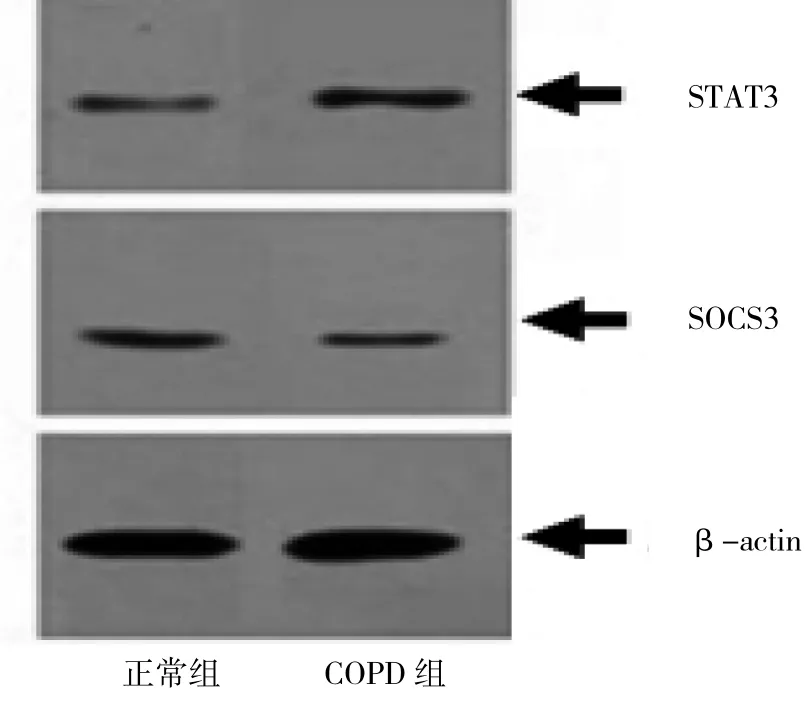
图3 两组大鼠下丘脑STAT3、SOCS3测定的电泳图
3 讨论
COPD营养不良动物模型是否成功建立对本研究至关重要。目前建立COPD模型国外大多使用清洁级BN大鼠来复制动物模型。而我国主要使用清洁级Wistar或SD大鼠制作COPD动物模型。故鉴于目前尚无一种被公认的建立最佳COPD动物模型的大鼠类型和方法,本研究通过大量的文献检索及前期预实验,决定采用和改进宋一平等的造模方法分2次气管内注入适量LPS和反复熏香烟烟雾的方法构建COPD大鼠模型,因其病理生理改变与人类COPD疾病形成状态相似,加之气道滴入LPS模拟人类肺部感染。本实验采用烟熏加气管滴注LPS的方法复制模型,模拟人类COPD疾病的发病模式。通过对动物的一般情况及肺组织病理切片的观察比较发现:经烟熏的SD大鼠逐渐出现烦躁,明显呛咳,呼吸急促,连续烟熏后症状逐渐加重;肺组织HE染色显示细支气管管腔变形、中层胶原纤维增生,平滑肌明显增厚,管腔明显狭窄,管腔内可见脱落上皮细胞及大量黏液,黏膜上皮增厚,黏膜皱壁有的形成假腺体样结构向管腔内突起,基底膜增厚,黏膜、黏膜下层有大量的炎症细胞浸润,肺泡隔破坏、增厚,肺泡腔变小,甚至部分细支气管管腔闭塞。最终引起大鼠气道的重塑,造模24周后,COPD组大鼠肺小气道均不同程度出现炎性细胞浸润、管壁增厚、管腔狭窄,提示COPD大鼠模型复制成功。同时每周2次固定时间动态监测并比较两组体重变化,实验数据显示COPD组大鼠在烟熏第24周出现体重较正常组下降14.3%,COPD大鼠体重低于正常组大鼠90%以上,参照Congleton的研究,说明本实验建立的COPD营养不良大鼠模型是成功的。
瘦素由肥胖基因编码,主要是由脂肪组织分泌的一种N端带有21个氨基酸信号肽的多肽,其主要功能是调节机体的能量代谢及脂肪的合成,是目前肯定的与COPD有明显相关性的细胞因子之一。Karakas等[4]在研究COPD稳定期患者循环瘦素水平与身体组成的关系时发现,COPD患者的瘦素水平低于健康对照者,且随着BMI的下降,瘦素水平进一步降低。瘦素主要通过与下丘脑瘦素受体结合,而发挥生物学效应,受体活化后信号传导是其功能的关键环节,酪氨酸激酶2(JAK2)/ STAT3途径是瘦素作用于下丘脑瘦素受体后信号转导的主要通路,而在此通路上STAT3、SOCS3的作用是不可忽视的。STAT3活化并转移定位到细胞核,与特定基因启动子区域的DNA元件或其他的转录因子或附属蛋白相互作用,调节靶基因的转录,抑制神经肽的分泌,从而抑制食欲、减少摄食以及增加能量的输出[5-6]。SOCS3是由瘦素介导STAT3活化并进入核内,特异性诱导产生的,其作用可通过负反馈来抑制激活的JAK/STAT3信号途径[7],从而减轻患者的厌食效应。总之,瘦素通过作用于下丘脑受体从而激活JAK2/STAT3通路,一方面增加STAT3的表达达到抑制食欲,同时另一方面又在持续诱导或激活SOCS3的表达来对STAT3的作用进行负反馈抑制。正常状态下,它们的相互作用处于动态平衡中。
本实验结果显示,COPD组合并营养不良大鼠下丘脑STAT3表达较正常组明显增多,另一方面COPD组合并营养不良大鼠SOCS3表达较正常组明显增少,且均有统计学意义,同时结合COPD组营养不良大鼠瘦素及体重检测结果,也较正常组均降低,且差异有统计学意义。实验结果提示,COPD组营养不良大鼠体重持续降低与瘦素有重要关系,其作用机制可能与瘦素作用于下丘脑受体后引起信号转导分子STAT3表达上调和SOCS3表达下调有关。COPD合并营养不良大鼠瘦素表达减少,下丘脑STAT3表达增加、SOCS3表达减少,3者作用动态失衡,可能是导致COPD大鼠类似于恶病质的营养不良出现的重要原因之一。
[1] 宋一平,崔德建,茅培英.慢性阻塞性肺病大鼠模型的建立及药物干预的影响[J].军医进修学院学报,2001,22(2):99-102.
[2]Congleton J.The Pulmonary cachexia syndrome:aspects of energy balance[J].Proc Nutr Soc,1999,58:321-328.
[3]张殿全,孙忠人.针刺四神聪对失眠大鼠下丘脑内5-HT、5HIAA含量的影响[J].中华中医药学刊,2009,27(9):1975-1977.
[4] Karakas S,Karadag F,Karul A B,et al.Circulating leptin and body composition in chronic obstructive Pulmonary disease[J].International Journal of Clinical practice,2005,59(10):1167-1170.
[5] Wolfe B E,Jimerson D C,Oriova C,et al.Effect of dieting on plasma leptin,soluble leptin receptor,adiponectin and resistin levels in healthy volunteers[J].Clin endocrinol(Oxf),2004,61(3): 332-338.
[6]Brichard SM,DelporteML,Lambert M.Adipocytokines in anorexia nervosa:a review focusing on leptin and adiponectin[J].Horm Metab Res,2003,35(6):337-342.
[7] Kreis S,Philippidou D,Margue C,et al.Recombinant interleukin-24 lacks apoptosis-inducing properties in melanoma cells [J].PLoS ONE,2007,2(12):300-309.
Expression of STAT3 and SOCS3 following leptin receptor activation in hypothalamus in COPD rats with malnutrition
Objective To investigate the expression of STAT3 and SOCS3 following leptin receptor activation in hypothalamus in COPD rats with malnutrition state.MethodsThirty SD rats were randomly divided into control group and COPD group with 15 in each group.Rats in COPD group received passive smoking for 24 weeks,then LPS 0.2ml was dripped in the airway at d30 and d45.All animals were sacrificed after experiments;serum leptin,triglycerides,VLDL were measured;and pathological examination of lung tissue was performed;relative expression of STAT3 and SOCS3 in hypothalamus was detected by Western-Blot.Results The body weight,and triglycerides,VLDL,leptin levels,and the expression of SOCS3 in COPD group were lower than those in normal group(all P<0.01),while the expression of STAT3 was higher(P<0.01). Conclusion The malnutrition state in COPD rats may be related to the leptin-mediated up-regulation of STAT3 expression and down-regulation of SOCS3 expression in hyothalamus.
Leptin COPD Malnutrition STAT3 SOCS3

2016-05-28)
(本文编辑:马雯娜)
10.12056/j.issn.1006-2785.2017.39.5.2016-790
国家自然基金项目(2012R10063);浙江省卫生厅一般项目(2013KYA140);浙江省博士后科研资助项目(BSH1402070)
310005 杭州,浙江中医药大学附属第二医院呼吸内科(徐志波、江劲);浙江中医药大学附属第一医院肺功能室(陈芳)
陈芳,E-mail:funchen@163.com
