地屈孕酮预处理在卵巢储备功能下降患者体外受精—胚胎移植中的应用
2017-03-24孙林常惠于黎黎王海燕邵小光
孙林+常惠+于黎黎+王海燕+邵小光
【摘要】 目的 探討使用地屈孕酮预处理对卵巢储备功能下降(DOR)患者体外受精-胚胎移植(IVF-ET)治疗相关参数及妊娠结局的影响。方法 96例符合DOR诊断标准的不孕患者, 采用拮抗剂方案进行体外受精/卵胞浆内单精子注射-胚胎移植(IVF/ICSI-ET)辅助助孕。将患者随机分为A组(34 例)、
B组(32例)和C组(30例)。预处理A组于体外受精(IVF)助孕前一月经周期黄体期口服地屈孕酮10 mg/次, t.i.d., 连续使用13 d;预处理B组于IVF助孕前一月经周期黄体期口服地屈孕酮10 mg/次, b.i.d., 连续使用10 d;C组作为对照组未行预处理。分析比较三组患者治疗周期相关参数及妊娠结局的变化。结果 预处理A组、预处理B组在人绒毛膜促性腺激素(HCG)日的雌二醇(E2)水平显著高于C组, 差异有统计学意义(P<0.05);预处理A组、预处理B组在于月经第3天的卵泡刺激素(FSH)水平显著低于C组, 差异有统计学意义(P<0.05)。但预处理A、B组比较差异无统计学意义(P>0.05)。A、B、C 三组患者依次两两比较, 月经第3天的E2、促黄体生成素(LH)水平和HCG日的LH、孕酮(P)水平以及窦卵泡计数( AFC)、促性腺激素(Gn)天数和Gn量、拮抗剂天数和量以及HCG日子宫内膜(Em)厚度比较差异均无统计学意义(P>0.05)。预处理A组的获卵数(6.92±3.05)个、受精率(73.06±25.42)%、优胚率(73.8%)和着床率(38.9%)显著高于C组(4.25±2.02)个、(60.51±18.32)%、(60.4%)、(26.0%), 差异有统计学意义(P<0.05);且A组Gn启动第4天、第7天和HCG日卵泡生长的不均匀率(最大卵泡直径与次大卵泡直径平均直径相差≥3 mm)显著低于C组, 差异有统计学意义(P<0.05)。预处理A组与预处理B 组比较, 差异无统计学意义(P>0.05)。预处理B组与C组各临床结局指标比较差异无统计学意义(P>0.05)。A、B、C三组患者依次两两比较, Gn启动日卵泡不均匀率、临床妊娠率以及孕早期流产率比较差异均无统计学意义(P>0.05)。结论 拮抗剂方案超促排卵的前一月经周期黄体期口服地屈孕酮预处理可以有效改善卵巢储备功能下降患者的Gn启动第4天、第7天和HCG日的卵泡不均匀率, 增强超促排卵效果, 增加获卵数, 提高受精率和优质胚胎率, 进而可以有效提高IVF/ICSI-ET的胚胎种植率和临床妊娠率, 推荐剂量为黄体期口服地屈孕酮10 mg, t.i.d.×13 d。
【关键词】 地屈孕酮;卵巢储备功能下降;拮抗剂方案;体外受精/卵胞浆内单精子注射-胚胎移植
DOI:10.14163/j.cnki.11-5547/r.2017.04.003
【Abstract】 Objective To explore the influence of dydrogesterone preprocessing on related parameters and pregnancy outcome of in vitro fertilization-embryo transfer treatment (IVF-ET) for patients with diminished ovarian reserve (DOR). Methods A total of 96 infertility patients matching DOR diagnosis standard were treated by antagonist scheme for in vitro fertilization/intracytoplasmic sperm injection and embryo transfer (IVF/ICSI-ET) assisted pregnancy, and they were randomly divided in group A (34 cases), group B (32 cases) and group C (30 cases). Preprocessing group A received oral dydrogesterone 10 mg/time, t.i.d., 13 d of continuous use at 1 menstrual cycle before in vitro fertilization (IVF) assisted pregnancy of luteal phase, preprocessing group B received oral dydrogesterone 10 mg/time, b.i.d., 10 d of continuous use at 1 menstrual cycle before IVF assisted pregnancy of luteal phase and group C received no preprocessing as control group. Treatment cycle related parameters and the change of the pregnancy outcomes were compared in three groups. Results Preprocessing group A and group B had higher estradiol (E2) on human chorionic gonadotropin (HCG) day, than group C, and the difference had statistical significance (P<0.05). Preprocessing group A and group B had lower follicle-stimulating hormone (FSH) level on 3rd day of menstruation than group C, and the difference had statistical significance (P<0.05), while there was no statistically significant difference between preprocessin group A and group B (P>0.05). There were no statistically significant difference in E2 on 3rd day of menstruation, LH and progesterone (P) level on HCG day, antral follicle count (AFC), gonadotropin (Gn) days, Gn quantity, days and quantity of antagonists and endometrial thickness (Em) on HCG day in pairwise comparison of three groups (P>0.05). Preprocessing group A had retrieved oocytes number as (6.92±3.05) pieces, fertility rate as (73.06±25.42), high qualified embryo rate as 73.8% and implantation rate as 38.9%, which were all significantly higher than (4.25±2.02) pieces, (60.51±18.32), 60.4%, and 26.0% in group C, and their differences had statistical significance (P<0.05). Group A had obviously lower follicles uneven rate of growth (difference value of average diameter between largest follicle diameter and secondary follicle diameter ≥3 mm) on HCG day and Gn started 4th and 7th day than those of group C, and the difference had statistical significance (P<0.05). There was no statistically significant difference between preprocessing group A and group B (P>0.05). Preprocessing group B had no statistically significant difference in all clinical outcome indexes compared with group C (P>0.05). There were no statistically significant difference in follicle uneven rate on Gn started day, clinical pregnancy rate and early pregnancy abortion rate in pairwise comparison of three groups (P>0.05). Conclusion Oral dydrogesterone preprocessing by antagonist scheme at 1 menstrual cycle of luteal phase before super stimulate ovulation can effectively improve the follicles uneven rate on Gn started 4th and 7th d and HCG day for diminished ovarian reserve patients, enhance the effect of super stimulate ovulation, increase retrieved oocyte number and high-quality embryo rate, so as to effectively improve embryo implantation rate and clinical pregnancy rate of IVF/ICSI-ET, and the recommended dose is oral dydrogesterone 10 mg,t.i.d.×13 d on luteal phase.
【Key words】 Dydrogesterone ; Diminished ovarian reserve; Antagonist scheme; In vitro fertilization-embryo transfer
卵巢储备功能是指女性双侧卵巢内尚存的可募集卵泡数量和质量, 反应其生育潜能和生殖内分泌功能[1]。而DOR是指因各种原因引起的卵巢产生卵子的能力减弱, 卵母细胞质量下降和生育能力下降[2]。目前最主要的助孕方法就是IVF-ET, 其中促性腺激素释放激素拮抗剂方案是最为温和、便捷和灵活的促排卵方案, 但其卵泡生长发育均匀性欠佳, 获卵数相对减少, 受精率、优胚率和临床妊娠率也会相应受到一定影响[3]。如何更好地运用拮抗剂方案, 并最大程度地改善卵泡生长的均匀性、增加获卵数、提高优质胚胎率和临床妊娠率, 是当前生殖领域日益受到重视的话题[4]。目前关于控制性超促排卵(COH)前预处理以改善拮抗剂方案临床结局的方法和其临床疗效还颇受争议, 其中关于地屈孕酮预处理在DOR患者中的应用研究也不多, 本研究旨在探讨黄体期地屈孕酮预处理对DOR患者IVF-ET治疗相关参数和妊娠结局的影响, 为进一步提高DOR患者的临床辅助治疗效果提供借鉴。现报告如下。
1 资料与方法
1. 1 一般资料 选择2015年1月~2016年6月在大连市妇女儿童医疗中心生殖与遗传中心就诊的符合DOR诊断标准的96例不孕患者, 符合以下三项标准中的任意两项即可入组;纳入标准:①35岁≤年龄≤42岁;②自然周期双侧卵巢AFC)≤5个;③基础FSH≥8.5IU/L或卵泡刺激素与黄体生成素比值(FSH/LH)≥3.6。进入治疗前2个月内不行任何激素治疗。排除标准[5]: 助孕周期数>3、宫腔粘连病史、子宫畸形、子宫内膜异位症、子宫腺肌病、甲状腺和肾上腺功能异常等。所有患者均签署知情同意书。将患者随机分为预处理A组(34 例)、B组(32例)、C组(对照组, 30例)。
1. 2 方法 预处理A组于IVF助孕前一月经周期黄体期开始服用地屈孕酮(达芙通, 荷兰苏威制药有限公司), 10 mg/次, t.i.d., 连续使用13 d。预处理B组于IVF助孕前一月经周期黄体期口服地屈孕酮10 mg/次, b.i.d., 连续使用10 d;C组未行任何药物预处理, 月经第3天常规抽取静脉血检测基础E2、LH和FSH水平并做阴式B超查看窦卵泡数(AFC), 于月经第3天开始使用Gn、重组促卵泡素[(rFSH), 默克雪兰诺, 德国]300U启动, 根据卵泡的生长情况添加人绝经期促性腺激素(HMG, 丽珠医药), 调整Gn用量。每2~3天复查B超, 于启动日、启动第4天、启动第7天和HCG(丽珠医药)日计算卵泡发育的不均匀率(将最大卵泡与次大卵泡平均直径相≥3 mm差则视为不均匀)。当最大卵泡直径达14 mm时加用拮抗剂(思则凯, Cetrotide, 默克雪兰诺, 德国)直至注射HCG日。当主导优势卵泡中有2~3个直径达18 mm时于当晚21:00注射HCG10000U, 注射后32~36 h 行取卵术, 将所获得的卵行常规IVF或卵胞浆内单精子注射(ICSI)后16~18 h观察受精情况。取卵72 h 移植卵裂期胚胎2~3枚。移植后14 d抽血查HCG值, 移植后28 d超聲见孕囊及心管搏动或流产物病理检查见绒毛者诊断为临床妊娠。妊娠12周以前的流产认为是孕早期流产。
1. 3 观察指标 观察三组基础的E2、LH、FSH, COH周期第3天的E2、LH、FSH水平, AFC、Gn天数及Gn用量, 拮抗剂使用天数及拮抗剂用量, HCG日E2、LH、P、HCG日子宫内膜厚度、卵泡发育不均匀率(Gn启动日、启动第4天、启动第7天、HCG日), 获卵率、受精率、优胚率、着床率、临床妊娠率及孕早期流产率。
1. 4 统计学方法 采用SPSS16.0统计学软件进行数据统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验;多组比较采用方差分析;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
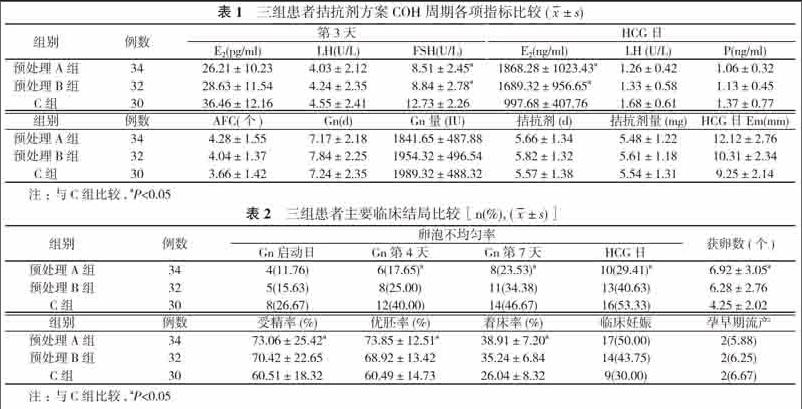
2. 1 三组间拮抗剂方案超促排卵周期各项指标的比较预处理A组、预处理B组在 HCG日的E2水平显著高于C组, 差异有统计学意义(P<0.05);预处理A组、预处理B组在于月经第3天的FSH水平显著低于C组, 差异有统计学意义(P<0.05)。但预处理A、B组比较差异无统计学意义(P>0.05)。A、B、C 三组患者依次两两比较, 月经第3天的E2、LH水平和HCG日的LH、P水平以及AFC、Gn天数、Gn量、拮抗剂天数和量以及HCG日子宫内膜(Em)厚度比较差异均无统计学意义(P>0.05)。见表1。
2. 2 三组患者主要临床结局比较 预处理A组的获卵数(6.92±3.05)个、受精率(73.06±25.42)%、优胚率(73.8%)和着床率(38.9%)显著高于C组(4.25±2.02)、个、(60.51±18.32)%、(60.4%)、(26.0%), 差异有统计学意义(P<0.05);且A组的Gn启动第4天、第7天和HCG日卵泡生长的不均匀率(最大卵泡直径与次大卵泡直径平均直径相差≥3 mm)显著低于C组, 差异有统计学意义(P<0.05)。预处理A组与预处理B 组比较, 差异无统计学意义(P>0.05)。预处理B组与C组各临床结局指标比较差异无统计学意义(P>0.05)。A、B、C三组患者依次两两比较, Gn启动日卵泡不均匀率、临床妊娠率以及孕早期流产率比较差异均无统计学意义(P>0.05)。见表2。
3 讨论
DOR患者发病年龄趋于年轻化, 发病率有上升趋势。卵泡数量减少会使卵泡对FSH 敏感性降低, 导致卵泡生长发育受限, 而且持续高水平的FSH可通过对卵泡本身的降调节作用来使残存的卵泡处于被抑制状态, 引起垂体对卵巢的不良反应[6, 7]。目前治疗方法主要有孕激素补充治疗、诱发排卵、辅助生殖、免疫治疗等[8]。两种细胞两种促性腺激素学说认为黄体晚期与早卵泡期黄体-卵泡转换期内源性FSH水平上升可以启动下一月经周期的卵泡募集, 因此黄体-卵泡转换期募集到的卵泡才是最终能发育成优势卵泡的关键[9, 10]。那么如何募集黄体-卵泡转换期的卵泡是下一个周期卵泡发育均匀化的关键所在。
促性腺激素释放激素(GnRH)拮抗剂方案是较为温和、便捷的治疗方案 [11]。本研究中拮抗剂方案是于早卵泡期开始Gn超促排卵治疗, 由于卵泡刺激素往往在前次月经周期的黄体晚期伴随黄体功能的退化即有缓慢升高, 较为敏感、FSH阈值偏低的窦卵泡从黄体晚期即开始, 对FSH敏感的窦卵泡因FSH的上升而优先发育, 从而导致整体卵泡发育的不均匀, 直径大的卵泡对于外源性Gn更为敏感, 这种不均匀性致使促排卵状态下卵泡发育的同步性较差, 最终导致获卵率、成熟卵子、受精率、优胚率和可用胚胎数目均受到影响[12-16]。
目前已有研究在黄体期口服类固醇激素作为卵巢低反应的一种常规辅助治疗策略。本研究中预处理A、B组患者在黄体期口服地屈孕酮预处理后月经第3天的基础FSH明显低于未预处理组, 且差异有统计学意义(P<0.05), 说明患者口服地屈孕酮后后体内的血清FSH水平受到部分抑制, 反馈性引起卵巢储备功能有所改善, 与文献报导一致。可能是由于在黄体-卵泡转换期使用地屈孕酮反饋性地抑制了FSH水平, 促进卵泡发育均一性, 进而导致地屈孕酮预处理组Gn启动第7天、HCG曰卵泡不均匀率明显低于对照组(P<0.05), 且获卵率、受精率和优胚率都有明显增加, 这些也与HCG日E2水平明显增加是相一致的。研究认为黄体中期使用地屈孕酮预处理, 可以有效促进卵泡发育的均匀性, 可能是由于孕激素预处理能明显抑制LH、FSH的分泌有关[3]。本研究结果显示地屈孕酮预处理组与未预处理组比较, 在Gn天数、Gn总量、拮抗剂天数和拮抗剂总量以及孕早期流产率方面比较差异均无统计学意义(P>0.05), 但预处理两组用量却有下降的趋势, 可能与卵泡发育均匀性增加后使得发育中卵泡对外源性的需要量相对减少有关, 这一点对临床应用还是很有参考价值的。本研究结果还显示拮抗剂方案超促排卵的前一月经周期黄体期口服地屈孕酮预处理A组可以有效改善卵巢储备功能下降患者的Gn启动第4天、第7天和HCG日的卵泡不均匀率, 增强超促排卵效果, 增加获卵数, 提高受精率和优质胚胎率, 进而可以相对提高IVF/ICSI-ET的胚胎种植率和临床妊娠率。作者推荐的剂量为黄体期口服地屈孕酮10 mg, t.i.d.×13 d, 可以作为临床借鉴使用。
综上所述, 研究认为对于卵巢储备功能降低的患者治疗前一周期黄体期给予适量地屈孕酮预处理可以明显增加其卵泡发育的均匀性, 提高获卵率、受精率、从而可相对改善妊娠结局。但是本研究为小样本的临床研究, 尚需经大样本、前瞻性的随机对照试验进一步验证, 以期对临床用药提供指导性意义。
参考文献
[1] Joiner LL, Robinson RD, Bates W, et al. Establishing institutional critical values of folliclestimulating hormone levels to predict in vitro fertilization success. Mil Med, 2007, 172(2): 202-204.
[2] 唐静. 不同促排卵方法对卵巢储备功能下降患者的疗效. 实用临床医药杂志, 2016, 20(5):96-99.
[3] 李元, 罗克莉, 龚斐. 地屈孕酮预处理可以增加拮抗剂方案中卵泡均匀性, 2014, 22 (10): 806-810.
[4] AI-Inany HG, Youssef MA, Aboulghar M, et al. GnRH antagonistare safer than agonist: an update of a Cochrane review. Hum Reprod Update, 2011, 17(4):435.
[5] Varani S, Stanzani M, Paolucci M, et al. Diagnosis of bloodstream infections in immunocompromised patients by real-time PCR.J Infect, 2009, 58(5):346-351.
[6] 王莹, 皮洁. 生长激素在卵巢储备功能降低患者中的临床应用. 中国生育健康杂志, 2014, 25(3):273-274.
[7] 胡蓉, 宋学茹, 夏天. 脱氢表雄酮在卵巢储备功能降低患者体外受精-胚胎移植中的应用. 国际生殖健康/计划生育杂志, 2013, 32(2):832-835.
[8] 聂明月, 方颖, 张军, 等. 基础睾酮水平对卵巢储备功能下降患者体外受精-胚胎移植结局的预测. 中国优生与遗传杂志, 2015, 23(3):96-98.
[9] 李玉梅, 巴林林, 刘冬娥, 等. 卵泡期联合黄体期促排卵在卵巢储备功能减退患者实施辅助生殖技术中的应用. 生殖医学杂志, 2014, 23(9):728-732.
[10] 徐晨, 王亮, 李文, 等. 麒麟丸对卵巢储备功能减退患者体外受精-胚胎移植的影响. 发育医学电子杂志, 2016, 4(3):158-161.
[11] 宋慧玲, 郭艺红, 郭华娟, 等. 生长激素对卵巢储备功能低下的年轻患者体外受精-胚胎移植治疗结局的影响. 中国实用医刊, 2012, 39(22):58-60.
[12] 张平, 赵静, 王蕴颖, 等. 脱氢表雄酮对卵巢储备低下患者体外受精-胚胎移植的影响. 实用临床医药杂志, 2014, 18(13): 57-59.
[13] 杨爱敏. 三种促排卵方案对卵巢储备功能低下者体外受精-胚胎移植结局的比较. 河北医科大学, 2011.
[14] 张楚, 张雪, 宋雪梅, 等. 黄体期促排卵改善卵巢低反应及卵巢储备功能减退患者助孕结局的效果研究. 中国妇幼保健, 2016, 31(20):4236-4238.
[15]邹琴燕, 李建芬, 李红. 微刺激方案在卵巢储备功能减退患者不同年龄组中的临床结局分析. 中外医疗, 2016, 35(15):34-36.
[16]宋晖, 武雁, 田国华, 等. 脱氢表雄酮预处理对卵巢低反应患者体外受精-胚胎移植结果的影响. 生殖医学杂志, 2015, 24(8):622-625.
