槐角多糖表征及抗氧化吸湿保湿性能研究
2017-03-23李彩霞高海宁
李彩霞 - 郑 雪 高海宁 - 张 勇
(1. 河西学院农业与生物技术学院,甘肃 张掖 734000; 2. 甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃 张掖 734000)
槐角又称槐实,为豆科植物国槐(SophorajaponicaL.)的果实,是一味常用中药[1]。陈明珠等[2]对槐角化学成分进行了研究,发现其含有黄酮、异黄酮、三萜皂苷、氨基酸、生物碱、磷脂和多糖等多种药理活性成分。目前国内外学者对槐角多糖研究已有报道,刘景东等[3]研究发现,槐角含有丰富的多糖;Ertan A等[4]对槐豆胶与卡拉胶的热相变协同作用进行了研究,发现槐豆胶与其他亲水胶体相互作用产生凝胶;卞云霞等[5]研究了槐豆多糖及其配合物的抑菌活性,结果显示不同的配合物对供试菌抑菌效果有差异,以上研究侧重于多糖与凝胶复配方面的报道,而未见多糖的抗氧化及保湿方面的研究。国槐资源丰富,其多糖含量高,因此有一定的研究价值。
天然多糖广泛存在于自然界中,是构成生命的四大基本物质之一,具有抗氧化、抗肿瘤、抗衰老、降血糖、抗辐射,调节人体免疫力等作用[6-8],同时又具有强吸水性、乳化性、高黏度性和成膜性[9],因此可以作为功能性添加剂,在医药、食品等领域中有广泛应用前景。
本试验以槐角果皮和种子为材料,采用双酶法从槐角果皮和种子中提取多糖,通过红外光谱对结构进行表征,并考察多糖对ABTS自由基、DPPH自由基、超氧阴离子自由基的清除作用及对亚铁离子的螯合能力,综合评价多糖的体外自由基清除活性,同时探讨多糖的吸湿和保湿性能,以期为槐角多糖在天然抗氧化剂和化妆品等领域的开发利用提供依据。
1 材料和方法
1.1 材料与试剂
槐角:采自河西学院,剥离果皮和种子,分别洗净、阴干、粉碎、过筛(60目),保存备用;
2,2-联氮-双(3-乙基苯并噻吡咯林-6-磺酸(ABTS)、菲洛嗪(Ferrozine)、二苯代苦味肼基 (DPPH):纯度≥99%,美国Sigma公司;
L-甲硫氨酸:分析纯,北京拜尔迪生物公司;
氯化硝基四氮唑蓝(NBT):分析纯,南京奥多福尼生物科技有限公司;
葡聚糖:纯度≥99%,国药集团化学试剂有限公司;
果胶酶:3.2 U/g,北京双旋微生物培养基制造厂;
纤维素酶:≥1 000 U/mg,北京奥博星生物技术有限公司;
正丁醇、氯仿等试剂:分析纯,上海中秦化学试剂有限公司。
1.2 仪器与设备
电子分析天平:AE200型,梅特勒-托利多国际贸易(上海)有限公司;
可见分光光度计:S-24型,上海棱光技术有限公司;
循环水式真空泵:SHZ-2000型,河南省巩义市英峪予华仪器厂;
数显恒温水浴锅:HH-4型,国华电器有限公司;
高速冷冻离心机:CR21GII型,日本日立公司;
冷冻干燥机:MiLLROCK型,美国米尔洛克公司;
旋转蒸发器:RE-2000A型,巩义市京华仪器有限责任公司;
酸度计:pH510型,安莱立斯仪器科技(上海)有限公司;
红外光谱仪:Nicolet iS50型,美国Thermo Scientific公司。
1.3 试验方法
1.3.1 槐角果皮和种子多糖的提取及含量测定
(1) 提取工艺流程:
原料→粉碎→石油醚脱脂→干燥→双酶法提取[以柠檬酸-柠檬酸钠缓冲液为溶剂,料液比1∶20 (g/mL),混合酶(纤维素酶∶果胶酶质量比1∶1)添加量0.5%,底物浓度5%,初始pH 4.8,酶解温度50 ℃,酶解时间1 h]→高温灭酶(80~90 ℃,10 min)→冷却至室温→离心(5 000 r/min,10 min)→上清液→减压浓缩(至原液体积的 1/10)→醇沉(浓缩液中加入3倍体积95%乙醇,静置过夜)→离心(5 000 r/min,5 min)→沉淀按1∶5 (g/mL)加入蒸馏水→加入 1/4 体积的Sevage试剂脱蛋白(3次)→醇沉(加入3倍体积95%乙醇,静置过夜)→离心(5 000 r/min,10 min)→沉淀冷冻干燥(-40~-47 ℃,压力17.42 Pa)→槐角果皮/种子多糖
(2) 多糖含量测定:根据文献[10]修改如下,准确称取105 ℃干燥至恒重的葡聚糖100 mg,溶解后定容于100 mL容量瓶中,并稀释成100 μg/mL葡聚糖标准溶液。精密吸取葡聚糖标准溶液0.00,0.20,0.40,0.60,0.80,1.00 mL用蒸馏水补充至2.00 mL,加入1 mL 6%苯酚,摇匀,然后加入5 mL 浓H2SO4,置于室温下反应20 min,冷却后于490 nm处测定吸光度,绘制标准曲线,并求得Y=0.005 8X+0.000 1(R2=0.999 2)的线性回归方程。
根据1.3.1方法提取多糖,稀释一定倍数后,精密吸取1 mL,按标准曲线制作方法操作,在490 nm处测定吸光度,按式(1)计算多糖的得率:
(1)
式中:
Y——多糖得率,%;
C——标准曲线上查得的多糖含量,μg;
V——多糖提取液总体积,mL;
N——样品的稀释倍数;
M——样品的重量,g;
VS——测定时所取溶液的毫升数,mL。
根据上述方法测定果皮和种子多糖粗提物中多糖含量,并计算其纯度。
1.3.2 红外光谱(IR)表征 取2 mg 左右干燥多糖,加入适量KBr 粉末研磨混匀后,压片,在波数4 000~400 cm-1内扫描果皮和种子多糖的红外光谱图。
1.3.3 多糖的抗氧化性测定
(1) 对ABTS自由基的清除作用测定:根据文献[11]修改如下,将2.00 mL稀释成一定质量浓度(种子:92.80~464.02 μg/mL;果皮:197.63~988.16 μg/mL)的多糖溶液和2.00 mL的ABTS混合为反应体系,2.00 mL蒸馏水和2.00 mL 的ABTS混合液为对照组,2.00 mL蒸馏水和2.00 mL 多糖溶液的混合液为空白组,将各组在暗处静置6 min,在734 nm处测定吸光度。以不同质量浓度的VC作阳性对照。按式(2)计算ABTS自由基的清除率。
(2)
式中:
R——清除率,%;
A0——对照组吸光值;
Ai——多糖溶液吸光值;
Aj——空白组吸光值。
(2) 对DPPH自由基的清除能力:根据文献[12]修改如下:将2.00 mL稀释一定质量浓度的槐角果皮(或种子)多糖溶液和2.00 mL的DPPH溶液(0.15 mmol/L的95%乙醇溶液)为测定组,2.00 mL蒸馏水和2.00 mL DPPH溶液为对照组,2.00 mL多糖溶液和2.00 mL 95%乙醇为样品空白组,摇匀,在室温下避光静置30 min,在517 nm波长下测定吸光度,以VC作阳性对照,DPPH自由基清除率按式(3)计算:
(3)
式中:
R——清除率,%;
A0——未加多糖溶液对照组吸光值;
Ai——加多糖溶液吸光值;
Aj——以95%乙醇代替DPPH溶液时的吸光值。
(3) 对超氧阴离子自由基的清除能力测定:参照文献[13],根据式(4)计算超氧阴离子自由基的清除率。
(4)
式中:
R——清除率,%;
A0——蒸馏水代替多糖的吸光值;
Ai——加入多糖溶液吸光值;
Aj——多糖溶液的本底吸光值。
(4) 对亚铁离子的螯合能力测定:根据文献[6],金属螯合率按式(5)计算:
(5)
式中:
R——螯合率,%;
A0——蒸馏水代替多糖溶液吸光值;
Ai——加多糖溶液的吸光值;
Aj——多糖溶液的本底吸光值。
1.3.4 吸湿保湿性能测定
(1) 槐角果皮和种子多糖的吸湿性:根据文献[6]修改如下,将200 mL的硫酸铵饱和溶液置于干燥器底部,使干燥器内的相对湿度为81%。准确称取充分干燥后的果皮多糖、种子多糖、甘油、壳聚糖各0.5 g于称量瓶,置于湿度和温度相对恒定的干燥器中并密封。放置3,15,19,28,39,45,50,67,76,90 h后,分别称量样品放置前后的质量,根据式(6)计算多糖的吸湿率。
(6)
式中:
A——吸湿率,%;
Wo——样品放置前质量,g;
Wn——样品吸水后质量,g。
(2) 槐角果皮和种子多糖的保湿性:根据文献[14]修改如下:在干燥器底部放入200 g 烘干的变色硅胶,准确称取充分干燥后的果皮多糖、种子多糖、甘油、壳聚糖各1 g置于内径30 mm恒重的称量瓶中,分别加入1 mL蒸馏水,充分摇匀,放入干燥器中并密封。放置6,15,21,27,39,50,70 h,分别称量样品放置不同时间的水分质量(Hn)和添加水分质量(Ho),根据式(7)计算多糖的保湿率。
(7)
式中:
R——保湿率,%;
Ho——添加的水分质量,g;
Hn——放置不同时间的水分质量,g。
1.4 统计方法
所有的试验均3次重复,试验数据采用Excel 2003软件进行统计分析、Origin 9软件进行作图。
2 结果与分析
2.1 槐角果皮和种子中多糖含量的比较
通过双酶法提取槐角果皮和种子多糖,采用苯酚硫酸法测定槐角果皮和种子中多糖的得率分别为24.7%,11.6%,该数据表明槐角种子和果皮中含有丰富的多糖,且果皮中多糖含量高于种子。并测定了果皮和种子多糖粗提物中多糖的含量,分别为72.39%,76.95%,从结果来看,种子多糖的纯度高于果皮多糖的。
2.2 红外光谱(IR)分析
由图1可知,槐角两部位多糖均有多糖的特征吸收峰,3 420 cm-1和3 300 cm-1处是多糖中O—H的伸缩振动引起的吸收峰,2 970 cm-1是甲基或亚甲基的C—H伸缩振动所形成的吸收峰[15],1 610 cm-1是—OH 的弯曲振动的吸收峰,1 410 cm-1和1 300 cm-1处是C—O 的变形振动的吸收峰[16],1 140 cm-1左右和1 080 cm-1左右为吡喃型甘露糖和半乳糖上伯、仲羟基的C—O的振动吸收峰[17],893 cm-1是吡喃糖C—H变角振动的吸收峰,果皮多糖在893 cm-1和839 cm-1均有吸收,说明该糖是β-型和α-型2种糖苷键吡喃糖对称振动所产生的吸收峰[18]。
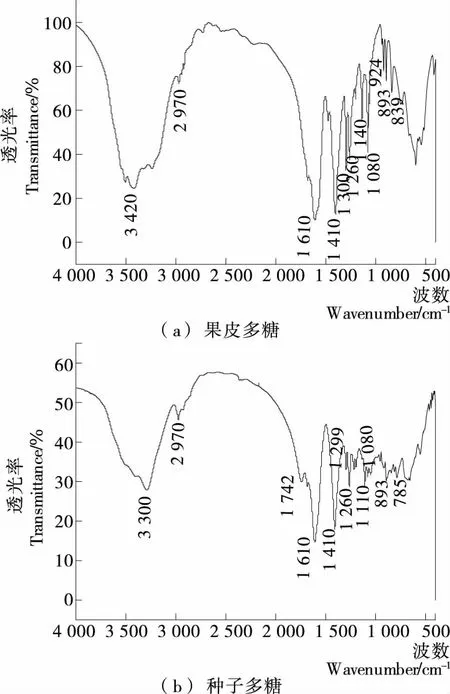
图1 槐角果皮和种子多糖红外光谱图Figure 1 Infrared spectrogram of polysaccharides of pericarp and seed from Sophora japonica L.
2.3 多糖的抗氧化活性
2.3.1 槐角果皮和种子多糖对ABTS自由基的清除能力
ABTS是一种水溶性的自由基,经氧化后生成蓝绿色的阳离子ABTS自由基,向其中加入样品,如果该样品含有抗氧化物质,能够提供供氢体,则会褪色。在734 nm下吸光度降低,其降低程度与抗氧化物质的抗氧化活性有关,通过光吸收的下降程度可反映该物质抗氧化活性的强弱[11,19]。由图2、3可知,槐角果皮、种子多糖和VC溶液均对ABTS自由基有一定的清除能力,其清除率均随浓度增大而增大。果皮多糖、种子多糖和VC在质量浓度分别为247.04,232.01,12.50 μg/mL 时对ABTS自由基的清除率分别为40.05%,71.83%,86.92%,表明多糖对ABTS自由基有很好的清除能力但弱于VC。
2.3.2 槐角果皮和种子多糖对DPPH自由基的清除作用
DPPH自由基在517 nm处有最大吸收,当反应体系中含有抗氧化物时,抗氧化物提供一个电子与其配对结合,使DPPH自由基的特征紫色消失,其吸收值降低,样品的抗氧化活性根据DPPH自由基的清除量来评价[20]。由图4、5可知,不同部位的多糖对DPPH自由基的清除能力不同,槐角果皮和种子多糖的质量浓度分别为494.08,464.02 μg/mL时,清除率分别为15.69%,54.71%,说明种子多糖对DPPH自由基的清除效果优于果皮多糖的。VC在25 μg/mL时清除率为86.24%,表明2种多糖的清除效果不及VC。
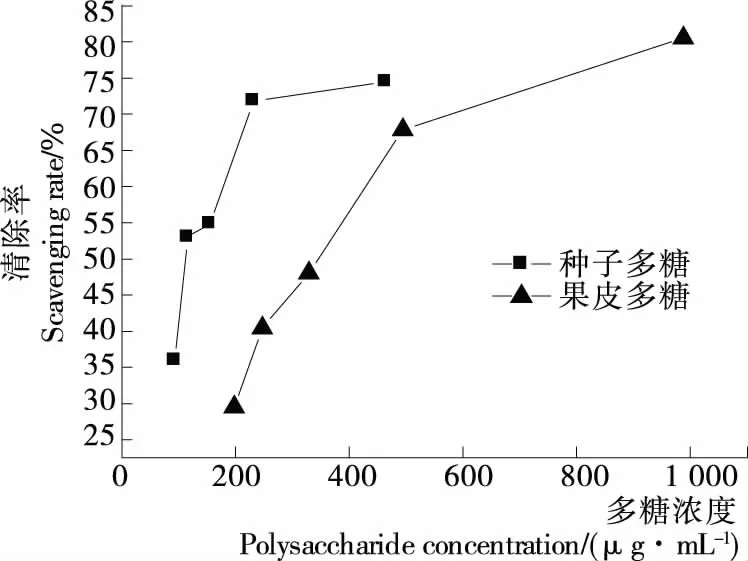
图2 槐角果皮、种子多糖对ABTS自由基的清除作用
Figure 2 Scavenging activity of polysaccharides of sophora fructus peel, seeds on ABTS radical
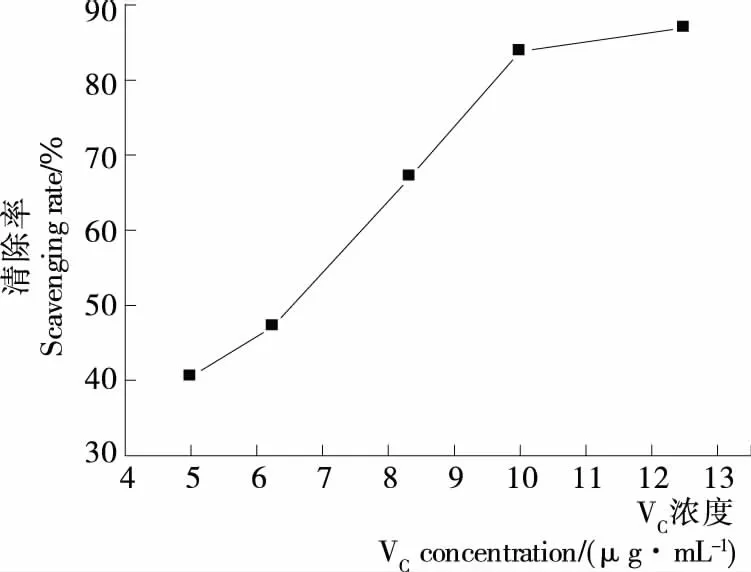
图3 VC对ABTS自由基的清除作用Figure 3 Scavenging activity of VC on ABTS radical
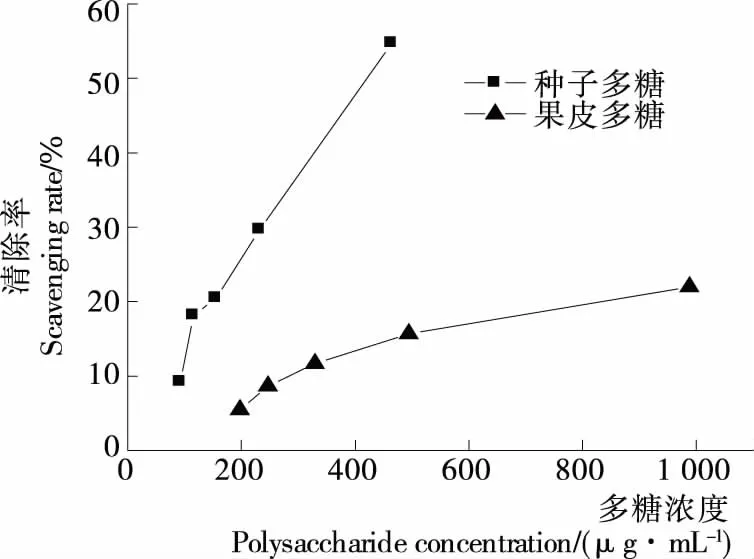
图4 槐角果皮、种子多糖对DPPH自由基的清除作用
Figure 4 Scavenging activity of polysaccharides of sophora fructus peel, seeds on DPPH radical
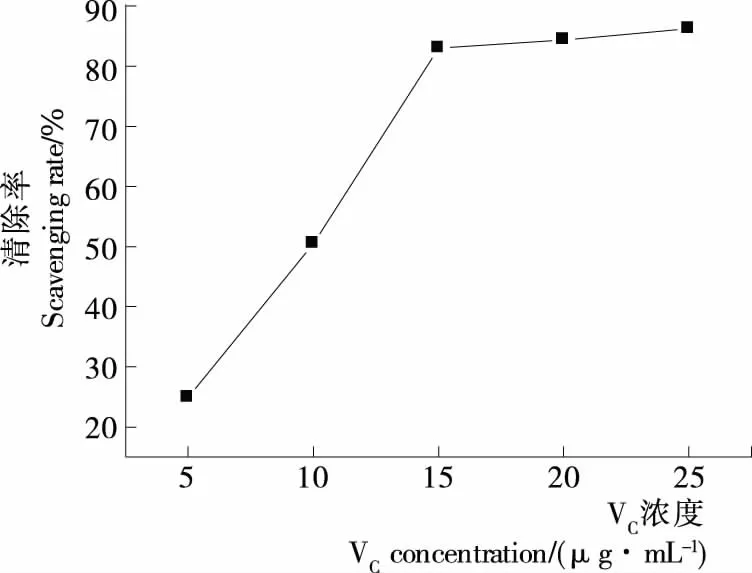
图5 VC对DPPH自由基的清除作用Figure 5 Scavenging activity of VC on DPPH radical
2.3.3 槐角果皮和种子多糖对超氧阴离子自由基的清除作用 由图6、7可知,随着多糖和VC质量浓度的增加,对超氧阴离子自由基的清除率均在增高,在测定范围内呈量效关系。在清除率为35%时,槐角果皮和种子多糖的质量浓度分别为494.08,154.67 μg/mL,而VC溶液在200 μg/mL时清除率为29.76%,说明对超氧阴离子自由基的清除能力种子多糖最优,VC次之,果皮多糖相对最弱。
2.3.4 槐角果皮和种子多糖对亚铁离子的螯合能力 螯合某些金属离子是抗氧化活性的一个重要机制,后者催化氢过氧化物的降解以及Fenton类反应,从而抑制了氧化损伤,在天然产物抗氧化活性评价中亚铁离子螯合能力的测定有着非常重要的意义[21]。由图8、9可知,随着果皮和种子多糖及EDTA质量浓度的增大,对亚铁离子的螯合率逐渐增大。当螯合率为31%时,槐角果皮、种子多糖的质量浓度分别为329.39,154.67 μg/mL,而当浓度为200 μg/mL时,EDTA螯合率达98.73%,对亚铁离子的螯合能力的大小顺序为EDTA>种子多糖>果皮多糖。

图6 槐角果皮、种子多糖对超氧阴离子自由基的清除作用
Figure 6 Scavenging activity of polysaccharides of sophora fructus peel, seeds on superoxide anion radical

图7 VC对超氧阴离子自由基的清除作用Figure 7 Scavenging activity of VC on superoxide anion radical
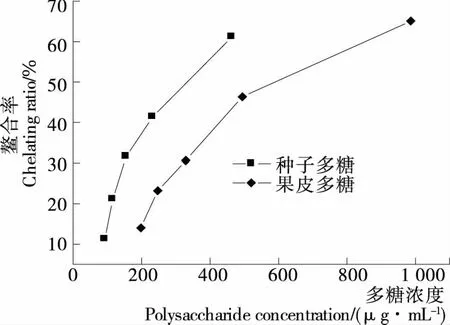
图8 槐角果皮、种子多糖对亚铁离子的螯合能力
Figure 8 Chelating ability of polysaccharides of sophora fructus peel, seeds on ferrous ion

图9 EDTA对亚铁离子的螯合能力Figure 9 Chelating ability of EDTA on ferrous ion chelating ability
2.4 吸湿保湿能力
2.4.1 槐角果皮和种子多糖的吸湿性 由图10可知,在相对湿度为81%的环境中,随着吸湿时间的延长,2种多糖、壳聚糖、甘油的吸湿率逐渐增大。在最初20 h内,多糖的吸湿率增加幅度较大,随后槐角果皮、种子多糖及壳聚糖逐渐达到饱和状态,三者吸湿性能基本一致。在90 h时槐角果皮多糖、种子多糖,壳聚糖、甘油的吸湿率分别为12.31%,12.99%,12.38%,56.09%,说明多糖有一定的吸湿性,但弱于甘油。

图10 吸湿率随时间变化的曲线Figure 10 Changes of moisture absorption rate for each sample with time changing
2.4.2 槐角果皮和种子多糖的保湿性 置于干燥器底部的变色硅胶吸附环境中的水分,使其自身颜色由蓝变红,根据多糖水分降低的程度,确定其保湿性。由图11可知,在硅胶环境中,各试样的保湿率呈下降趋势,在27 h时降幅均稍有减小,在70 h的监测范围内,槐角果皮多糖、种子多糖、壳聚糖、甘油的保湿性分别为31.73%,31.27%,14.83%,58.44%。说明槐角果皮和种子多糖保湿性能差异不大,二者保湿率低于甘油,而高于保湿剂壳聚糖,均表现出良好的保湿性能。
3 结论
本试验以槐角果皮和种子作为研究对象,采用双酶法提取多糖,测得槐角果皮中多糖(24.7%)的得率高于种子的(11.6%),通过酶法提取的槐角多糖高于文献[22]报道的水浴加热回流所提取的,说明酶法有利于多糖的提取。本研究结果表明,果皮和种子粗提取物中,多糖含量分别为72.39%和76.95%,说明粗多糖中含有一定的杂质,需要更进一步分离纯化。对多糖进行红外扫描,均具有多糖的特征吸收峰,种子多糖具有β-吡喃糖苷键,果皮多糖具有β-型和α-型2种糖苷键。
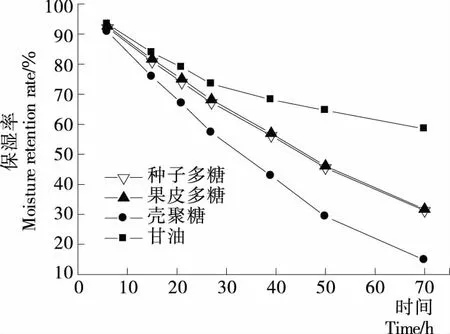
图11 保湿率随时间变化的曲线Figure 11 Changes of moisture retention rate for each sample with time changing
植物不同部位不同种类的多糖功能各不相同,生物活性也不同[23-24]。从试验结果可以看出,种子多糖对ABTS自由基、DPPH自由基、超氧阴离子自由基、亚铁离子螯合力均高于果皮多糖,可能与糖的种类和结构有关,需要更进一步研究。多糖对自由基清除作用表明,种子多糖的清除活性优于果皮多糖,对DPPH自由基和超氧阴离子自由基的半数清除浓度分别为417.76,397.71 μg/mL,与文献[25]数据对比说明种子多糖具有很好的自由基清除活性。
槐角果皮和种子多糖的吸湿保湿性能结果显示,在相同的监测时效内,槐角果皮多糖、种子多糖和壳聚糖三者的吸湿率基本一致,且均低于甘油;保湿性能方面,在39 h时槐角果皮多糖和种子多糖及甘油的保湿率均高于50%,均低于甘油而高于壳聚糖,可见,槐角果皮多糖和种子多糖具有良好的保湿作用。综上所述,槐角果皮和种子多糖在食品中可以作为增稠剂、保水剂,在化妆品领域可以作为抗氧化剂和保湿剂。本研究仅对粗多糖清除几种自由基的能力和吸湿保湿性能进行了研究,后续将对其有效成分进行分离、纯化,为国槐产品的开发利用提供理论依据。
[1] 国家药典委员会. 中华人民共和国药典: 第一部[M]. 北京: 中国医药科技出版社, 2015: 355.
[2] 陈明珠, 申艳艳, 赵越, 等. 槐角黄酮的体外抗氧化活性研究[J]. 食品工业科技, 2013, 34(4): 94-96.
[3] 刘景东, 刘惠敏, 王憬, 等. 槐角多糖含量测定方法的研究[J]. 白求恩军医学院学报, 2007, 5(3): 172-174.
[4] ERTAN A, SELIM K, ONDER P. Synergistic effect of the locust bean gum on the thermal phase transitions of k-carrageenan gels[J]. Food Hydrocolloids, 2009, 23(2): 451-459.
[5] 卞云霞, 付蕊, 刘英超. 槐豆多糖及其配合物的抑菌性研究[J]. 大连民族学院学报, 2009, 11(9): 70-71.
[6] 陈刚, 郭晓蕾, 宝丽. 银耳, 麦冬, 燕麦多糖的抗氧化活性及吸湿保湿性能研究[J]. 中华中医药学刊, 2013, 31(1): 212-214.
[7] 丁保金, 金丽琴, 吕建新. 多糖的生物活性研究进展[J]. 中国药学杂志, 2004, 39(8): 561-564.
[8] 赵琪, 赵利, 杨玉娈, 等. 河蚬多糖分离纯化及抗氧化、抗肿瘤活性研究[J]. 食品与机械, 2017, 33(4): 127-132, 138.
[9] 张斌, 张璐, 李沙沙, 等. 植物多糖与化妆品的联系[J]. 辽宁中医药大学学报, 2013, 15(1): 109-111.
[10] 宋慧, 苗敬芝, 董玉玮. 双酶法提取大豆多糖及其抗氧化性研究[J]. 中国食品添加剂, 2012(5): 89-93.
[11] 李彩霞, 李复兴, 李鹏, 等. 国槐叶黄酮的抗氧化活性研究[J]. 天然产物研究与开发, 2013, 25(5): 676-680.
[12] GHAVI P P. The extraction process optimization of antioxidant polysaccharides from Marshmallow (AlthaeaofficinalisL.) roots[J]. International Journal of Biological Macromolecules, 2015, 75: 51-57.
[13] 李合生. 现代植物生理学[M]. 北京: 高等教育出版社, 2002: 32-34.
[14] 王凌, 孙利芹, 赵小惠. 一种微藻多糖的理化性质及抗氧化保湿活性[J]. 精细化工, 2012, 29(1): 20-25.
[15] 张华锋, 张杰, 刘炯, 等. 首乌藤多糖的分离纯化及初步结构解析[J]. 中国实验方剂学杂志, 2013, 19(18): 5-8.
[16] 于明, 朱文学, 郭菡, 等. 响应面分析法优化超声提取槐豆胶工艺[J]. 食品科学, 2013, 34(2): 114-118.
[17] 刘春兰, 徐斯凡. 少数民族地区药用植物多糖的化学与药理[M]. 北京: 中央民族大学出版社, 2008: 39-41.
[18] 张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1998: 196-198.
[19] 魏银花, 申迎宾, 王立, 等. 紫米多酚提取工艺及抗氧化活性研究[J]. 食品与机械, 2013, 29(3): 111-115.
[20] 范现丽, 王高, 王宏, 等. 香桃木叶片粗多酚的抗氧化活性的研究[J]. 植物研究, 2009, 29(3): 375-379.
[21] MANIAN R, ANUSUYA N, SIDDHURAJU P, et al. The antioxidant activity and free radical scavenging potential two different solvent extracts ofCamelliasinensis(L)O.kuntz,FicusbengalensisL. andFicusracemosaL[J]. Food Chemistry, 2008, 107(3): 1 000-1 007.
[22] 方艳夕, 周丽丽, 叶强, 等. 槐角多糖及其水解物中单糖的检测[J]. 安徽科技学院学报, 2017, 31(1): 50-53.
[23] 肖锡湘, 上官新晨. 多糖的应用研究[J]. 中国食物与营养, 2006, 12(5): 21-22.
[24] 王阳, 霍秀文, 周翼虎, 等. 不同品种山药块茎多糖和黏液质多糖对自由基清除能力的研究[J]. 辽宁大学学报, 2012, 39(4): 354-360.
[25] ZHANG Ling-wen, JI Hong-fang, DU Ai-lin, et al. Characterization and antioxidant properties of polysaccharides from flowers ofSophorajaponicaL. (Huaihua) [J]. Journal of Medicinal Plants Research, 2013, 7(21): 1 543-1 549.
