肝X受体激动剂GW3965对人结肠癌细胞奥沙利铂耐药的逆转作用及机制
2017-03-23谭湘洲王然文俏程莫砚群吴瑞平陈志康
谭湘洲,王然,文俏程,莫砚群,吴瑞平,陈志康
(中南大学湘雅医院 结直肠肛门外科,湖南 长沙 410008)
结直肠癌早已被列入威胁人类健康的恶性肿瘤行列,其在全球范围内的发病率位居十大恶性肿瘤的第3位[1]。近年来,不仅结直肠癌新发病例逐年增加,且有20%~25%的新发病例在确诊时已有远处转移[2]。外科手术治疗技术虽进步飞速,但对于进展期结直肠癌的治疗仍需依靠联合手术、化疗、放疗等全身综合治疗。奥沙利铂(oxaliplatin,OXA),作为第3代铂类药物,目前已成为进展期结肠癌化疗的一线药物,它通过与DNA共价结合形成铂类-DNA加和物,破坏DNA的复制和转录,达到抑制肿瘤细胞生长的作用[3]。尽管如此,进展期结直肠癌患者对OXA的初始有效率也仅有20%~30%,所以在目前的化疗方案中,大多采用联合给药方案,以提高有效率,降低药物毒副反应。然而随着治疗的进行,进展期结肠癌患者对OXA逐步产生继发性耐药而出现化疗失败[4]。因此,如何有效逆转结直肠癌细胞对OXA的耐药,提高其对OXA的敏感性,是临床亟待解决的难题。
自噬,是细胞在多种生理及病理生理条件下,通过动态改变亚细胞膜形态使得胞内细胞器和蛋白降解的分解代谢过程。目前已证实,包括结直肠癌细胞在内的多种肿瘤细胞可通过自噬获得耐药性从而躲避化疗药物的损伤作用[5]。
肝X受体(liver x receptor,LXR),作为核受体家族的成员,在胆固醇、脂肪酸及糖类代谢的过程中起到了重要的调节作用。近年来,其抗肿瘤作用正被逐步发现。LXR激动剂GW3965已被证实可通过阻滞细胞周期抑制结肠癌细胞HCT-116的体外生长[6],本研究致力于LXR激动剂对于结肠癌细胞耐OXA细胞HCT-116/L-OHP的化疗敏感性及自噬水平的影响,旨在揭示其可能的作用机制,为临床化疗增敏提供依据。
1 材料与方法
1.1 实验材料与仪器
细胞:人结肠癌细胞株HCT116购自中南大学湘雅中心实验室。主要试剂:LXR激动剂GW3965购自美国Sigma公司。注射用OXA购自Selleck公司,CCK-8试剂盒购自日本株式会社同仁化学研究所;兔抗人ATG-5多克隆抗体、兔抗人Beclin-1多克隆抗体、兔抗人LC3单克隆抗体、兔抗人p62单克隆抗体购自美国Abcam公司、鼠抗人GAPDH多克隆抗体购自上海康成公司;羊抗兔和羊抗鼠二抗(荧光标记)购自美国Sigma公司。实验仪器:超净工作台、CO2恒温培养箱、高压蒸汽灭菌锅、-80 ℃冰箱、显微镜、天平、高速低温离心机、恒温水浴锅、电泳仪、电泳槽、凝胶成像仪等仪器。
1.2 实验方法
1.2.1 细胞培养及构建 采用OXA药物浓度持续递增诱导HCT116细胞,首先将2.5 µmol/L OXA加入培基中培养,连续4个周期,逐渐增加OXA浓度(2.5、5、10、20、30、40、45 µmol/L),直至细胞可在含45 µmol/L OXA的培养基中生长,此时HCT116/L-OHP细胞构建成功。分别将HCT-116、HCT-116/L-OHP细胞加入10% FBS的RPMI1640培养基,置入37 ℃、5% CO2恒温培养箱中培养。根据细胞生长状态36~48 h换液。细胞铺满80%培养瓶时,常规胰酶消化、离心,传代培养。
1.2.2 细胞生长曲线测定 取对数生长期的HCT116、HCT116/L-OHP细胞,胰酶消化后制备细胞悬液,按照5 000/孔接种于96孔板,每组均设4个孔,采用CCK-8法连续7 d测定各组的吸光度(OD值),绘制生长曲线。
1.2.3 细 胞 对 OXA耐 受 性 变 化 ⑴ 测 定HCT116、HCT116/L-OHP对OXA的耐受性变化:取对数生长期的HCT116/L-OHP细胞,胰酶消化后制备细胞悬液,分别进行细胞计数,按照5 000个/孔将2种细胞接种于96孔板,实验组加入不同浓度的 OXA(2.5、5、10、20、40、80、160、320 µmol/L),对照组加等数量细胞及等体积完全培养基,空白组仅加等体积的完全培养基,每组均设3个复孔,培养48 h后加入10% CCK8 100 µL, 温 箱 孵 育 1.5 h 后 用 全 自 动 酶 标 仪 在450 nm波长测定各孔吸光度OD值,实验重复3次。采用SPSS 21.0软件计算出各组细胞半数抑制浓度(IC50),抑制率(%)=1-(实验组平均OD值空白组平均OD值)/(对照组平均OD值-空白组平均OD值)×100%;耐药指数(resistance index,RI)=耐药细胞株IC50/亲本细胞IC50。⑵ 测定不同浓度GW3965处理后HCT-116/LOHP对OXA的耐药性变化:取对数生长期的HCT-116、HCT116/L-OHP细胞,经胰酶消化后制备细胞悬液,进行细胞计数后,按10 000个/孔接种于96孔板,待细胞贴壁后,分别以含不同浓度GW3965(10、20、30 µmol/L)+DMSO 0.01% 的完全培养基培养HCT116/L-OHP,同时设置空白对照组,其内只加入 DMSO 0.01%,GW3965作用 48 h后,各组细胞加入不同浓度的OXA(0、2.5、5、10、20、40、80、160 µmol/L),每组均设 3个复孔,培养48 h 后加入 10% CCK8 100 µL,温箱孵育 1.5 h 后用全自动酶标仪在450 nm波长测定各孔吸光度OD值,实验重复3次。按照上法计算出各组IC50、RI、逆转倍数。其中逆转倍数=实验组IC50/空白对照组IC50。
1.2.4 细胞蛋白表达水平的检测 取对数生长期的HCT-116/LOHP细胞,经胰酶消化后制备细胞悬液,进行细胞计数后,分别接种于4个相同的细胞培养瓶中,采用不同浓度(0、10、20、30 μmol/L)的GW3965处理48 h后,各组细胞常规培养至对数期后用RIPA裂解液提取细胞总蛋白。采用BCA法检测蛋白浓度。取50 μg蛋白质样品于100 ℃加热变性后上样,经8%SDS-PAGE 电泳分离后,依次进行转膜、封闭、一抗、二抗孵育。其中兔抗人ATG-5多克隆抗体1:10 000稀释,兔抗人Beclin-1多克隆抗体1:2 000稀释,兔抗人LC3单克隆抗体1:3 000,兔抗人p62单克隆抗体1:1 000,兔抗人 GAPDH 抗体 1:10 000稀释,羊抗兔二抗 1:10 000稀释。采用 Bio-Rad ChemiDoc MP凝胶成像分析系统显影、拍照。用Image J软件进行条带灰度分析,以各目的蛋白与内参(GAPDH)的灰度比值表示各目的蛋白的相对表达量。
1.3 统计学处理
采用SPSS 21.0软件对数据进行分析,计量资料用均数±标准差()表示,3组及以上样本用Kuskal-WallisH检验进行分析,两样本分布是否有差异性用Mann-WhitneyU检验,P<0.05为差异有统计学意义。
2 结 果
2.1 人结肠癌OXA耐药细胞株HCT-116/L-OHP的建立
采用OXA药物浓度持续递增诱导的方法,历时6个月获得可耐受45 µmol/L OXA浓度并正常生长的人结肠癌OXA耐药HCT116/L-OHP细胞,且反复传代、冻存、复苏后,复测其RI不变。
HCT116细胞、HCT116/L-OHP细胞的生长曲线见图1,在第1~4天时H C T 1 1 6细胞与HCT116/L-OHP细胞的增殖速度无统计学差异(均P>0.05),但在第5~7天,HCT116细胞的增殖速度明显高于HCT116/L-OHP细胞(均P<0.05)。
不同浓度的OXA对HCT116细胞抑制率均明显高于HCT116/L-OHP细胞(均P<0.05)(图2)。由概率单位回归分析求出HCT116细胞、HCT116/L-OHP细胞48 h的IC50分别为(10.05±0.73)µmol/L、(244.99±10.33)µmol/L,HCT116/L-OHP的RI为24.45±1.66,两组IC50差异有统计学意义(P<0.05)。
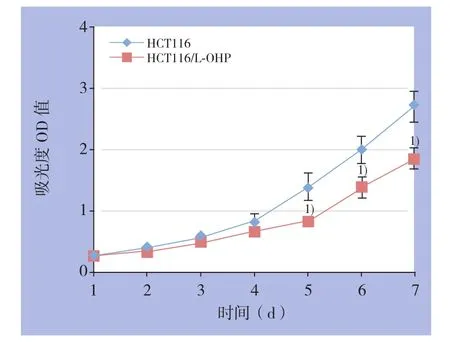
图1 HCT116细胞与HCT116/L-OHP细胞的生长曲线1)与HCT116细胞比较,P<0.05Figure 1 The growth curves of HCT116 and HCT116/L-OHP cells 1) P<0.05 vs. HCT116 cells

图2 不同浓度OXA对HCT116细胞与HCT116/L-OHP细胞的抑制情况 1)与HCT116细胞比较,P<0.05Figure 2 The inhibitory effects of different concentrations of OXA on HCT116 and HCT116/L-OHP cells 1) P<0.05 vs. HCT116 cells
2.2 LXR激动剂GW3965对HCT116/L-OHP细胞OXA耐药的逆转作用
CCK8检测结果发现,不同浓度(10、20、30 µmol/L)GW3965作用于HCT116/L-OHP细胞48 h,并经48 h连续OXA处理后,细胞的生长增殖均受到明显抑制,并呈浓度依赖性,与对照组比较,差异均有统计学意义(均P<0.05)(图3)。
不同浓度(10、20、30 µmol/L)GW3965作用后HCT116/L-OHP细胞对OXA的IC50、RI较对照组(0 µmol/L GW3965)明显降低,且随着GW3965的浓度升高而降低更加明显(均P<0.05)。逆转倍数也随着GW3965浓度增加而递增(表1)。
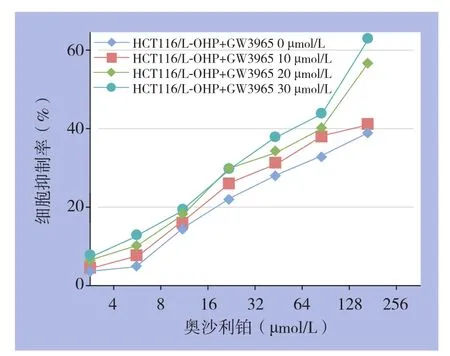
图3 不同浓度GW3965对HCT116/L-OHP细胞OXA耐药的逆转作用Figure 3 The reversal effects of different concentrations of GW3965 on OXA resistance in HCT116/L-OHP cells
表1 不同浓度GW3965作用后HCT116/L-OHP细胞对OXA的IC50、RI、逆转倍数(±s)Table 1 The IC50,RI and reversal fold to OXA in HCT116/L-OHP cells after exposure to different concentrations of GW3965 (±s)

表1 不同浓度GW3965作用后HCT116/L-OHP细胞对OXA的IC50、RI、逆转倍数(±s)Table 1 The IC50,RI and reversal fold to OXA in HCT116/L-OHP cells after exposure to different concentrations of GW3965 (±s)
注:1)与 0 µmol/L GW3965 组比较,P<0.01 Note:P<0.01 vs. 0 µmol/L GW3965 group
2.3 LXR激动剂GW3965对HCT-116/LOHP细胞自噬水平的影响
Western blot法检测结果显示,不同浓度GW3965(10、20、30 μmol/L)处理人结肠癌耐OXA细胞48 h后,自噬相关蛋白ATG-5、Beclin-1的表达水平随GW3965浓度的增加而下降,而p62的表达水平随GW3965浓度的增加上升,与对照组相比较,差异均有统计学意义(均P<0.05)(图4)。脂化后与自噬体膜结合的LC3-II蛋白的表达水平较对照组明显升高,且呈浓度依赖性,差异均有统计学意义(均P<0.05)(图5)。

图5 LC3蛋白表达水平检测Figure 5 Determination of protein expressions of LC3
3 讨 论
GW3965是一种LXR的配体,可激活LXR信号通路,是某些病理过程如血管性疾病、代谢性疾病、神经退行性病变等的潜在治疗靶点。Pommier等[7]的研究发现,在人类前列腺癌中,LXR激动剂可调控mTOR信号通路的上游信号PI3K/AKT等来发挥其抑制肿瘤的作用。Vedin等[8-9]的研究表明LXR配体处理后的人结肠癌细胞的增殖受到抑制,SKP2(S-phase kinase-associated protein 2)的转录及蛋白水平被下调,同时周期蛋白依赖性激酶(cyclin-dependent kinases,CDKs)及原癌基因MYC的表达水平也有所下调。其中SKP2、CDKs以及MYC与肿瘤细胞的周期密切相关。这表明LXR与生长因子信号通路之间的关系,可能是调控细胞周期的上游信号通路。LXR配体也可能通过调节细胞代谢基因来发挥其抗肿瘤的作用,Fukuchi等[10]的研究表明在前列腺癌中,ATP结合的盒转运子A1(ATP-binding cassette sub-family A member 1,ABCA1)的表达降低,ABCA1低表达的前列腺癌细胞可促进细胞增殖,ABCA1作为LXR的靶基因,其功能为促进细胞内游离胆固醇和磷脂的流出,在胆固醇的逆转运和高密度脂蛋白的生成有着重要的作用。这表明LXR信号可通过ABCA1来调控肿瘤细胞增殖。越来越多的证据表明LXR可通过改变细胞脂类代谢、抑制细胞增殖以及诱导细胞凋亡而发挥重要的抑瘤作用[11-13]。本研究表明LXR激动剂GW3965能够逆转人结肠癌耐OXA细胞株HCT116/L-OHP对OXA的耐药性,从而增加化疗药物OXA对耐药细胞株的抑瘤作用,并且随着GW3965的浓度增加,其抑瘤作用越强。该结果提示GW3965可能是一种潜在的化疗增敏剂,从而增加OXA等化疗药物的抗肿瘤作用。
大多数肿瘤患者化疗失败的首要原因是因为获得性耐药的产生[14]。已知的结肠癌化疗耐药的主要机制包括慢性缺氧[15]、上皮间质转化[16]、CpG岛甲基化[17]、错配修复基因的缺失[18]、细胞亚群存在[19]、KRAS及P53基因突变[20-21]等。其中细胞自噬也是导致结肠癌耐药性的机制之一。多项研究已证实,自噬在肿瘤的发生、发展中起着重要作用,研究者们发现在胰腺癌、食管癌[23]和宫颈癌[24]等肿瘤细胞的耐药性随着自噬活性的升高而增加,而通过基因敲除、沉默自噬相关蛋白如Beclin-1、给予自噬抑制剂3-MA等途径抑制自噬后,肿瘤细胞对化疗的敏感性均显著增强[24-26]。而在结肠癌细胞中,Liu等[27]也发现在使用不同浓度的OXA处理结肠癌细胞后,其自噬水平随着OXA浓度的增加而升高,即OXA可通过诱导结肠癌细胞自噬,使癌细胞免受药物毒性作用。自噬相关的调控因子及信号通路主要包括:mTOR信号通路、Beclin1相关调控途径、Atg蛋白、P53、自噬相关蛋白LC3等。DeYoung等[28]研究表明,作为LXR信号通路相关分子Redd1可通过激活抑瘤蛋白TSC1/2而下调mTOR信号通路的活性。秦溶等[6]的研究也表明,LXR激动剂GW3965能抑制人结肠癌HCT116和LoVo细胞的增殖,其机制可能与AMPK以及mTOR信号转导通路有关。其中mTOR作为细胞生长的中心调节因子,是多条调节细胞自噬信号通路的重要汇聚点[29]。本研究表明,LXR激动剂GW3965作用后的人结肠癌耐OXA细胞株的自噬相关蛋白Atg5、Beclin1的相对蛋白表达水平降低,而自噬相关蛋白p62的相对蛋白表达水平增高,该结果表明,GW3965作用后的人结肠癌耐OXA细胞株的自噬活性降低,其机制可能与mTOR信号通路、Beclin1相关调控途径、ATG蛋白等相关信号通路有关。但有趣的是,自噬相关蛋白LC3-II的表达水平在GW3965作用后反而增高。LC3为一种微管相关蛋白,是自噬体膜上的标记蛋白,细胞内存在两种形式,即LC3-I和LC3-II。当自噬体形成时,LC3-I则通过剪切以及泛素化加工修饰,并与磷脂酰乙醇胺(PE)偶联,形成膜结合形式的LC3-II,定位于自噬体内外膜上。Ichimura等[30-31]研究认为,LC3-II水平的升高代表着自噬体结构的增加,即细胞内自噬水平的提高。显然这种结果与Atg5、Beclin1及p62提示的自噬活性降低完全相反。这种现象的发生可能是由于自噬溶酶体降解功能下降或者自噬体与溶酶体融合迟缓所导致的。自噬是一个动态变化的过程,而自噬体也仅仅只是整个自噬通路过程中的一个中间结构,该种情况下的LC3-II的表达并不能真实反映其自噬水平。
综上所述,本研究证实GW3965可以提高人结肠癌细胞耐药株对OXA的化疗敏感性,同时降低其自噬水平,提示GW3965可能通过抑制细胞自噬蛋白水平逆转人结肠癌耐OXA细胞HCT116/L-OHP的耐药性,其机制可能与mTOR信号转导通路、Beclin-1相关调控途径以及ATG蛋白等有关。接下来,可进一步通过验证揭示GW3965增加结肠癌细胞化疗敏感性的机制与细胞自噬的联系,以期为结肠癌化疗耐药这一临床难题出谋献计。
[1]Bardelli A1,Siena S.Molecular mechanisms of resistance to cetuximab and panitumumab in colorectal cancer[J]J Clin Oncol,2010,28(7):1254–1261.doi:10.1200/JCO.2009.24.6116..
[2]Gourdier I,Del Rio M,Crabbé L,et al.Drug speci fi c resistance to oxaliplatin is associated with apoptosis defect in a cellµLar model of colon carcinoma [J].FEBS Lett,2002,529(2/3):232–236.
[3]Saif MW1,Choma A,Salamone SJ,et al.Pharmacokinetically guided dose adjustment of 5-fluorouracil:a rational approach to improving therapeutic outcomes[J].Journal of the National Cancer Institute,2009,101(22):1543–52.
[4]Goldberg RM,Sargent DJ,Morton RF,et al.A randomized controlled trial of fluorouracil plus leucovorin,irinotecan,and oxaliplatin combinations in patients with previously untreated metastatic colorectal cancer[J].J Clin Oncol,2004,22(1):23–30.
[5]Liu L,Yang M,Kang R,et al.HMGB1-induced autophagy promotes chemotherapy resistance in leukemia cells[J].Leukemia,2011,25(1):23–31.doi:10.1038/leu.2010.225.
[6]秦溶,李薇薇,徐琛莹,等.肝X受体激动剂GW3965对人结肠癌细胞增殖的抑制作用[J].诊断学理论与实践,2014,13(2):166–170.doi:10.3969/j.issn.1671–2870.2014.02.012.Qin R,Li WW,Xu CY,et al.Inhibition of human colorectal cancer cell proliferation by liver X receptors agonist GW3965[J].Journal of Diagnostics Concepts Practice,2014,13(2):166–170.doi:10.3969/j.issn.1671–2870.2014.02.012.
[7]Pommier AJ,Alves G,Viennois E,et al.Liver X Receptor activation downregulates AKT survival signaling in lipid rafts and induces apoptosis of prostate cancer cells [J].Oncogene,2010,29(18):2712–2723.doi:10.1038/onc.2010.30.
[8]Vedin LL,Gustafsson JÅ,Steffensen KR.The oxysterol receptors LXRalpha and LXRbeta suppress proliferation in the colon [J].Mol Carcinog,2013,52(11):835–844.doi:10.1002/mc.21924.
[9]Lo Sasso G,Bovenga F,Murzilli S,et al.Liver X receptors inhibit proliferation of human colorectal cancer cells and growth of intestinal tumors in mice[J].Gastroenterology,2013,144(7):1497–1507.doi:10.1053/j.gastro.2013.02.005.
[10]Fukuchi J,Hiipakka RA,Kokontis JM,et al.Androgenic suppression of ATP-binding cassette transporter A1 expression in LNCaP human prostate cancer cells[J].Cancer Res,2004,64(21):7682–7685.
[11]Pencheva N,Buss CG,Posada J,et al.Broad-spectrum therapeutic suppression of metastatic melanoma through nuclear hormone receptor activation[J].Cell,2014,156(5):986–1001.doi:10.1016/j.cell.2014.01.038.
[12]Wang Q,Ma X,Chen Y,et al.Identi fi cation of interferon-gamma as a new molecular target of liver X receptor[J].Biochem J,2014,459(2):345–354.doi:10.1042/BJ20131442.
[13]Venteclef N,Ferré P.Liver X receptor:from metabolism to cancer[J].Biochem J,2014,459(2):e1–3.doi:10.1042/BJ20140211.
[14]屈雁玲,马俊丽,邓甘露,等.甲基莲心碱逆转人结肠癌细胞奥沙利铂耐药的体外研究[J].中国普通外科杂志,2017,26(3):325–332.doi:10.3978/j.issn.1005–6947.2017.03.009.Qu YL,Ma JL,Deng GL,et al.Reversal effect of neferine on oxaliplatin-resistance in human colon cancer cells in vitro[J].Chinese Journal of General Surgery,2017,26(3):325–332.doi:10.3978/j.issn.1005–6947.2017.03.009.
[15]Wang L,Xue M,Chung DC.c-Myc is regµLated by HIF-2alpha in chronic hypoxia and influences sensitivity to 5-FU in colon cancer[J].Oncotarget,2016,7(48):78910–78917.doi:10.18632/oncotarget.12911.
[16]Kubiliūt R,ŠµLskyt I,Daniūnait K,et al.Molecular features of doxorubicin-resistance development in colorectal cancer CX-1 cell line[J].Medicina (Kaunas),2016,52(5):298–306.doi:10.1016/j.medici.2016.09.003.
[17]Shiovitz S,Bertagnolli MM,Renfro LA,et al.CpG island methylator phenotype is associated with response to adjuvant irinotecan-based therapy for stage III colon cancer[J].Gastroenterology,2014,147(3):637–645.doi:10.1053/j.gastro.2014.05.009.
[18]Ma J,Zhang Y,Shen H,et al.Association between mismatch repair gene and irinotecan-based chemotherapy in metastatic colon cancer[J].Tumour Biol,2015,36(12):9599–9609.doi:10.1007/s13277–015–3723–5.
[19]Xiong B,Ma L,Hu X,et al.Characterization of side population cells isolated from the colon cancer cell line SW480[J].Int J Oncol,2014,45(3):1175–1183.doi:10.3892/ijo.2014.2498.
[20]Linardou H,Dahabreh IJ,Kanaloupiti D,et al.Assessment of somatic k-RAS mutations as a mechanism associated with resistance to EGFR-targeted agents:a systematic review and metaanalysis of studies in advanced non-small-cell lung cancer and metastatic colorectal cancer[J].Lancet Oncol,2008,9(10):962–972.doi:10.1016/S1470–2045(08)70206–7.
[21]Li XL,Zhou J,Chen ZR,et al.P53 mutations in colorectal cancer -molecular pathogenesis and pharmacological reactivation[J].World J Gastroenterol,2015,21(1):84–93.doi:10.3748/wjg.v21.i1.84.
[22]Sousa CM,Biancur DE,Wang X,et al.Pancreatic stellate cells support tumour metabolism through autophagic alanine secretion[J].Nature,2016,536(7617):479–483.
[23]Chen Y,Li X,Guo L,et al.Combining radiation with autophagy inhibition enhances suppression of tumor growth and angiogenesis in esophageal cancer[J].Mol Med Rep,2015,12(2):1645–1652.doi:10.3892/mmr.2015.3623
[24]Orfanelli T,Jeong JM,DoµLaveris G,et al.Involvement of autophagy in cervical,endometrial and ovarian cancer[J].Int J Cancer,2014,135(3):519–528.doi:10.1002/ijc.28524.
[25]Chen S,Rehman SK,Zhang W,et al.Autophagy is a therapeutic target in anticancer drug resistance[J].Biochim Biophys Acta,2010,1806(2):220–229.doi:10.1016/j.bbcan.2010.07.003.
[26]Livesey KM,Tang D,Zeh HJ,et al.Autophagy inhibition in combination cancer treatment [J].Curr Opin Investig Drugs,2009,10(12):1269–1279.
[27]Liu W,Zhang Z,Zhang Y,et al.HMGB1-mediated autophagy modulates sensitivity of colorectal cancer cells to oxaliplatin via MEK/ERK signaling pathway[J].Cancer Biol Ther,2015,16(4):511-517.doi:10.1080/15384047.2015.1017691.
[28]DeYoung MP,Horak P,Sofer A,et al.Hypoxia regulates TSC1/2-mTOR signaling and tumor suppression through REDD1-mediated 14–3–3 shuttling[J].Genes Dev,2008,22(2):239–251.doi:10.1101/gad.1617608.
[29]许红玲,张萍.自噬与肿瘤耐药关系的研究进展[J].上海交通大学学报:医学版,2016,36(6):934–938.doi:10.3969/j.issn.1674–8115.2016.06.030.Xu HL,Zhang P.Research progresses of relationship between autophagy and drug resistance of tumor[J].Journal of Shanghai Jiaotong University:Medical Science,2016,36(6):934–938.doi:10.3969/j.issn.1674–8115.2016.06.030.
[30]Ichimura Y,Kirisako T,Takao T,et al.A ubiquitin-like system mediates protein lipidation[J].Nature,2000,408(6811):488–92.
[31]Kabeya Y,Mizushima N,Ueno T,et al.LC3,a mammalian homologue of yeast Apg8p,is localized in autophagosome membranes after processing[J].EMBO J,2000,19(21):5720–5728.
