microRNA-183通过下调Bcl-2诱导人神经母细胞瘤细胞株SK-N-SH细胞凋亡的研究
2017-03-23马国祥丁茜萍邓海华杨振汉
马国祥 丁茜萍 邓海华 杨振汉
广东深圳市宝安区福永人民医院内科 深圳 518103
microRNA-183通过下调Bcl-2诱导人神经母细胞瘤细胞株SK-N-SH细胞凋亡的研究
马国祥 丁茜萍 邓海华 杨振汉
广东深圳市宝安区福永人民医院内科 深圳 518103
目的 研究microRNA-183对神经母细胞瘤细胞的调控作用,为神经母细胞瘤的治疗提供新策略。方法 购买microRNA-183和对照 microRNA,转染至人神经母细胞瘤细胞株SK-N-SH细胞,再使用MTT实验,Caspase-3活性测定试剂盒和流式检测细胞生长和凋亡的影响。合成Bcl-2 siRNA,检测Bcl-2对人神经母细胞瘤细胞株SK-N-SH细胞凋亡的影响。转染Bcl-2质粒后,再转染microRNA-183至人神经母细胞瘤细胞株SK-N-SH细胞,分析Bcl-2的表达水平和人神经母细胞瘤细胞株SK-N-SH细胞的凋亡。结果 转染microRNA-183降低SK-N-SH细胞的生长(P=0.005 9),发生磷脂酰丝氨酸膜表面表达(P=0.008)和Caspase-3的激活(P=0.014),Bcl-2的表达降低(P=0.015)。干扰SK-N-SH细胞中Bcl-2增强了microRNA-183诱导的细胞凋亡(P=0.005 8),而过表达Bcl-2抑制了microRNA-183诱导的细胞凋亡(P=0.007 3)。结论 转染microRNA-183抑制SK-N-SH细胞的生长和增殖。microRNA-183通过下调Bcl-2而诱导SK-N-SH细胞的凋亡,提示Bcl-2可能是神经母细胞瘤潜在的候选治疗靶点。
细胞凋亡;microRNA-183;Bcl-2;SK-N-SH细胞
神经母细胞瘤严重威胁着患者的生活和健康[1]。神经母细胞瘤的治疗主要包括放化疗、手术治疗、分子靶向治疗等[2],针对不同的患者,上述治疗方法疗效均显著,然而,也存在毒副作用强、适用人群少、分子靶点的选择难等缺点[3-4]。microRNA调控细胞生长、凋亡和增殖作用[5]。在动物实验中,microRNA常被作为癌症治疗的分子靶点[6]。然而,microRNA-183对神经母细胞瘤细胞生长和凋亡的调控作用尚不清楚。因此,本研究以人神经母细胞瘤细胞株SK-N-SH细胞为细胞模型,探讨microRNA-183对人神经母细胞瘤细胞株SK-N-SH细胞可能的调控机制,以期为神经母细胞瘤分子靶点的治疗提供理论依据。
1 实验试剂和方法
1.1 实验试剂和实验细胞 小鼠源抗人Bcl-2的多克隆抗体,HRP标记的羊源抗小鼠的IgG单克隆抗体,内参抗actin内参的多克隆抗体来源于美国Santa Cruz生物技术有限公司。细胞培养用血清和培养基来源于华兰生物用品公司。MTT试剂盒来源于碧云天生物技术研究所。细胞凋亡试剂来源于北京鼎国科技有限责任公司公司。
microRNA如microRNA-83(5′-ACATCACA-TCGGTAGTTGCCAT-3′和5′- AAACAAAGAGGTAAAGGTGCA-3′),对照microRNA(5′-CCAACGAGTGTCTTTCGAGC-3′和5′-TTGACGTTT-CACGATACAT-3′)和siRNA Bcl-2(5′-CTACGTGCTACCATGGATGC-3′和5′-TTCTAGAACTACGCTATGT-3′),Bcl-2的质粒来源于上海生物工程有限公司。Lipo2000转染试剂来源于美国Invitrogen。
1.2 细胞培养的方法 复苏人神经母细胞瘤细胞株SK-N-SH细胞,将人神经母细胞瘤细胞株SK-N-SH细胞重悬于DMEM培养基中,37 ℃,5% CO2[7]。
1.3 转染方法 将microRNA-183和对照micro-RNA转染至人神经母细胞瘤细胞株SK-N-SH细胞。将人神经母细胞瘤细胞株SK-N-SH细胞铺板于24孔板,密度30%左右,将microRNA-183和对照microRNA加入lipo2000中,混匀,室温放置7 min,将混合液加入细胞中,37 ℃,5% CO2[8-9]。
1.4 MTT试剂盒检测细胞活性 按照MTT试剂盒的说明检测人神经母细胞瘤细胞株SK-N-SH细胞的活性[10]。首先,接种人神经母细胞瘤细胞株SK-N-SH细胞。按1.3的描述向人神经母细胞瘤细胞株SK-N-SH细胞转染microRNA-183或对照miRNA后,再加入1 mg/mL MTT反应液,培养人神经母细胞瘤细胞株SK-N-SH细胞24 h。最后在细胞里加入终止反应液DMSO,终止反应。
将6孔板人神经母细胞瘤细胞株SK-N-SH细胞放入酶标仪中,测试人神经母细胞瘤细胞株SK-N-SH细胞在560 nm处的吸收值,绘制人神经母细胞瘤细胞株SK-N-SH细胞生长曲线[11]。
1.5 流式细胞术检测细胞凋亡 人神经母细胞瘤细胞株SK-N-SH细胞的凋亡情况使用流式检测。首先,接种人神经母细胞瘤细胞株SK-N-SH细胞。按1.3的描述向人神经母细胞瘤细胞株SK-N-SH细胞转染microRNA-183或对照miRNA后,向200 μL体积的细胞中加入16 μL的反应液和2 μL的染料Annexin-V-FITC,避光反应14 min。最后上流式检测[12]。1.6 聚丙烯酰胺凝胶电泳和Western blot免疫印迹 首先,接种人神经母细胞瘤细胞株SK-N-SH细胞。按1.3的描述向人神经母细胞瘤细胞株SK-N-SH细胞转染microRNA-183或对照miRNA后,收集细胞,向细胞中加入细胞裂解液裂解,制备聚丙烯酰胺凝胶电泳样品,进行电泳,电泳结束转膜、封闭,孵育一抗、二抗,最后进行显影、定影[13]。
1.7 Caspase-3活性测试 按照试剂盒的说明检测人神经母细胞瘤细胞株SK-N-SH细胞的凋亡情况。首先,接种人神经母细胞瘤细胞株SK-N-SH细胞。按1.3的描述向人神经母细胞瘤细胞株SK-N-SH细胞转染microRNA-183或对照miRNA后,裂解细胞,向细胞样品中加入生色底物反应。最后在酶标仪上测试各组样品的光吸收值[14],作为细胞Caspase-3活性的相对值。

2 结果
2.1 转染microRNA-183降低了人神经母细胞瘤细胞株SK-N-SH细胞的活性 各实验组的人神经母细胞瘤细胞株SK-N-SH细胞活性通过MTT测试,与转染对照miRNA的人神经母细胞瘤细胞株SK-N-SH细胞相比,转染microRNA-183后,人神经母细胞瘤细胞株SK-N-SH细胞的生长被显著抑制(P=0.005 9)。见图1。
由于转染对照miRNA的人神经母细胞瘤细胞株SK-N-SH细胞和未转染组人神经母细胞瘤细胞株SK-N-SH细胞的活性差异无统计学意义(P>0.05),所以,以转染miRNA细胞组作为对照。
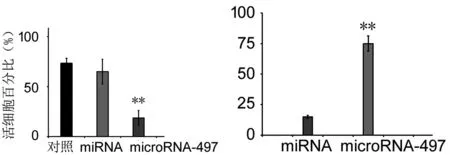
图1 转染microRNA-183降低了人神经母细胞瘤细胞株SK-N-SH细胞的活性,抑制其生长 与miRNA组相比,**P<0.01 图2 转染microRNA-183引起人神经母细胞瘤细胞株SK-N-SH细胞的凋亡与miRNA组相比,**P<0.01
2.2 转染microRNA-183引起人神经母细胞瘤细胞株SK-N-SH细胞的凋亡 如图2所示,人神经母细胞瘤细胞株SK-N-SH细胞磷脂酰丝氨酸的外翻,与转染对照miRNA的人神经母细胞瘤细胞株SK-N-SH细胞相比,转染microRNA-183后,人神经母细胞瘤细胞株SK-N-SH细胞膜磷脂酰丝氨酸外翻的量显著增加(P=0.008)。
2.3 转染microRNA-183引起人神经母细胞瘤细胞株SK-N-SH细胞中Caspase-3的活化 图3中人神经母细胞瘤细胞株SK-N-SH细胞中细胞凋亡的检测数据提示,与转染miRNA的人神经母细胞瘤细胞株SK-N-SH细胞相比,转染microRNA-183后,人神经母细胞瘤细胞株SK-N-SH细胞凋亡增加(P=0.014)。

图3 转染microRNA-183引起人神经母细胞瘤细胞株SK-N-SH细胞的Caspase-3的活化 与miRNA组相比,*P<0.05 图4 转染microRNA-183引起人神经母细胞瘤细胞株SK-N-SH细胞中Bcl-2蛋白表达的下降
2.4 转染microRNA-183引起人神经母细胞瘤细胞株SK-N-SH细胞中Bcl-2蛋白表达的下降 如图4所示,人神经母细胞瘤细胞株SK-N-SH细胞中细胞凋亡的检测数据提示,与转染对照miRNA的人神经母细胞瘤细胞株SK-N-SH细胞相比,转染microRNA-183后,人神经母细胞瘤细胞株SK-N-SH细胞细胞凋亡增强(P=0.015)。
2.5 敲低Bcl-2增强microRNA-183引起的人神经母细胞瘤细胞株SK-N-SH细胞凋亡 如图5所示,降低Bcl-2的表达后,再转染microRNA-183后,人神经母细胞瘤细胞株SK-N-SH细胞凋亡增加(P=0.007 6)。microRNA-183组和siBcl-2+microRNA-183细胞凋亡差异有统计学意义(P=0.005 8)。
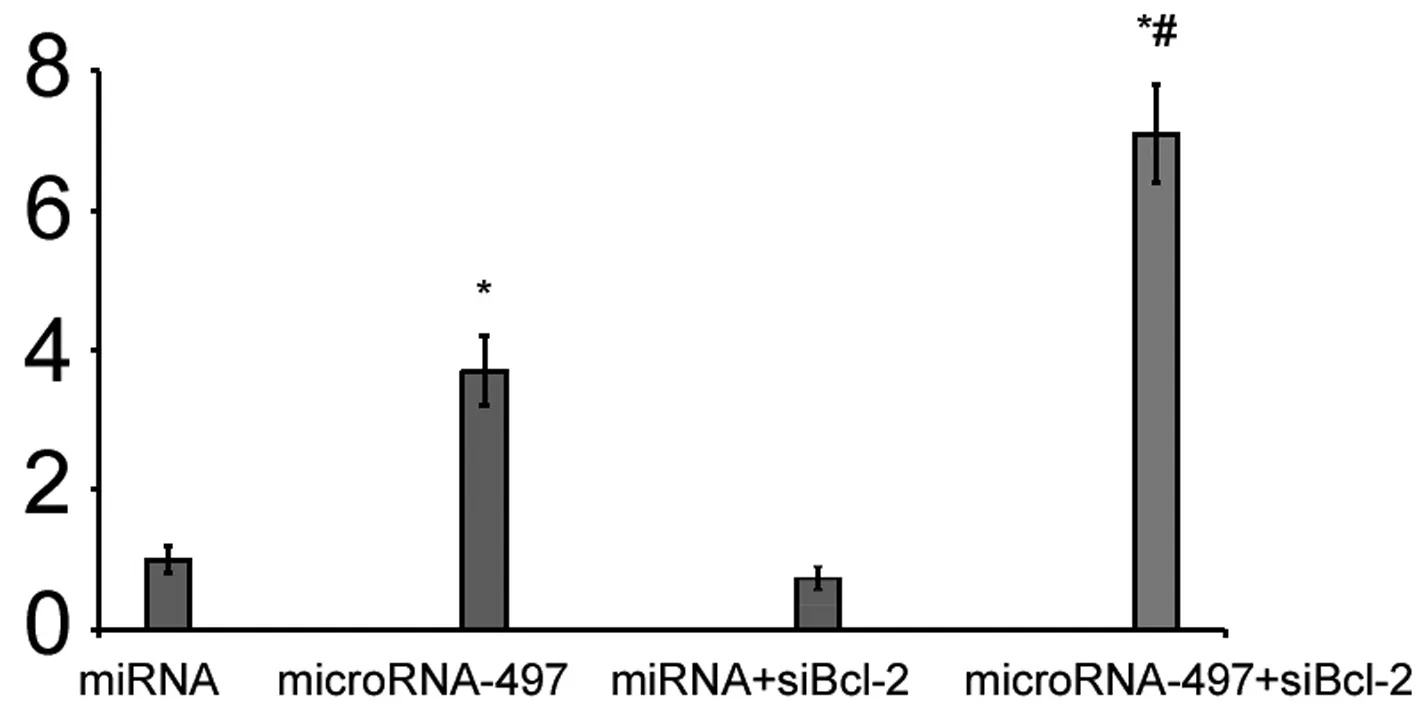
图5 敲低Bcl-2增强microRNA-183引起的人神经母细胞瘤细胞株SK-N-SH细胞凋亡 与miRNA组相比,*P<0.05;microRNA-183组和siBcl-2+microRNA-183细胞凋亡比较,#P<0.05
2.6 转染Bcl-2抑制了microRNA-183诱导的人神经母细胞瘤细胞株SK-N-SH细胞凋亡 图6中Western blot结果表明,Bcl-2的质粒转染增加了其水平。microRNA-183组和Bcl-2+microRNA-183组间Bcl-2比较差异有统计学意义(P<0.05)。
图6示,人神经母细胞瘤细胞株SK-N-SH细胞中细胞凋亡的检测结果表明,转染Bcl-2增强Bcl-2水平后,再转染microRNA-183后,人神经母细胞瘤细胞株SK-N-SH细胞凋亡被明显抑制(P=0.006)。microRNA-183组和Bcl-2+microRNA-183细胞凋亡差异有统计学意义(P=0.007 3)。
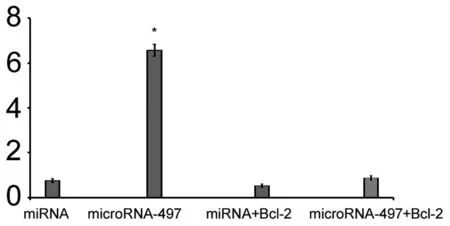
图6 转染Bcl-2抑制了microRNA-183诱导的人神经母细胞瘤细胞株SK-N-SH细胞凋亡与miRNA组相比,*P<0.05;microRNA-183组和Bcl-2+microRNA-183比较,#P<0.05
3 讨论
本研究以人神经母细胞瘤细胞株SK-N-SH细胞为细胞模型,从蛋白水平上研究了microRNA-183对人神经母细胞瘤细胞株SK-N-SH细胞的调节机制,结果显示,转染microRNA-183降低了人神经母细胞瘤细胞株SK-N-SH细胞的生长,引起人神经母细胞瘤细胞株SK-N-SH细胞凋亡。这与前人研究结果高度一致,即microRNA调控细胞生长和细胞凋亡[15]。
Bcl-2蛋白是Bcl-2蛋白家族中重要的细胞凋亡抑制蛋白之一[7-8]。据研究报道,Bcl-2可能受microRNA-183的调节,进而调节人神经母细胞瘤细胞株SK-N-SH细胞[9-10]。本研究结果证明,转染microRNA-183降低了Bcl-2的蛋白水平。转染microRNA-183和降低Bcl-2的表达后,人神经母细胞瘤细胞株SK-N-SH细胞的凋亡增加,而转染Bcl-2则抑制了microRNA-183诱导的人神经母细胞瘤细胞株SK-N-SH细胞凋亡。
本文采用不同的方法证明了Bcl-2蛋白在microRNA-183诱导的人神经母细胞瘤细胞株SK-N-SH细胞凋亡中的作用:(1)Western blot结果显示,microRNA-183高表达时,人神经母细胞瘤细胞株SK-N-SH细胞中的Bcl-2蛋白显著降低;(2)转染Bcl-2 siRNA后,再转染microRNA-183至人神经母细胞瘤细胞株SK-N-SH细胞后,人神经母细胞瘤细胞株SK-N-SH细胞凋亡增强;(3)转染Bcl-2质粒后,再转染microRNA-183至人神经母细胞瘤细胞株SK-N-SH细胞,人神经母细胞瘤细胞株SK-N-SH细胞凋亡被显著抑制。结果表明,Bcl-2蛋白在microRNA-183诱导的人神经母细胞瘤细胞株SK-N-SH细胞凋亡中发挥关键作用,Bcl-2蛋白是潜在的神经母细胞瘤的分子靶点[11-12]。Bcl-2可抑制癌细胞的细胞凋亡[13-14],这是一致性的结论。
本文的不足和缺点如下:(1)缺少临床神经母细胞瘤的样本和对照组织中Bcl-2蛋白水平的结果;(2)缺少预后临床神经母细胞瘤的样本和对照组织中Bcl-2蛋白水平的结果;(3)缺少神经母细胞瘤的小鼠模型和以microRNA-183为靶点治疗的神经母细胞瘤小鼠的疗效结果。
转染microRNA-183抑制人神经母细胞瘤细胞株SK-N-SH细胞的生长和增殖,microRNA-183通过下调Bcl-2而诱导人神经母细胞瘤细胞株SK-N-SH细胞的凋亡,提示Bcl-2可能是神经母细胞瘤潜在的候选治疗靶点。
[1] Cheng M,Liu L,Lao Y,et al.MicroRNA-181a suppre-sses parkin-mediated mitophagy and sensitizes neuroblastoma cells to mitochondrial uncoupler-induced apoptosis[J].Oncotarget,2016,7(27):42 274-42 287.
[2] Kong B,Wu PC,Chen L,et al.microRNA-7 Protects Against 1-Methyl-4-Phenylpyridinium Iodide-Induced Cell Apoptosis in SH-SY5Y Cells by Directly Targeting Krüpple-Like Factor 4.DNA[J].Cell Biol,2016,35(5):217-225.
[3] Soriano A,París-Coderch L,Jubierre L,et al.Micro RNA-497 impairs the growth of chemoresistant neuroblastoma cells by targeting cell cycle,survival and vascular permeability genes[J].Oncotarget,2016,7(8):9 271-9 287.
[4] Nolan K,Walter F,Tuffy LP,et al.Endoplasmic reticu-lum stress-mediated upregulation of miR-29a enhances sensitivity to neuronal apoptosis[J].Eur J Neurosci,2016,43(5):640-652.
[5] Bevilacqua V,Gioia U,Di Carlo V,et al.Identification of linc-NeD125,a novel long non coding RNA that hosts miR-125b-1 and negatively controls proliferation of human neuroblastoma cells[J].RNA Biol,2015, 12(12):1 323-1 337.
[6] Bachetti T,Di Zanni E,Ravazzolo R,et al.miR-204 mediates post-transcriptional down-regulation of PHOX2B gene expression in neuroblastoma cells[J].Biochim Biophys Acta,2015,1 849(8):1 057-1 065.
[7] Wu K,Yang L,Chen J,et al.miR-362-5p inhibits proliferation and migration of neuroblastoma cells by targeting phosphatidylinositol 3-kinase-C2β[J].FEBS Lett,2015,589(15):1 911-1 919.
[8] Carpenter D,Hsiang C,Jiang X,et al.The herpes simplex virus type 1 (HSV-1)latency-associated transcript (LAT)protects cells against cold-shock-induced apoptosis by maintaining phosphorylation of protein kinase B (AKT)[J].J Neurovirol,2015,21(5):568-575.
[9] Zhang W,Zhao L,Liu J,et al.Cisplatin induces platelet apoptosis through the ERK signaling pathway[J].Thromb Res,2012,130(1):81-91.
[10] Tao Z,Zhao H,Wang R,et al.Neuroprotective effect of microRNA-99a against focal cerebral ischemia-reperfusion injury in mice[J].J Neurol Sci,2015,355(1/2):113-119.
[11] Du X,Wang H,Xu F,et al.Enterovirus 71 induces apoptosis of SH.SY5Y human neuroblastoma cells through stimulation of endogenous microRNA let-7b expression[J].Mol Med Rep,2015,12(1):953-959.
[12] Rihani A,Van Goethem A,Ongenaert M,et al.Genome wide expression profiling of p53 regulated miRNAs in neuroblastoma[J].Sci Rep,2015,5:9 027.
[13] Zhao Z,Ma X,Sung D,et al.microRNA-449a functions as a tumor suppressor in neuroblastoma through inducing cell differentiation and cell cycle arrest[J].RNA Biol,2015,12(5):538-554.
[14] Ren X,Bai X,Zhang X,et al.Quantitative nuclear proteomics identifies that miR-137-mediated EZH2 reduction regulates resveratrol-induced apoptosis of neuroblastoma cells[J].Mol Cell Proteomics,2015,14(2):316-328.
[15] Harvey H,Piskareva O,Creevey L,et al.Modulation of chemotherapeutic drug resistance in neuroblastoma SK-N-AS cells by the neural apoptosis inhibitory protein and miR-520f[J].Int J Cancer,2015,136(7):1 579-1 588.
(收稿2016-10-20)
microRNA-183 induces apoptosis of human neuroblastoma cell line SK-N-SH by down regulating Bcl-2 disease rats
MaGuoxiang,DingQianping,DengHaihua,YangZhenhan
FuyongPeople'sHospitalofShenzhenBaoanDistrict,Shenzhen518103,China
Objective To study the regulation of microRNA-183 on neuroblastoma cells and to provide a new strategy for the treatment of neuroblastoma.Methods microRNA and microRNA-183 were transfected into SK-N-SH cells,and then MTT experiment and Caspase-3 activity assay and flow cytometry were employed to investigate the role of microRNA-183 in growth and apoptosis of human neuroblastoma cell line SK-N-SH.Bcl-2 siRNA was transfected into SK-N-SH cells,and effects of Bcl-2 on human neuroblastoma cell line SK-N-SH cells apoptosis was tested.After transfection of Bcl-2 plasmid,microRNA-183 was transfected into human neuroblastoma cell line SK-N-SH cells,and the expression level of Bcl-2 and apoptosis of human neuroblastoma cell line SK-N-SH were analyzed.Results The transfection of microRNA-183 reduced cell growth of the SK-N-SH cells (P=0.005 9),and the expression of phosphatidylserine on the membrane (P=0.008) and activation of Caspase-3 were observed (P=0.014),and the expression of Bcl-2 was decreased (P=0.015).Bcl-2 interference of human neuroblastoma cell lines enhances apoptosis of the human neuroblastoma cell line SK-N-SH induced by microRNA-183 (P=0.005 8),and overexpression of Bcl-2 inhibits apoptosis induced by microRNA-183 (P=0.007 3).Conclusion The transfection of microRNA-183 inhibits the growth and proliferation of human neuroblastoma cell line SK-N-SH.MicroRNA-183 induces apoptosis of SK-N-SH by down regulating Bcl-2,which suggests that Bcl-2 may be a potential candidate therapeutic target for neuroblastoma.
Apoptosis;microRNA-183;Bcl-2;SK-N-SH cell
R730.264
A
1673-5110(2017)07-0003-04
