六水氯化镁相变储热材料的研究进展
2017-03-22王会春凌子夜方晓明苑坤杰张正国
王会春,凌子夜,方晓明,苑坤杰,张正国
六水氯化镁相变储热材料的研究进展
王会春,凌子夜,方晓明,苑坤杰,张正国
(华南理工大学传热强化与过程节能教育部重点实验室,广东广州 510640)
六水氯化镁(水氯镁石)的相变温度为117 ℃左右,相变焓为160 kJ/kg,具有储热密度大、不可燃性、价格相对低廉以及热导率较高等优点,是中温储能领域重要的相变材料。本文综述了六水氯化镁的相变温度、相变焓、比热容、热导率、密度等热物性研究进展,揭示了六水氯化镁作为相变材料存在过冷特性、相分离、腐蚀性的固有缺点,分析了加入合适成核剂和增稠剂改进其性能的方法。同时,综述了六水氯化镁在储能领域作为单种或混合相变材料的应用。六水氯化镁与其它的盐混合(共晶)后相变焓较大,具有良好的应用前景。
储热技术;相变材料;六水氯化镁;过冷;相分离
储热技术能解决热能供给与需求失配的矛盾,在太阳能热利用、工业余(废)热回收、电力“移峰填谷”以及建筑节能等诸多领域有着广泛的应用前景,是实现节能和保护环境的关键技术之一。储热技术主要包括显热储热、潜热储热和化学反应热储热3类,其中以相变材料(phase change material,PCM)为工作介质的潜热储热技术具有储热密度较大、温度恒定且易于操作控制等优点而成为最具应用前景的储热技术,而相变材料的性能则是潜热储热技术应用的关键。用作相变材料的物质包括有机物和无机物两种,有机物相变材料如石蜡、脂肪酸、酯类等,它们具有相变潜热较大且几乎无过冷和相分离的优点,但也存在易燃性、热导率低以及价格昂贵等缺点。无机物相变材料包括水、金属、无机水合盐以及熔融盐等,其中无机水合盐具有相变潜热大、无可燃性以及成本低等优势[1],但存在过冷度大、相分离严重、腐蚀性以及吸水性强等不足,从而严重制约了其实际应用。一直以来,高性能水合无机盐类相变材料的研究开发一直是储热技术的 难点。
六水氯化镁(MgCl2·6H2O,magnesium chloride hexahydrate)的相变温度在110 ℃左右,相变潜热较大[2],是一种适用于中温储热的水合无机盐相变材料[3-4]。在天然形成的水氯镁石中,90%(质量分数,下同)以上的成分是六水氯化镁。我国青海盐湖蕴藏着大量的水氯镁石,但它们因无法利用而被废弃,被称为“镁害”。可见,在我国六水氯化镁的来源广泛、成本低廉,大力开展六水氯化镁相变储热材料的研发,不仅有利于推进水合无机盐相变材料的研究和应用,促进潜热技术的发展,而且还有助于充分开发利用我国的盐湖资源,解决“镁害”问题。本论文对六水氯化镁相变材料的研究现状进行了综述,在介绍六水氯化镁物性的基础上,着重分析了在解决其过冷、相分离以及循环稳定性等方面的研究进展,并对基于六水氯化镁的混合相变材料研究动态进行了评述,最后指出了六水氯化镁相变材料研究中目前存在的问题及未来的发展方向。
1 六水氯化镁的物性
1.1 六水氯化镁的基本物性
六水氯化镁的分子量为203.31 g/mol,是无色针状单斜晶体[5],空间群C2/m,WECK等[6]通过密度泛函理论计算得六水氯化镁的晶格参数为:=0.991 nm,=0.716 nm,=0.612 nm,==90°,=94.25°,=0.43318 nm3,=2,六水氯化镁的晶体结构如图1所示[7]。AGRON等[8]的实验数据与该计算值吻合。晶格信息为后续成核剂的寻找提供了指导,LANE等[9]认为在结构上,与六水氯化镁晶格参数相差小于15%的晶体可尝试作为其成核剂。
工业上常用的水氯镁石为含MgCl2·6H2O(94.8%)、Li2SO4·H2O(3.2%)、KCl·MgCl2·6H2O(1.8%)、KCl(0.90%)、NaCl(0.2%)等杂质的混合矿物质[10]。

表1 六水氯化镁与水氯镁石的物性参数
六水氯化镁和水氯镁石的物性参数见表1,可见两种物质的熔点分别在110 ℃附近,六水氯化镁由于纯度高,其能量密度和相变温度比水氯镁石高。两种物质在固液两种状态下物性都略有不同,固态下密度较大,液态的比热容较高。PILAR等[13]根据测得的热容值,拟合得到热容C对温度的函数多项式(1)。WECK等[6]通过第一性原理计算得六水氯化镁的等压热容C关于温度的多项式(2)。
(25~98 ℃)=A+B·+C·T(1)
式中,A=486±14,B = −1.409±0.082,C=30.5×10−4±1.23×10−4,R2=0.9991。
(17~227 ℃)=ab+c-2+d-0.5e2(2)
式中,a=5.7643×102,b=−8.674×10-2,c=4.521784×105,d=−5.066334×103,e=5.97×10-5,SSD(平方差之和)=0.004。
此外,KOSAKA[17]指出水氯镁石液态热导率比其固态热导率低。
1.2 六水氯化镁的热稳定性
结晶水合盐在达到一定温度后,极易失去结晶水,生成含结晶水少的水合物。图2[18]为六水氯化镁在25~300 ℃范围内分解的TGA图,测试条件为干燥氮气1 ℃/min,可以看出六水氯化镁是逐步失水的。
SUGIMOTO等[7]发现在He氛围下水氯镁石在温度为25 ℃≤≤600 ℃范围内的分解产物为MgCl2·H2O(= 1,2,4,6)、MgOHCl·H2O(0≤≤1.0)、MgCl2和MgO。ZONDAG等[19]认为六水氯化镁的失水温度低至50 ℃。HUANG等[20]发现六水氯化镁的失水产物按温度划分分别为: 69 ℃,MgCl2·4H2O;129 ℃,MgCl2·2H2O;167 ℃,MgCl2·H2O(1≤≤2)和MgOHCl;203 ℃,MgCl2·H2O(1≤≤2)转变为Mg(OH)Cl·0.3H2O;235 ℃,Mg(OH)Cl·0.3H2O转变为MgOHCl;415 ℃,MgOHCl转变为圆筒状MgO粒子。由于脱水反应和水解反应并存,中高温时反应产物为MgOHCl,加之元素Cl与H具有较好的结合力(电负性与原子半径的契合),导致高温时HCl极易形成且挥发,最后产物只有MgO。
尽管水氯镁石存在失水的问题,但GALLEGOS等[21]指出,较之相变温度相近的有机相变材料半乳糖醇、D-甘露醇等,MgCl2·6H2O由于存在较牢固的离子键和氢键,具有较高的沸点和热稳定性。GUTIERREZ等[4]发现,130 ℃之内,水氯镁石较稳定,有0.4%的吸水量,添加适量聚乙二醇(PEG)几乎无失重。
1.3 六水氯化镁的腐蚀性
六水氯化镁对金属的腐蚀性与其离子性质以及温度、湿度、pH等与应用环境有关。由于强吸湿性,六水氯化镁极易吸收空气中的水汽,形成的水合物水解电离出Mg2+和酸根Cl-,会在金属容器表面发生电化学反应,造成腐蚀。
EL-SEBAII[22]等通过扫描电镜(SEM)观察了埋入MgCl2·6H2O的金属表面情况,发现经过500次冷热循环后不锈钢和铝都被严重腐蚀(图3)。NAGANO等[23]测试了多种金属插入10%MgCl2·6H2O的Mg(NO3)2·6H2O混合物,并在90 ℃储藏90天后的质量损失,对腐蚀特性进行了定量分析。结果表明,铜、黄铜、碳钢腐蚀严重,而SUS316、铝等因腐蚀导致的质量损失低于0.001 g,并没有明显的腐蚀(图4)。
(a)不锈钢(循环前)
(b)Al(循环前)
(c)不锈钢(500次循环后)
(d)Al(500次循环后)
图3 不锈钢和Al在六水氯化镁500次冷热循环前后的SEM图
Fig. 3. The SEM photographs of aluminum and stainless steel before and after 500 cycles of magnesium chloride hexahydrate
铜
SUS304
碳钢
SUS316
青铜
铝
图4 90天后材料腐蚀测试的形貌
Fig.4 The surface appearance of metals after the corrosion test of magnesium chloride hexahydrate
此外,BLÜCHER等[24]发现CO2浓度会影响MgCl2·6H2O对金属的腐蚀。CO2浓度高时,金属表面酸性环境会破坏以Mg(OH)2沉淀为核心的保护膜的形成,使腐蚀加快。
鉴于其强腐蚀性,有学者建议用塑料代替金属作为水合无机盐的容器[25],或者尝试用微胶囊封装水合无机盐[26],避免水合盐与金属容器直接接触,减轻腐蚀程度。
2 六水氯化镁作为相变储热材料存在的问题及其相关研究
水合无机盐作为相变材料,其熔化/凝固循环的次数直接反映了材料本身的使用性能和寿命。表2对比了MgCl2·6H2O在高低温循环前后的相变温度和相变焓的变化,在敞开体系中,发现循环前后MgCl2·6H2O物性变化明显,稳定性较差,主要原因在于MgCl2·6H2O具有较高的过冷度以及严重的相分离现象。
2.1 过冷度
从结晶动力学上来说,存在过冷可以促进结晶。但是无机水合盐由于缺乏杂质等作为结晶种子,纯物质的饱和溶液在凝固点时需要克服因微小晶体生成所需要的高比表面能而难以结晶,导致过冷严重,熔化和凝固温差可高达37 ℃[13]。过冷会限制相变材料潜热的释放,影响其实际应用。
为了降低过冷度,可采用的方法包括:①机械搅拌或扰动。El-SEBAII等[22,27]发现测试装置中的冷却风使样品产生了震动,意外地发现MgCl2·6H2O的过冷度有所降低。②加入合适的成核剂。CHOI等[14]添加0.5%(质量分数)的一水草酸钙作为成核剂。LANE等[29]测试了表3中列出的多种成核剂,将MgCl2水合盐的过冷度降低至2 ℃内。PILAR等[13]发现SrCO3和Sr(OH)2将MgCl2·6H2O的过冷度从37 ℃降至1 ℃,且过冷度随着成核剂含量的增加可以进一步得到抑制。加入成核剂使得MgCl2·6H2O的凝固峰更为尖锐,凝固温度区间更 集中,凝固焓被提升了25%以上,从而改善了其循环过程中潜热释放的稳定性。
表2 基于六水氯化镁的相变材料体系的循环性能
Table 2 The cycle stability of different materials based on MgCl2·6H2O

表2 基于六水氯化镁的相变材料体系的循环性能
组分测试条件循环次数相变温度/℃相变焓/kJ·kg-1 循环前循环后循环前循环后 六水氯化镁[22]敞开,过量水500Tm=122..95Tm=134.2Hm=155.1Hm=85 六水氯化镁[27]密闭,过量水1000Tm=116.29Tm=119.86Hm=137.96Hm=130.28 六水氯化镁[28]密闭200Tm=120.5Tc=120.0Tm=120.2Tc=119.1Hm=99.9Hm=95.3 六水氯化镁[28]密闭600Tm=120.5Tc=120.0Tm=119.5Tc=117.3Hm=99.9Hm=84.7
T表示熔化温度,H表示熔化温度,T表示结晶(凝固)温度,下同。
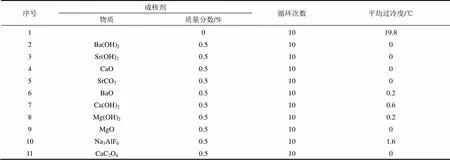
表3 成核剂对46.1%MgCl2-53.9%H2O体系的影响[29]
2.2 相分离
低水合物或无水合物的无机盐溶解度相对较小,聚沉在容器底部,导致凝固时难以恢复为原水合物,或者水分在敞开体系中被蒸发到环境中,是相分离现象出现的原因。相分离会产生四水氯化镁沉积,具有不可逆性,导致了相变焓随着相分离的出现而逐渐减小,体系的储热能力就逐渐降低。六水氯化镁相分离的改进方法包括:
(1)加入增稠剂。增稠剂与水反应改变水溶液的黏度,使低水合物或无水合物盐不易聚沉。GUTIERREZ等[4]使用PEG作为增稠剂来抑制相分离。相比于纯MgCl2·6H2O循环前后凝固温度变化近8 ℃,相变焓下降近50%,加入5%PEG2000后,不仅材料的凝固温度在50次循环前后相差不超过 2 ℃,其凝固焓也在81.1~86.3 kJ/kg之间,有效改善了材料的稳定性。DING等[30]加入5%CMC作为增稠剂后发现,尽管过冷度没有得到明显的改善,且30次冷热循环后MgCl2·6H2O的凝固焓也有所降低,但降低幅度明显减少。
(2)密闭封装。由于相变温度高于水的蒸发温度,体系极易失水。将相变材料通过一定容器密闭封装后,可以避免失去结晶水。EL-SEBAII等[22]在敞开体系中测试了MgCl2·6H2O快速循环500次前后的相变特性,发现即使加入了过量水以避免相分离,但是循环过程中材料的熔化温度由111.5 ℃升到124.12 ℃,熔化焓由155.11 kJ/kg降到 85 kJ/kg,性能差异明显。但将MgCl2·6H2O密封于密闭容器中进行了1002次快速熔化/凝固循环后,如图5所示,熔化温度仅由110.8 ℃升到115.39 ℃,相变焓仅由137.95 kJ/kg降到130.28 kJ/kg,变化幅度小,循环性能得到了有效改善[27]。
2.3 六水氯化镁混合相变材料
六水氯化镁和水氯镁石已经被用于部分工业、实验室级别的储热装置[14,31],但单一的水合无机盐由于相变温度过高,体系极易失水,相分离和稳定性等问题非常严重。将六水氯化镁与其它水合无机盐混合(表4),降低其相变温度,可以获得具有不同相变温度的相变材料,还可以克服水合盐因失水导致的稳定性不足等问题。

表4 六水氯化镁混合相变材料的热物性
DING等[30]研究了MgCl2·6H2O和Mg(NO3)2·6H2O的混合盐(表5),可得相变温度约为60 ℃、相变焓较高的混合盐。MARCUS等[38]发现将MgCl2·6H2O与CoCl2·6H2O和NiCl2·6H2O按一定比例混合后,可得到熔点在40 ℃以下的共晶盐。
NAGANO等[23, 39]用5%~10%(质量分数)的MgCl2·6H2O将Mg(NO3)2·6H2O的相变温度调至60~90 ℃,其相变焓约为150 kJ/kg,且在30~100 ℃间循环1000次后仍能保持在140 kJ/kg左右,见图7和图8。祝丹婷等[40]研究发现,MgCl2·6H2O/Mg(NO3)2·6H2O的质量比为(3∶7)~(6∶4)时,相变温度在57 ℃左右。质量比为5∶5时,循环前后的相变焓分别为57.08 kJ/kg、60.05kJ/kg,过冷度小、循环稳定。

表5 不同质量比例的Mg(NO3)2·6H2O/ MgCl2·6H2O的热物性[30]
2.3 封装方式
相变材料常被包覆至微胶囊[41]或多孔基质 内[42]以改善其稳定性和提升其热物性。如图10所示,USHAK等[43]用丙烯酸酯作为聚合物,三氯甲烷作为溶剂,通过流化床法(流化时间2 min,雾化流率2 kg/h)制得包覆率为92%的六水氯化镁胶囊[44](相变温度为95.3 ℃,相变焓为118.3 kJ/kg)和87%的水氯镁石胶囊(相变温度为104.6 ℃,相变焓为95 kJ/kg)。但目前鲜有MgCl2·6H2O与多孔介质复合的相关文献报道。通过与高导热系数的多孔介质复合,可以有效地抑制过冷度和相分离,从而提高热稳定性。
3 结 语
由于储热密度大、不燃、无毒、廉价等优势,六水氯化镁成为最有应用前景的中温相变储热材料之一。论文综述了国内外关于六水氯化镁的基本物性研究以及其作为相变材料在应用中存在的过冷度大和相分离严重问题等。针对过冷度大的问题,可从晶体学和结构化学的角度,寻找与酸酐同一族系元素形成的(单斜)晶体作为成核剂。针对其相分离严重的问题,可根据pH值、HLB、黏度等物性来选用合适的助剂(如六水硝酸镁、PEG等)对六水氯化镁进行改性。此外,六水氯化镁还可以与其它水合无机盐混合,制备出具有不同相变温度的水合无机盐相变材料,满足不同的应用需求。通过封装处理,可以减少结晶水分的流失,提高热稳定性。未来的研究重点应该是采用亲水基团的多孔介质如陶瓷Al2O3或SiO2等吸附六水氯化镁制备复合相变储热材料,或者制备无机物(SiO2等)作为外壳的微胶囊相变材料,并添加高导热系数材料,以降低过冷度,解决相分离及腐蚀性问题。
[1] SHARMA S D, SAGARA K. Latent heat storage materials and systems: A review[J]. International Journal of Green Energy, 2005, 2(1): 1-56.
[2] LI Y T, YAN D J, GUO Y F, et al. Studies on magnesium chloride hexahydrate as phase change materials[J]. Applied Mechanics and Materials, 2011(71/78): 2598-2601.
[3] LANE G A. Low temperature heat storage with phase change materials[J]. International Journal of Ambient Energy, 2011, 1(3): 155-168.
[4] GUTIERREZ A, USHAK S, GALLEGUILLOS H, et al. Use of polyethylene glycol for the improvement of the cycling stability of bischofite as thermal energy storage material[J]. Applied Energy, 2015, 154: 616-621.
[5] 顾晓滨,秦善,牛菁菁. 相变储能矿物材料研究现状及其展望[J]. 矿物岩石地球化学通报, 2014, 33(6): 932-940.
GU Xiaobin, QIN Shan, NIU Jingjing. Mineral materials used as phase change materials[J]. Minerals Petrology and Geochemistry, 2014, 33(6): 932-940.
[6] WECK P F, KIM E. Solar energy storage in phase change materials: First-principles thermodynamic modeling of magnesium chloride hydrates[J]. The Journal of Physical Chemistry C, 2014, 118(9): 4618-4625.
[7] SUGIMOTO K, DINNEBIER R E, HANSON J C. Structures of three dehydration products of bischofite from in situ synchrotron powder diffraction data (MgCl2·H2O,=1, 2, 4)[J]. Acta Crystallographica. Section B, Structural Science, 2007, 63: 235-242.
[8] AGRON P, BUSING W. Magnesium dichloride hexahydrate, MgCl2·6H2O, by neutron diffraction[J]. Acta Crystallographica Section C: Crystal Structure Communications,1985, 41(1): 8-10.
[9] LANE G A. Phase change materials for energy storage nucleation to prevent supercooling[J]. Solar Energy Materials and Solar Cells, 1992, 27(2): 135-160.
[10] USHAK S, GUTIERREZ A, GALLEGUILLOS H, et al. Thermophysical characterization of a by-product from the non-metallic industry as inorganic PCM[J]. Solar Energy Materials and Solar Cells, 2015, 132: 385-391.
[11] DINCER I, DINCER I. Thermal energy storage: Systems and applications[J]. John Wiley Professio, 2010: doi:10.1002/9780470970751.ch1.
[12] ABHAT A. Low temperature latent heat thermal energy storage: Heat storage materials[J]. Solar Energy, 1983, 30(4): 313-332.
[13] PILAR R, SVOBODA L, HONCOVA P, et al. Study of magnesium chloride hexahydrate as heat storage material[J]. Thermochimica Acta, 2012, 546: 81-86.
[14] CHOI J C, SANG D K. Heat transfer in a latent heat-storage system using MgCl2·6H2O at the melting point[J]. Energy, 1995, 20(1): 13-25.
[15] RIESENFELD E H, MILCHSACK C. Versuch einer bestimmung des hydratationsgrades von salzen in konzentrierten lösungen[J]. Zeitschrift Für Anorganische Chemie, 2004, 85(1): 401-429.
[16] MINEVICH A, MARCUSA Y, BENDOR L. Densities of solid and molten salt hydrates and their mixtures and viscosities of the molten salts[J]. Journal of Chemical & Engineering Data, 2004, 49(5): 1451-1455.
[17] ASAHINA T, KOSAKA M, TAODA H, et al. Dynamical heat transfer problems in the heat storage unit of packed pebble bed type[J]. Transactions of the Society of Heating, Air-Conditioning and Sanitary Engineers of Japan, 1979: 63-70.
[18] ESSEN V M, GORES J C, BLEIJENDAAL L P, et al. In Characterization of salt hydrates for compact seasonal thermochemical storage[C]//ASME 2009 3rd International Conferece on Energy Sustainabilty Collocated with the Heat Transfer and Inter PACK 09 Conferences. American Society of Mechanical Engineers, 2009.
[19] ZONDAG H A, VAN ESSEN V M, BLEIJENDAAL L P, et al. Application of MgCl2·6H2O for thermochemical seasonal solar heat storage[C]//Proceeding IRES 2010 conference, Berlin,2010.
[20] 黄琼珠, 路贵民, 汪瑾, 等. MgCl2·6H2O热分解机理的研究[J]. 无机材料学报, 2010, 25 (3): 306-310.
HUANG Qiongzhu, LU Guimin, WANG Jin, et al. Thermal decomposition mechanism of MgCl2∙6H2O[J]. Inorganic Materials, 2010, 25(3): 306-310.
[21] GALLEGOS LAZCANO M A, YU W. Thermal performance and flammability of phase change material for medium and elevated temperatures for textile application[J]. Journal of Thermal Analysis and Calorimetry, 2014, 117(1): 9-17.
[22] EL-SEBAII A A, AL-AMIR S, AL-MARZOUKI F M, et al. Fast thermal cycling of acetanilide and magnesium chloride hexahydrate for indoor solar cooking[J]. Energy Conversion and Management, 2009, 50(12): 3104-3111.
[23] NAGANO K, OGAWA K, MOCHIDA T, et al. Performance of heat charge/discharge of magnesium nitrate hexahydrate and magnesium chloride hexahydrate mixture to a single vertical tube for a latent heat storage system[J]. Applied Thermal Engineering, 2004, 24(2/3): 209-220.
[24] BLÜCHER D B, SVENSSON J E, JOHANSSON L G. The influence of CO2, AlCl3·6H2O, MgCl2·6H2O, Na2SO4and NaCl on the atmospheric corrosion of aluminum[J]. Corrosion Science, 2006, 48 (7): 1848-1866.
[25] LANE G A, ROSSOW H E. Hydrated Mg(NO3)2/MgCl2reversible phase change compositions: US 4272392[P]. 1981-6-9.
[26] 铁生年, 柳馨, 铁健. 相变储能材料的腐蚀性与封装材料研究进展[J]. 材料导报, 2015(11): 138-143.
TIE Shengnian, LIU Xin, TIE Jian. Corrosive and packaging research on phase change materials[J]. Materials Review, 2015(11): 138-143.
[27] EL-SEBAII A A, AL-HENITI S, AL-AGEL F, et al. One thousand thermal cycles of magnesium chloride hexahydrate as a promising PCM for indoor solar cooking[J]. Energy Conversion and Management, 2011, 52(4): 1771-1777.
[28] 李文浩, 徐玲玲. 太阳能中温利用相变材料MgCl2·6H2O的热循环耐久性研究[J]. 功能材料, 2014(9): 127-131.
LI Wenhao, XU Lingling. Thermal cycle durability research on MgCl2·6H2O used as medium temperature PCM[J]. Solar Temperature Phase Change Material Functions, 2014(9): 127-131.
[29] LANE G A, ROSSOW H E. Hydrated MgCl2or Mg(NO3)2/MgCl2reversible phase change compositions: EP 0054758[P]. 1981-11-26.
[30] DING Q, LUO X, LIN X, et al. Study of magnesium nitrate hexahydrate and magnesium chloride hexahydrate mixture as Phase change material[C]//Power and Energy Engineering Confereence 2012 Asia-Pacific. IEEE,2012:1-4.
[31] GASIA J, GUTIERREZ A, PEIRÓ G, et al. Thermal performance evaluation of bischofite at pilot plant scale[J]. Applied Energy, 2015, 155: 826-833.
[32] 李卫萍, 阮德水. CaCl2·6H2O-MgCl2·6H2O多温截面的研究[J]. 华中师范大学学报(自然科学版), 1998, 32(1): 74-76.
LI Weiping, RUAN Deshui. Multi-temperature section of CaCl2·6H2O-MgCl2·6H2O[J]. Journal of Central China Normal University(Natural Science Edition), 1998, 32(1): 74-76.
[33] LI G, ZHANG B, LI X, et al. The preparation, characterization and modification of a new phase change material: CaCl2·6H2O-MgCl2·6H2O eutectic hydrate salt[J]. Solar Energy Materials and Solar Cells, 2014, 126: 51-55.
[34] 赵有璟, 时历杰, 康为清, 等. 相变温度可调的无机混盐体系相变储能材料[J]. 材料科学与工程学报, 2014, 32(1): 79-84.
ZHAO Youjing, SHI Lijie, KANG Weiqing. et al. Inorganic mixed salt system of adjustable phase transition temperature used as phase change materials[J].Materials Science and Engineering, 2014, 32 (1): 79-84.
[35] YONEDA N,TAKANASHI S. Eutectic mixtures for solar heat storage[J]. Solar Energy, 1977, 21(1): 61-63.
[36] NAUMANN R, EMONS H H. Results of thermal analysis for investigation of salt hydrates as latent heat-storage materials[J]. Journal of Thermal Analysis, 1989, 35(3): 1009-1031.
[37] 周权宝, 尹霞, 汪琼, 等. 体系Mg(NO3)2-MgCl2-H2O作为相变储能材料的相图预测[J]. 化学学报, 2011, 69 (15): 1725-1730.
ZHOU Quanbao, YIN Xia, WANG Qiong, et al. Phase diagrams of Mg(NO3)2-MgCl2-H2O system used as phase change material[J]. Chemical Journal, 2011(15): 1725-1730.
[38] MARCUS Y, MINEVICH A, BEN-DOR L. Solid-liquid equilibrium diagrams of common ion binary salt hydrate mixtures involving nitrates and chlorides of magnesium, cobalt, nickel, manganese, and iron(III)[J]. Thermochimica Acta, 2005, 432(1): 23-29.
[39] NAGANO K, OGAWA K, MOCHIDA T, et al. Thermal characteristics of magnesium nitrate hexahydrate and magnesium chloride hexahydrate mixture as a phase change material for effective utilization of urban waste heat[J]. Applied Thermal Engineering, 2004, 24(2/3): 221-232.
[40] 祝丹婷, 钱静, 蔡蓉. 混合水合盐作为储热相变材料的热物性能研究[J]. 包装工程, 2015(1): 65-69.
ZHU Danting, QIAN Jing, CAI Rong. Hydrated salt mixtures as a heat storage phase change material [J]. Packaging Engineering, 2015(1): 65-69.
[41] 陈娇, 张焕芝, 孙立贤, 等. CaCl2·6H2O/多孔Al2O3复合相变材料的制备与热性能[J]. 应用化工, 2014, 43(4): 590-593.
CHEN Jiao, ZHANG Huanzhi, SUN Lixian, et al. The preparation and thermal properties of CaCl2·6H2O/porous Al2O3composite phase change thermal[J]. Chemical Applications, 2014, 43(4): 590-593.
[42] 余丽秀, 孙亚光, 张志湘. 矿物复合相变储能功能材料研究进展及应用[J]. 化工新型材料, 2007, 35(11): 14-16.
YU Lixiu, SUN Yaguang, ZHANG Zhixiang. Development and application of mineral composite phase change materials[J]. New Chemical Materials, 2007, 35(11): 14-16.
[43] USHAK S, CRUZ M, CABEZA L, et al.Preparation and characterization of inorganic PCM microcapsules by fluidized bed method[J]. Materials, 2016, 9(1): doi: 10.3390/ma9010024.
[44] CHAIYASAT P, ISLAMM Z, CHAIYASAT A. Preparation of poly(divinylbenzene) microencapsulated octadecane by microsusp- ension polymerization: Oil droplets generated by phase inversion emulsification[J]. RSC Advances, 2013, 3(26): 10202-10207.
Recent progress in the use of magnesium chloride hexahydrate used as a phase change material
WANG Huichun, LING Ziye, FANG Xiaoming, YUAN Kunjie, ZHANG Zhengguo
(Key Laboratory of Enhanced Heat Transfer and Energy Conservation, The Ministry of Education, South China University of Technology, Guangzhou 510640, Guangdong, China)
Magnesium chloride hexahydrate (bischofite) has a phase transition temperature at about 117 ℃ with a phase change enthalpy of 160 kJ/kg. Such a material is non-flammable and has a high thermal conductivity and low price, and is therefore regarded as a promising phase change material (PCM) for medium temperature thermal energy storage applications. This paper aims to provide a state-of-the-art review on thermophysical properties of the material, including phase transition temperature, phase change enthalpy, heat capacity, thermal conductivity and density. Potential problems are identified for using the material as a PCM, including the extent of supercooling, phase separation, corrosion, and hygroscopicity of hexahydrate magnesium chloride. Discussion is made on possible solutions to these problems. It is concluded that good cycle stability could be achieved if a suitable nucleating agent and a thickener are used. Potential applications of the material as a PCM or as part of PCM mixtures are discussed.
thermal energy storage; phase change material; magnesium chloride hexahydrate; supercooling; phase separation
10.12028/j.issn.2095-4239.2016.0061
TK 02
A
2095-4239(2017)02-204-09
2016-08-19。修改稿日期:2016-11-16。
国家自然科学基金(U1507201和U1407132),广东省自然科学基金(2014A030312009)项目。
王会春(1989—),男,硕士研究生,主要研究方向为水合无机盐相变材料,E-mail:cehc@mail.scut.edu.cn;
张正国,教授,主要研究方向为储热技术、传热强化与节能,E-mail:cezhang@scut.edu.cn。
