认知冲突螺旋上升
2017-03-20施小萍
施小萍


[摘 要] 溶液中的平衡是相互影响的,从电离平衡和水解平衡的角度再认识碳酸氢钠溶液,得到三个与原有认知冲突的结论,并通过设置认知冲突,展开课堂教学,消除二轮复习中的盲点和疑点。
[关键词] 电离平衡;水解平衡;碳酸氢钠溶液;认知冲突;课堂教学
“等浓度的NaHCO3溶液pH大于等浓度的CH3COONa溶液”这一观点在中学化学中似乎已经成为定论,但我们在实验中发现并非如此。我们经探究得出了三个有悖于原有认知的结论:①等浓度的NaHCO3溶液pH小于等浓度的 CH3COONa溶液②NaHCO3溶液中CO32-、OH-离子浓度大小关系:c(CO32-)>c(OH-)③常温下0.1mol/LNaHCO3溶液与等体积等浓度的BaCl2溶液混合会生成BaCO3沉淀。我们通过设置有关这三个结论的认知冲突,展开课堂教学,消除学习过程中的盲点,构建新的认知。
一、等浓度的NaHCO3溶液和CH3COONa溶液pH大小问题
(一)问题发现
2015年浙江某地区高三二模考试中呈现了如下这组数据:已知在常温下测得如下6种0.1mol/L溶液的PH(见下表)这组数据可谓是一石激起千层浪。而有关等浓度的NaHCO3溶液和CH3COONa溶液pH比较的问题,在各地模拟考以及高考试题中均有涉及。我们怀着尊重科学,尊重客观事实的态度对这一问题进行了深入研究。
(二)质疑阶段
带着疑问我们查阅了很多资料,结果发现高中阶段的教辅资料,像学生常用的《5年高考3年模拟》《步步高》等资料中显示的都是等浓度的NaHCO3溶液pH大于等浓度的CH3COONa溶液,更有资料中将上述表格中8.3和8.8两个数据交换了位置,显然认为上表中的数据是错误的。而检索中国知网发现中学化学的常见核心期刊《化学教学》《中学化学教学参考》,有论文认为等浓度的NaHCO3溶液pH小于等浓度的 CH3COONa溶液[1]。总之说法不一而同。
(三)实验探究
事实是检验真理的唯一的标准,而化学实验的现象便是化学学科独有的事实,我们决定发挥化学实验的强大功能,展开科学探究,用数据说话。我们用pH计分别测定0.1mol/LNaHCO3溶液、0.1mol/LCH3COONa溶液的PH值,经多次测量显示0.1mol/LNaHCO3溶液pH=8.28,0.1mol/LCH3COONa溶液pH=8.96。由此可见众多中学教辅资料上的数据是错误的。
(四)理论分析
碳酸氢钠溶液中存在的平衡:
H2O ? H+ +OH-K①=1.0×10-14
HCO3- ? H+ +CO32- K②=5.6×10-11
HCO3- +H2O ? OH- +H2CO3 K③=2.3×10-8
原先認为等浓度的NaHCO3溶液pH大于等浓度的CH3COONa溶液,是做这样的分析而得出:CH3COOH的酸性强于H2CO3,所以CH3COONa的水解程度小于NaHCO3的水解程度,等浓度的盐溶液水解程度大的,溶液碱性越强。而实际上受HCO3-电离的影响,电离产生的H+中和了水解产生的OH-,使OH-离子浓度减小,pH减弱,因此等浓度的NaHCO3溶液pH小于等浓度的CH3COONa溶液。由此可见HCO3-的电离和水解是相互影响,相互促进的,只考虑电离或者水解都是不够全面、不够严谨的。
二、NaHCO3溶液中离子浓度大小问题
在中学化学常见的碳酸氢钠溶液中离子浓度大小关系排序是:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。这种结论出现的原因还是认为NaHCO3溶液中HCO3-水解是最主要的平衡,水解产生的c(OH-)相对较大,而忽略了HCO3-电离带来的影响。实际上电离产生的H+中和了水解产生的OH-,使平衡②、③平衡正向移动,HCO3-的电离和水解程度都增大。用方程叠加的方法处理方程①②③可得下列新方程,并经计算得出方程④的平衡常数:
HCO3-+HCO3-? CO32-+ H2CO3 K④=K②.K③/K①=1.3×10-4
从平衡常数可以看出④式HCO3-的自偶电离是碳酸氢钠溶液中进行程度最大的反应,根据浓度相等时,进行程度越大,所得离子浓度越大的原则,推导得出结论,碳酸氢钠溶液中离子浓度大小关系是:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
关于NaHCO3溶液中c(CO32-)>c(OH-)这一新的结论,我们也用数据计算的方法得到了证实。下图是碳酸氢钠在不同pH环境下它们不同形态的粒子的组成百分率图像:
由图可知,Ka2=c(CO32-)×c(H+)/c(HCO3-)=10-10.25,当pH=8.25时溶液中 c(HCO3-)/ c(CO32-)=100。0.1mol/LNaHCO3溶液中,c(HCO3-)≈0.1mol/L,则 c(CO32-)=10-3 mol/L, c(OH-)=10-5.75 mol/L,从数据计算的角度再一次说明NaHCO3溶液中的确是c(CO32-)>c(OH-)。
三、0.1mol/LNaHCO3溶液中滴加等浓度BaCl2溶液能否产生沉淀问题
经上述计算得出:0.1mol/LNaHCO3溶液中,c(CO32-)=10-3mol/L,这相当于浓度稍微小一点的碳酸钠溶液中的CO32-的浓度,那么往0.1mol/LNaHCO3溶液滴加BaCl2溶液,能否生成沉淀呢?我们做了如下实验:0.1mol·L-1BaCl2溶液与0.1mol·L-1NaHCO3溶液等体积混合,先有少量白色沉淀,无气泡,久置沉淀量变多,并有少量气泡产生。0.1mol/LNaHCO3溶液中c(CO32-)=10-3 mol/L,加入等体积等浓度BaCl2溶液,Qc= c(CO32-)×c(Ba2+)=0.5×10-3×0.05=2.5×10-5, ksp(BaCO3)=2.58×10-9 ,Qc大于ksp(BaCO3),能产生沉淀。由于CO32-、Ba2+的浓度都较小,所以一开始沉淀的量也较少。随着CO32-浓度的减小,自偶电离平衡正向移动,不断生成沉淀,溶液中H2CO3浓度增大,最终能观察到少量气泡。反应的离子方程式为:Ba2++2 HCO3-= BaCO3↓+ H2CO3。经计算可得该离子反应的平衡常数:
由此可见的确存在产生沉淀的可能性。
四、有关碳酸氢钠溶液研究结果在课堂教学中的应用
教学研究最终是为实际的课堂教学服务的,应该对课堂教学有裨益。这三个结论也是学生在长期的学习过程中形成的思维定势,我们以此为切入点,通过设计符合学生认知规律的教学环节,将这一研究成果应用于课堂教学,并在2016年市级高考化学复习研讨会活动中做了公开展示,在高三二轮复习中如何消除学生的思维定势,突破教学中的盲点和疑点等方面起了示范引领的作用。现将课堂教学过程摘要如下:
环节一:神奇功效的“苏打水”
【情境创设】投影苏打水、苏打片的商标,显示成分为碳酸氢钠
【设计说明】从生活实际引入话题:从平衡角度再认识碳酸氢钠溶液。苏打的成分是碳酸钠,为什么商标显示的是碳酸氢钠,这究竟是生活中的习惯性错误,还是另有玄机,利用第一次认知冲突激起学生的学习兴趣。
环节二:知识重现 碳酸氢钠溶液有关知识的判断
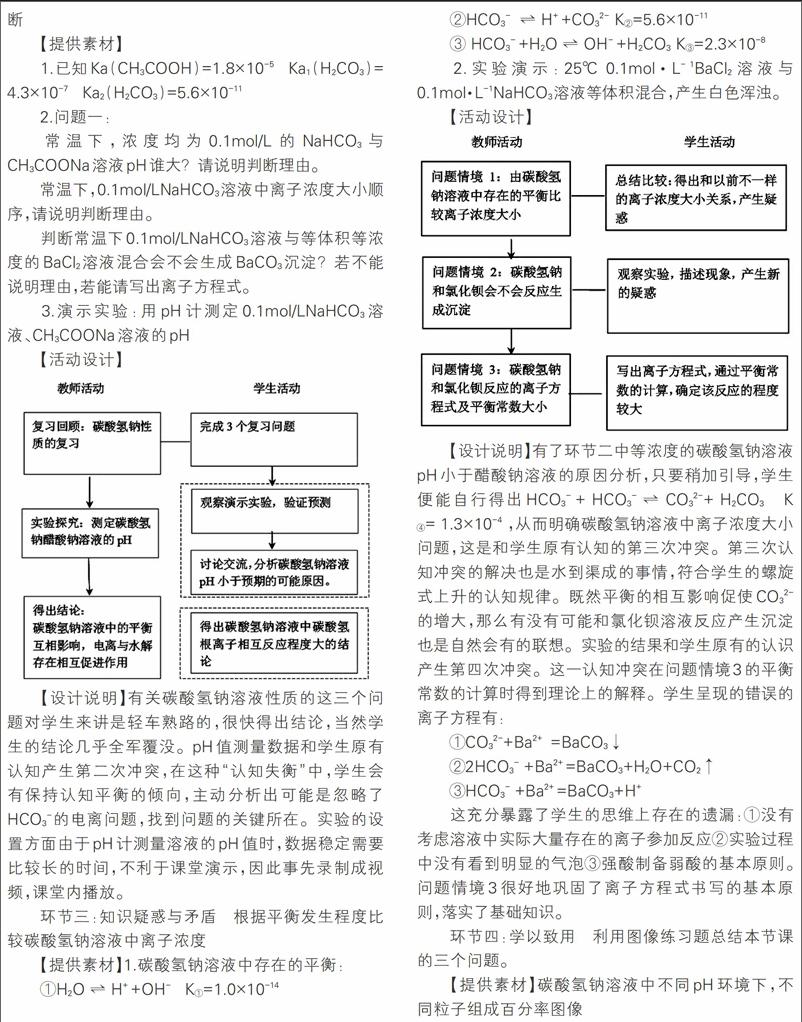
【提供素材】
1.已知Ka(CH3COOH)=1.8×10-5 Ka1(H2CO3)=4.3×10-7 Ka2(H2CO3)=5.6×10-11
2.问题一:
常温下,浓度均为0.1mol/L的NaHCO3与CH3COONa溶液pH谁大?请说明判断理由。
常温下,0.1mol/LNaHCO3溶液中离子浓度大小顺序,请说明判断理由。
判断常温下0.1mol/LNaHCO3溶液与等体积等浓度的BaCl2溶液混合会不会生成BaCO3沉淀?若不能说明理由,若能请写出离子方程式。
3.演示实验:用pH计测定0.1mol/LNaHCO3溶液、CH3COONa溶液的pH
【活动设计】
【设计说明】有关碳酸氢钠溶液性质的这三个问题对学生来讲是轻车熟路的,很快得出结论,当然学生的结论几乎全军覆没。pH值测量数据和学生原有认知产生第二次冲突,在这种“认知失衡”中,学生会有保持认知平衡的倾向,主动分析出可能是忽略了HCO3-的电离问题,找到问题的关键所在。实验的设置方面由于pH计测量溶液的pH值时,数据稳定需要比较长的时间,不利于课堂演示,因此事先录制成视频,课堂内播放。
环节三:知识疑惑与矛盾 根据平衡发生程度比较碳酸氢钠溶液中离子浓度
【提供素材】1.碳酸氢钠溶液中存在的平衡:
①H2O ? H+ +OH- K①=1.0×10-14
②HCO3- ? H+ +CO32- K②=5.6×10-11
③ HCO3- +H2O ? OH- +H2CO3 K③=2.3×10-8
2.实验演示:25℃ 0.1mol·L-1BaCl2溶液与0.1mol·L-1NaHCO3溶液等体积混合,产生白色浑浊。
【活动设计】
【设计说明】有了环节二中等浓度的碳酸氢钠溶液pH小于醋酸钠溶液的原因分析,只要稍加引导,学生便能自行得出HCO3- + HCO3- ? CO32-+ H2CO3 K④= 1.3×10-4 ,从而明确碳酸氢钠溶液中离子浓度大小问题,这是和学生原有认知的第三次冲突。第三次认知冲突的解决也是水到渠成的事情,符合学生的螺旋式上升的认知规律。既然平衡的相互影响促使CO32-的增大,那么有沒有可能和氯化钡溶液反应产生沉淀也是自然会有的联想。实验的结果和学生原有的认识产生第四次冲突。这一认知冲突在问题情境3的平衡常数的计算时得到理论上的解释。学生呈现的错误的离子方程有:
①CO32-+Ba2+ =BaCO3↓
②2HCO3- +Ba2+ =BaCO3+H2O+CO2↑
③HCO3- +Ba2+ =BaCO3+H+
这充分暴露了学生的思维上存在的遗漏:①没有考虑溶液中实际大量存在的离子参加反应②实验过程中没有看到明显的气泡③强酸制备弱酸的基本原则。问题情境3很好地巩固了离子方程式书写的基本原则,落实了基础知识。
环节四:学以致用 利用图像练习题总结本节课的三个问题。
【提供素材】碳酸氢钠溶液中不同pH环境下,不同粒子组成百分率图像
【活动设计】
【设计说明】利用图像练习题总结本节课的三个问题,落实平衡常数的计算等基础知识,同时从计算所得数据上直观认识碳酸氢钠溶液中离子浓度大小关系,强化了本节课得出的三个新的结论:
环节五:本节课的疑惑和收获
【设计说明】由于这节课所得的结论和学生原有的认知是完全相反的,学生不免有这样的疑虑:考试怎么办?我们的原则是:实事求是,尊重科学,尊重客观事实,相信高考题也是不会有科学性问题的。给学生一颗定心丸,解除学生的疑虑。
五、总结与反思
(一)研究过程
我们经历了:发现问题→问题质疑→查阅资料→实验测定→理论分析→数据分析→得到结论等一系列过程,以实验现象为依据,以理论分析为推手,将问题层层深入,符合科学探究的一般过程。
在研究过程中,我们的最初设想是通过实验的方法直接测定碳酸氢钠溶液中碳酸根离子的浓度,但是由于现有设备的限制,没有直接用于测定碳酸根离子浓度的传感器等手持技术,因此未能直接测得数据,而是间接采用数据计算理论推导的方式来解决论题。
我们研究过程中所用溶液均采用0.1mol/L,主要是考虑课堂演示实验有比较明显的现象。而实际上由于NaHCO3溶液本身是缓冲溶液,随着溶液浓度的变化,溶液pH变化幅度NaHCO3溶液要小于CH3COONa溶液,这一问题我们未展开更深入的研究[2]。
(二)教学过程
本节课课堂教学设计紧紧围绕学生原有三个错误认知展开,通过五个环节的活动,两个实验的探究,六个问题的解决,理论联系实际,消除学生的思维定势。同时让学生体验了科学探究的过程,学习了科学研究的基本方法,加深了对科学本质的认识,有利于学生形成科学的自然观和严谨求实的科学态度。
在这三个问题上学生几乎无一例外地出现了错误,这和长期的作业的巩固训练形成惯性思维定势有很大关系。相信在新课刚刚接触溶液中的平衡时,学生对这样的问题是会有各种想法、心存疑虑的,但是到了高三二轮复习的时候却众口一词了。因此教师在教学过程中既要让学生学会思考问题的基本方法,但是又不能扼杀了学生的灵感,浇灭学生智慧的火花,要防止学生思维的僵化,这两者之间的平衡是教师需要斟酌和把握的,也是教学过程中的难点所在。
(三)疑虑之处
研究过程发现各种弱酸溶液中不同pH环境下,不同粒子组成百分率图像都是没有显示酸的浓度的,可见粒子组成百分率和溶液浓度没有大的联系。这是因为一般的含氧酸有氢键的影响,还是像碳酸氢钠这样溶液本身能形成缓冲体系有关,我们还没得到证实。
六、结束语
从平衡角度再一次认识碳酸氢钠溶液,无论是教师的研究过程、教学过程,还是学生的学习过程,对这样心存疑虑的问题,通过实验探究、理论分析去解决问题的方法,是值得我们去做更多的尝试的,尝试的过程便是学习的过程,是科学研究的过程,是享受化学带来愉悦的过程。
[参 考 文 献]
[1]吴正帅,任志斌.等浓度的NaHCO3溶液和CH3COONa溶液pH比较[J].中学化学,2014(6).
[2]谢雕,唐娅.等浓度的NaHCO3溶液和CH3COONa溶液pH比较研究[J].化学教与学,2016(2).
(责任编辑:张华伟)
