脂肪干细胞促进可注射性“软骨细胞砖-富血小板血浆”复合体形成异位软骨的实验研究
2017-03-19李治冶董岩冯晓珂曹强吴炜巴睿恺赵铱民
李治冶 董岩 冯晓珂 曹强 吴炜 巴睿恺 赵铱民
大量的研究采用组织工程技术将种子细胞负载于支架材料,成功地实现了软骨再生[1]。然而,现有的方法很难实现微创,可注射性软骨细胞砖-富血小板血浆(chondrocyte bricks- platelet rich plasma, CB- PRP)复合体,作为一种完全自体来源的组织工程复合体,可负载骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)通过皮下注射的方式可实现软骨再生[2-3]。不过,BMSCs因取材较难、数量相对有限等因素阻碍了其进一步的临床应用[4]。脂肪干细胞(adipose- derived stem cells, ADSCs)可以从皮下组织中大量分离获取,并具备骨向、软骨向和脂肪向等多项分化潜能[5]。因此在软骨再生领域,ADSCs被认为是一种更理想的种子细胞。本研究把ADSCs负载于CB- PRP复合体中,探究其能否作为种子细胞促进异位软骨的形成。
1 材料与方法
1.1 材料和设备
成人ADSCs、成人BMSCs(Cyagen);成人软骨细胞(Sciencell,美国);高糖DMEM培养基、胰酶、双抗、PBS缓冲液(Hyclone,美国);胎牛血清(Gemini,美国);抗坏血酸、柠檬酸钠(Sigma,美国);凝血酶(Biomedical,西班牙);细胞培养箱(Thermo Scientific,美国);显微镜电脑分析系统(Nikon CX J30,日本)。
1.2 软骨细胞砖的制备与组织学鉴定
成膜培养软骨细胞约15 d后,用多片刀切割器将细胞膜片切割成面积约为1 mm2小颗粒,即CB。PBS冲洗两次后重悬于PBS中待用。取适量CB置于4%多聚甲醛中固定24 h后做石蜡切片,经HE和Safranin- O染色后镜下观察。
1.3 PRP的提取和制备
挑选健康志愿者,签署知情同意书。配制3.8%柠檬酸钠抗凝液,取肘正中静脉血9 ml后加入1 ml抗凝液。两步离心法制备PRP:静脉血以1 800 r/min离心8 min后分为3 层:血细胞层(底层)、PRP层(中层)和乏血小板血浆层(顶层)。弃掉底层后以3 600 r/min离心8 min,留下底层1/4为PRP,置于冰中待用。
1.4 “干细胞- CB- PRP”复合体的构建及异位成软骨实验
1.4.1 “干细胞- CB- PRP”复合体的构建 将ADSCs和BMSCs分别扩增培养,第2代细胞用于后续实验。
实验组(ADSCs- CB- PRP):将约2.25×107个ADSCs,软骨细胞砖(原始软骨细胞数量为7.5×106个)与500 μl PRP混合后吸入2 ml注射器,加入50 μl凝血酶混匀后待其凝结。对照组(BMSCs- CB- PRP):将约2.25×107个BMSCs,软骨细胞砖(原始软骨细胞数量为7.5× 106个)与500 μl PRP混合后吸入2 ml注射器,加入50 μl凝血酶混匀后待其凝结。
1.4.2 裸鼠背部皮下注射实验 6~8 周龄雄性裸鼠10 只,随机分为2 组。1%戊巴比妥钠腹腔注射麻醉后,2 组复合体分别通过16G针头注射至实验组和对照组裸鼠背部皮下组织。
1.4.3 “干细胞- CB- PRP”复合体的大体形态观察
12 周后处死裸鼠并取材,观察比较2 组复合体在形态、色泽、光滑度和弹性等方面的异同。
1.4.4 “干细胞- CB- PRP”复合体的组织学分析 将标本在4%多聚甲醛固定24 h后浸入10%EDTA脱钙处理2 周,石蜡包埋切片后,进行HE、Safranin- O和TB染色观察,并对Safranin- O和TB染色阳性区域面积进行定量计算。
1.5 统计学分析
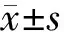
2 结 果
2.1 软骨细胞砖的组织学观察
培养约15 d后,软骨细胞形成白色半透明细胞膜片,表面平整且无褶皱、破溃(图 1A)。切割后,软骨细胞膜片形成一致的颗粒化“软骨细胞-细胞外基质”复合体,即软骨细胞砖(图 1B)。HE染色显示软骨细胞砖在垂直方向上由2~4 层圆形的软骨细胞构成,周围环绕有丰富的细胞外基质,其厚度约为50~90 μm(图 1C)。Safranin- O染色显示细胞外基质中显示大量均匀的桔红色深染区域(图 1D)。
A: 软骨细胞膜片; B: 软骨细胞砖; C~D: 软骨细胞砖的HE和Safranin- O染色
2.2 大体形态观察结果
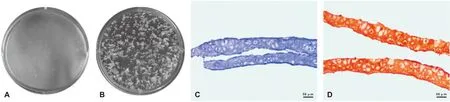
经凝血酶激活后,流动的复合体逐渐凝结成凝胶样结构(图 2A)。注射后,复合体具有足够的机械强度,可在裸鼠皮下维持一定的大体形态(图 2B)。经过12 周的体内生长,2 组复合体均可观察并触及裸鼠背部明显的半圆形隆起(图 2C、2D)。与周围组织分离后,2 组复合体均呈现轮廓规则、表面光滑、具有弹性的乳白色半透明的软骨样形态。此外,2 组复合体均与周围组织实现了良好的融合,复合体表面及周围可见明显的血管分布,表明2 组复合体均可在动物体内存活并生长,无明显吸收和变形(图 2E、2F)。
2.3 组织学结果
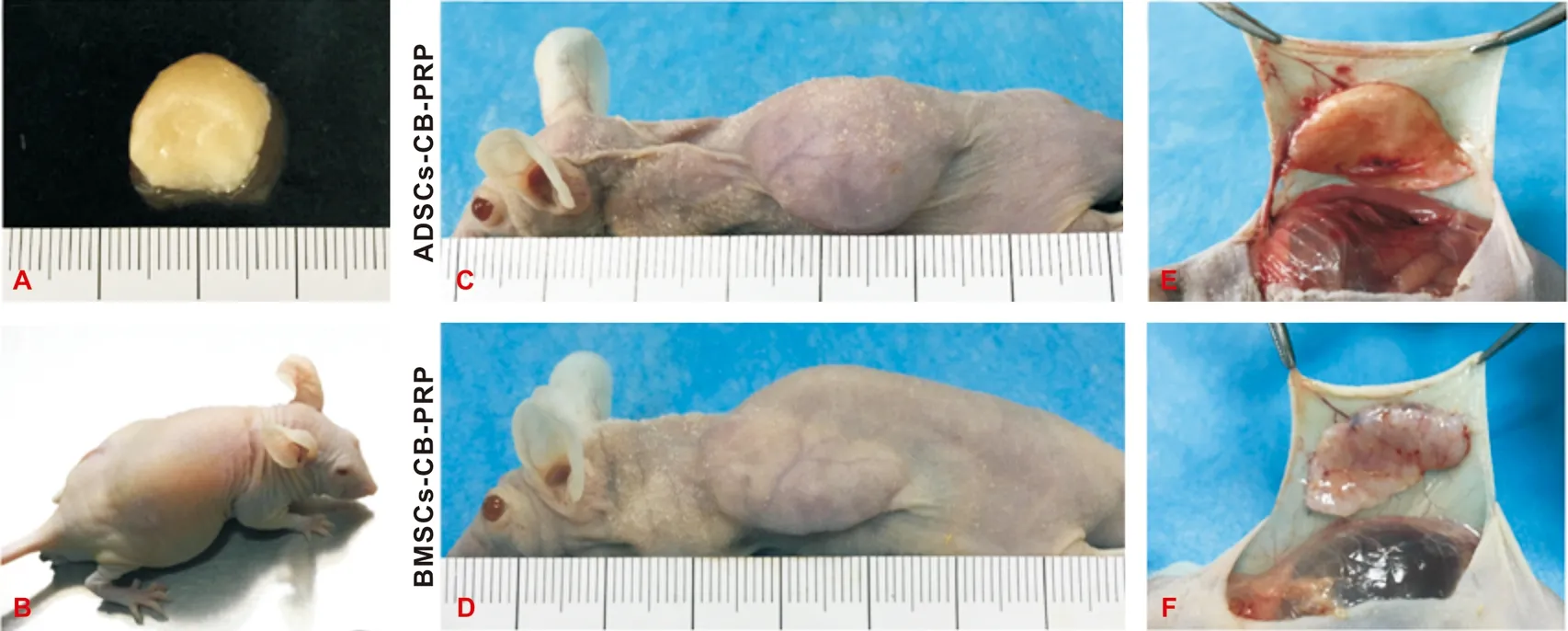
HE、Safranin- O及TB染色结果显示,2 组复合体均观察有较大较圆的成熟软骨细胞位于软骨陷窝内,成群分布在中央,周围包绕丰富的细胞外基质,Safranin- O和TB染色在细胞外基质中呈强阳性,符合软骨的典型组织学表现。较小较扁的幼稚软骨细胞尚未成熟,单个分布在周围,细胞外基质较少,Safranin- O和TB染色颜色稍浅,呈弱阳性(图 3A~F)。定量分析显示,Safranin- O染色阳性区域面积在实验组占总面积的66.10%±7.81%;在对照组占62.11%±6.39%(P>0.05)(图 3G)。TB染色阳性区域面积在实验组占总面积的61.85%±8.22%;对照组占57.26%±7.63%(P>0.05)(图 3H)。
A: 凝血酶激活后的复合体; B: 注射后裸鼠背部可见明显隆起; C~D: 2 组复合体在裸鼠体内生长12 周; E~F: 2 组复合体均呈现软骨样大体形态
图 3 “干细胞- CB- PRP”复合体的组织学观察与检测
3 讨 论
对于颌面部软骨组织的缺损修复,传统的手术方法往往造成明显的创伤和疤痕[6]。现有的方法是将种子细胞负载于支架材料并加入相应细胞因子,采用组织工程的方法来改善和提高新生软骨的特性[2]。目前的支架材料虽然具有良好的生物降解性和生物活性,但却无法有效地实现微创修复。
前期研究发现将成膜培养的软骨细胞制备成CB并与PRP混合后,再将扩增培养的软骨细胞负载至其中,形成的“软骨细胞- CB- PRP”复合体可通过注射的方式实现软骨组织的再生[2];为了优化实验方法并减少软骨细胞的用量,用单纯扩增的BMSCs取代软骨细胞,构建出“BMSCs- CB- PRP”复合体,成功实现软骨组织再生,并能够有效改善复合体中央的血流灌注情况[3]。该复合体能够在体内形成软骨发育的微环境,通过启动机体自身的愈合机制进而形成软骨组织,在保证移植物具有足够机械强度的同时,又确保其具有良好的塑形性和可注射性以满足颌面部软骨组织不同形态缺损的微创修复[4,7]。BMSCs虽然作为经典的种子细胞在软骨缺损修复领域被大量研究,但是其取材困难、细胞数量相对有限和分化能力随年龄退化等弊端往往阻碍其实现进一步的临床转化。
Zuk等[5,8]研究发现ADSCs同样具有形成软骨样基质的能力。ADSCs不仅具备软骨向分化的能力,而且在人体中含量更丰富、获取更容易、随年龄增长而出现分化能力退化的程度更为缓慢[9-10]。因此本研究把ADSCs负载于CB- PRP复合体,探索其作为种子细胞实现颌面部软骨组织微创修复的可行性。
通过实验发现,经过约15 d的培养,组织学结果显示软骨细胞不仅可以贴壁生长,还可以在垂直方向上通过细胞扩增和细胞外基质的沉积实现CB在厚度上的增加,大量的糖胺多糖被分泌至细胞外参与了细胞外基质的形成。CB中包含有大量的软骨细胞和丰富的细胞外基质。激活后,CB- PRP复合体形成的凝胶样结构具有高度的可塑性,可将干细胞稳定负载于其中。ADSCs- CB- PRP和BMSCs- CB- PRP 2 组复合体经过体内12 周的生长均能够完成组织重塑,并与机体实现融合。2 组复合体均具呈现良好的软骨样形态,无明显吸收和变形。组织学结果显示,2 组复合体均呈现软骨组织的典型组织学表现并有新生的软骨细胞形成。对Safranin- O和TB染色阳性区域面积百分比进行定量分析显示,ADSCs- CB- PRP组较BMSCs- CB- PRP组形成了更多的软骨组织,但无统计学差异。因此,我们认为ADSCs可以作为一种理想的种子细胞应用于可注射性细胞砖技术中,ADSCs- CB- PRP复合体能够在动物体内形成具有良好形态、机械强度和软骨表型的新生组织工程软骨。
ADSCs的引入推进了可注射性细胞砖技术的临床转化,为其在颌面部微创软骨修复领域的应用提供了新的方法和途径。不过,如何再进一步减少软骨细胞的用量和培养的难度则需更多的研究去探索。此外,复合体内新生软骨细胞的来源,ADSCs的最终去向及其软骨形成机制仍需要进一步的研究和探讨。
