B类Ⅱ型清道夫受体在牙龈卟啉单胞菌影响泡沫细胞形成中的作用
2017-03-19贺晓丽梁冬雨刘峰陈建霞罗礼君
贺晓丽 梁冬雨 刘峰 陈建霞 罗礼君
动脉粥样硬化(atherosclerosis, AS)是一种炎症性的疾病,单核细胞分化为巨噬细胞并摄入大量氧化型低密度脂蛋白(oxidized low density lipid, ox- LDL)形成泡沫细胞是AS早期最主要的病理特征。相关的临床研究均发现在动脉粥样硬化斑块中牙龈卟啉单胞菌(Porphyromonasgingivalis,P.g)的检出率最高,几乎达到100%,这就证明P.g与动脉粥样硬化的发生、发展密切相关[1]。另外,各种研究也显示P.g可能通过引起血小板的凝集、侵入动脉和心脏内皮细胞、促进巨噬细胞向泡沫细胞的形成、引发机体的免疫反应等方面加速和影响AS的发病进程[2-5]。但其确切机制尚有待进一步研究。
清道夫受体(scavenger receptors, SRs)是一类细胞表面糖蛋白,也是一种模式识别受体,主要分布于单核/巨噬细胞,具有转运脂质的功能,在AS等脂代谢相关疾病中起着重要作用。SRs可以分为A、B、C、D、E、F、G七大类型,B类清道夫受体主要包括SR- BI、SR- BⅡ、CD36 3 个亚型,合称CD36超家族。其中CD36与ox- LDL的识别、转运、细胞内大量脂质的堆积等AS形成密切相关[6-8]。我们之前的研究证实[9],P.g的炎症刺激可以促进巨噬细胞CD36的表达,从而诱导加剧泡沫细胞形成。B类Ⅱ型清道夫受体(scavenger receptor class B type Ⅱ, SR- BⅡ, SR- B2),又称2型溶酶体整合膜蛋白(lysosomal integral membrane protein 2, LIMP2),是一种溶酶体膜糖蛋白,在粗面内质网中合成,并且在溶酶体及内涵体等部位中大量存在[10-11]。本研究的目的是了解作为B类清道夫受体中的一员,SR- BⅡ在P.g诱导泡沫细胞形成过程中的变化、作用及相关机制。
1 材料与方法
1.1 实验材料
1.1.1 主要仪器 Lightcycler480荧光定量PCR仪(Roche,美国),倒置相差显微镜(Nikon,日本)等。
1.1.2 主要试剂 C57/BL6野生型小鼠(同济大学提供),ox- LDL(上海启晰生物科技有限公司),牙龈卟啉单胞菌ATCC3327(上海交通大学医学院口腔医学研究所李鸣宇教授馈赠),大肠杆菌(Escherichiacoli)ATCC25922(广州环凯生物科技公司),脂多糖(Lipopolysaccharides, LPS)来自大肠杆菌0111; B4、油红O(Sigma,美国);siRNA1、siRNA2(吉玛基因),siPORTTMNeoFXTM转染试剂(Ambion,美国),兔抗人LIMP2单克隆抗体(北京博奥森生物技术有限公司)等。
1.2 实验方法
1.2.1 小鼠腹腔巨噬细胞获取及培养 6~8 周的C57/BL6小鼠,腹腔注射2 ml浓度为40 ml/L的巯基乙酸,2 d后用PBS灌洗腹腔收集细胞。细胞计数后离心弃上清并重悬于含双抗的RPMI 1640培养基中,将细胞接种到12孔板和24孔板,每孔细胞数量分别为1×106和5×104。置于CO2恒温培养箱中培养。
1.2.2 细菌培养 将P.g冻存羊血接种于BHI血琼脂平板,置于厌氧箱进行培养。待血平板上长满黑色菌落后刮取部分置于BHI液体培养基中培养24~48 h,镜下和生化鉴定其为纯培养后,离心(5 000 r/min, 5 min)、弃上清,无菌PBS洗涤3 次后使菌液重悬,用比浊仪测定OD600的值。
1.3 泡沫细胞形成的检测
24孔板中的细胞在加入ox- LDL(100 μg/ml)、P.g(moi=200)等各种刺激后置于培养箱中培养20 h,之后40 g/L甲醛固定30 min,沿侧壁加入500 μl油红O孵育10 min以后加入600 ml/L异丙醇并保持30 s~1 min,PBS洗涤3 次,倒置相差显微镜观察泡沫细胞的形成并计算阳性比。
1.4 Western blot检测泡沫细胞形成过程中蛋白含量的变化
12孔板中的细胞加入各刺激之后置于培养箱中培养,并分别在0、3、6、9、12、24 h时收集细胞蛋白并检测蛋白含量。加入上样缓冲液并煮样,之后电泳、转膜、牛奶封闭后加入LIMP2单克隆抗体(抗体浓度1∶100)4 ℃孵育过夜,1×TBST洗膜5 min×5 次后二抗室温孵育2 h,充分洗膜后显影观察。使用Image J 1.43软件将图片上每个特异条带灰度值数字化,并与GAPDH灰度值进行比较分析。
1.5 Real- time PCR法检测泡沫细胞形成过程中基因含量的变化
12孔板中的细胞加入刺激后在各时间点用Trizol收集细胞,提取细胞的总RNA后进行浓度测定并逆转录成cDNA,置于-20 ℃备用。设计基因的上下游引物序列如下:Gapdh- F(5'- TGACCACAGTCCATGCCATC- 3' ),Gapdh- R(5'- GACGGACACATTGGGGGTAG- 3' ),Limp2- F(5'- TGGACCACAGACACATGCAAT- 3' ),Limp2- R(5'- CGTTCTCAAAGCTGCTGAAAG- 3' )。
引物均由生工生物工程上海(股份)有限公司合成。PCR反应体系为20 μl,反应条件为95 ℃30 s→95 ℃5 s→60 ℃34 s,持续40 个循环。反应结束后,根据内参基因Gapdh以及目的基因Limp2的Ct值计算出各样本RNA的表达量。
1.6 siRNA干扰
设计合成的siRNA序列如下:Negative control:5'- UUC UCC GAA CGU GUC ACG UTT- 3' (正义链),5'- ACG UGA CAC GUU CGG AGA ATT- 3' (反义链);Mouse Limp2- 1:5'- CCA GAC GAU CGA GAA GAA UTT- 3' (正义链),5'- AUU CUU CUC GAU CGU CUG GTT- 3' (反义链);Mouse Limp2- 2:5'- GCU CCG GAA CAA GGC AAA UTT- 3' (正义链),5'- AUU UGC CUU GUU CCG GAG CTT- 3' (反义链)。
在转染试剂的作用下,将negative control、Limp2- 1、Limp2- 2、Limp2- 1+2(终浓度均为10 μmol/L)转到12或24孔板中。转染6~8 h后换成含双抗的1640培养基,48 h后加入P.g刺激,8 h后收样。24孔板用于油红O染色。
1.7 统计学分析
2 结 果
2.1 P.g促进泡沫细胞的形成
ox- LDL以及P.g刺激小鼠腹腔巨噬细胞,经过油红O染色,可以观察到空白组(NC)及P.g组没有泡沫细胞的形成(图 1)。只加入ox- LDL后,可以看到有少量泡沫细胞的形成,约占20%~30%,而共同加入P.g及ox- LDL后泡沫细胞约占60%~70%(图 2)。结果表明P.g可以促进巨噬细胞的泡沫化进程。
2.2 P.g诱导SR- BⅡ表达的增加。
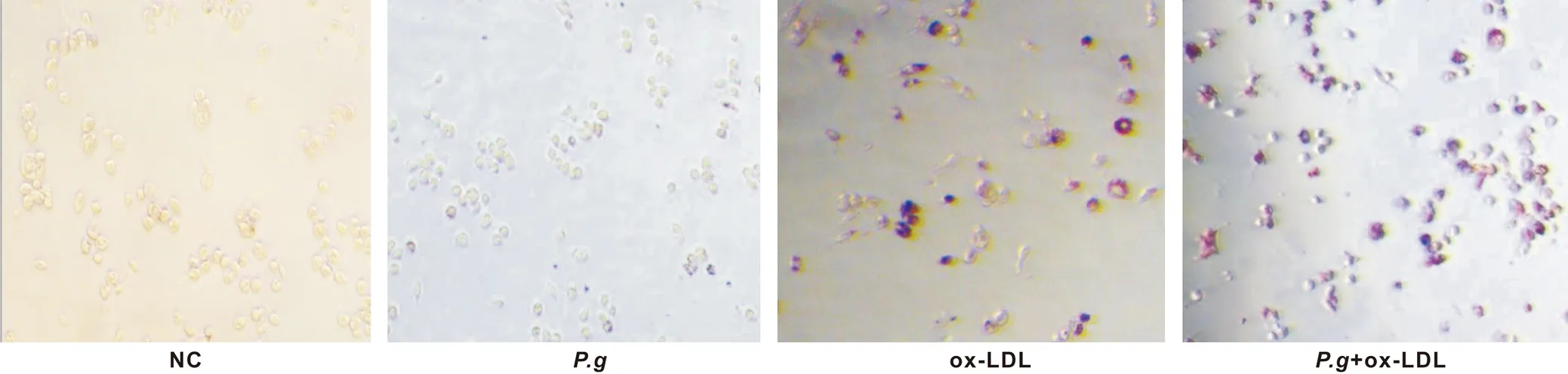
图 1 油红O染色显示P.g促进泡沫细胞的生成
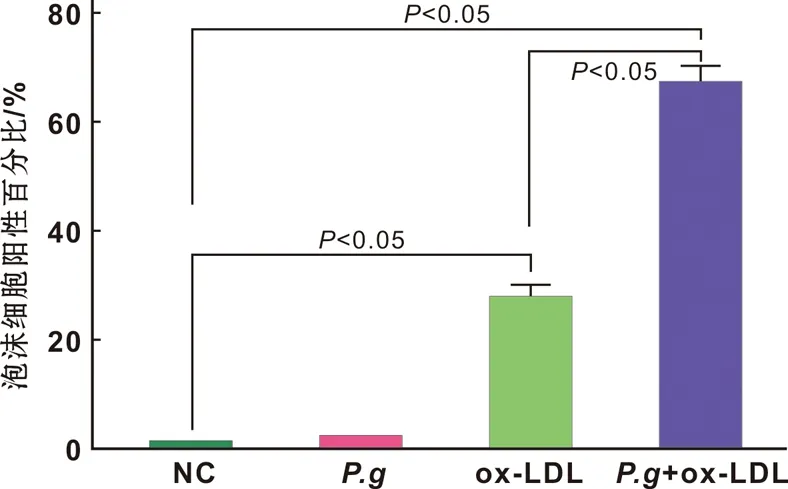
图 2 4 组细胞中泡沫细胞阳性百分比
蛋白检测结果显示,只加入ox- LDL刺激后,SR- BⅡ蛋白的表达有所增加,在3 h左右开始上升、6 h达到峰值;只加入P.g刺激后,SR- BⅡ蛋白的表达量比只加入ox- LDL有明显增加和延长;而同时加入P.g和ox- LDL刺激后,SR- BⅡ蛋白有较强的表达且明显的延长(图 3A)。Real- time PCR结果显示,各组刺激后SR- BⅡ基因的表达水平与蛋白水平的表达趋势基本一致(图 3B)。结果表明,在泡沫细胞形成过程中,ox- LDL和P.g的刺激都可以促进SR- BⅡ的部分表达;但P.g的加入对SR- BⅡ表达有明显的叠加效果。
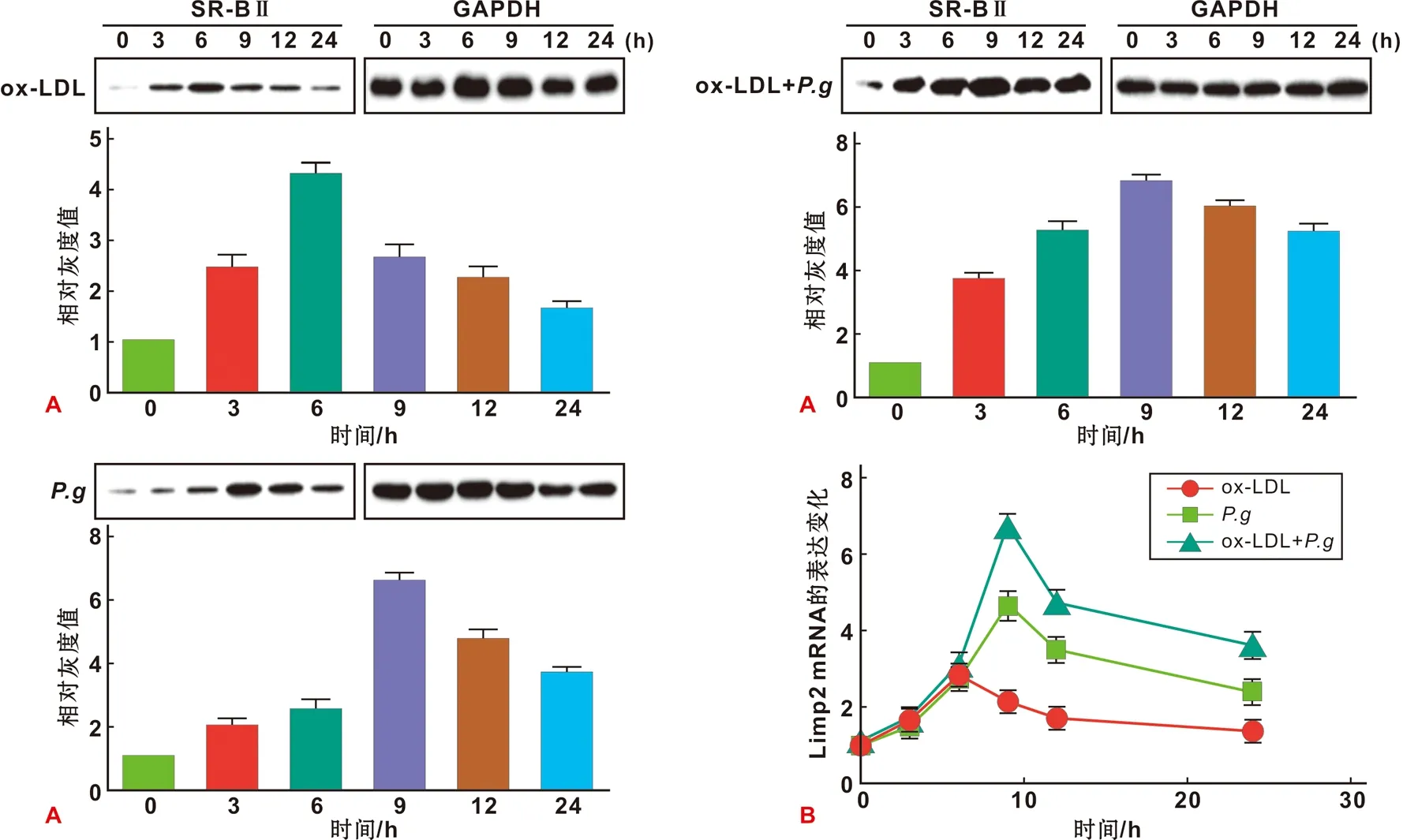
图 3 P.g诱导SR- BⅡ表达增加
比较P.g(moi=200)、E.coli(moi=10)、LPS(200 ng/ml)刺激小鼠腹腔巨噬细胞后SR- BⅡ的蛋白表达情况。结果示E.coli和LPS均未引起巨噬细胞中SR- BⅡ蛋白表达的明显改变(图 4)。表明P.g在泡沫细胞形成过程中促进SR- BⅡ蛋白的表达具有特异性。
2.3 SR- BⅡ参与调控P.g诱导的泡沫细胞形成
采用siRNA沉默SR- BⅡ的表达后,检测相关刺激对泡沫细胞形成的影响。结果显示,siRNA干扰之后SR- BⅡ蛋白的表达量明显降低,且2 种siRNA合用的干扰效果最佳(图 5A)。与正常对照组相比较,siRNA干扰后,无论是单纯ox- LDL刺激,还是P.g+ox- LDL刺激诱导的泡沫细胞形成均明显减少(图 5B)。
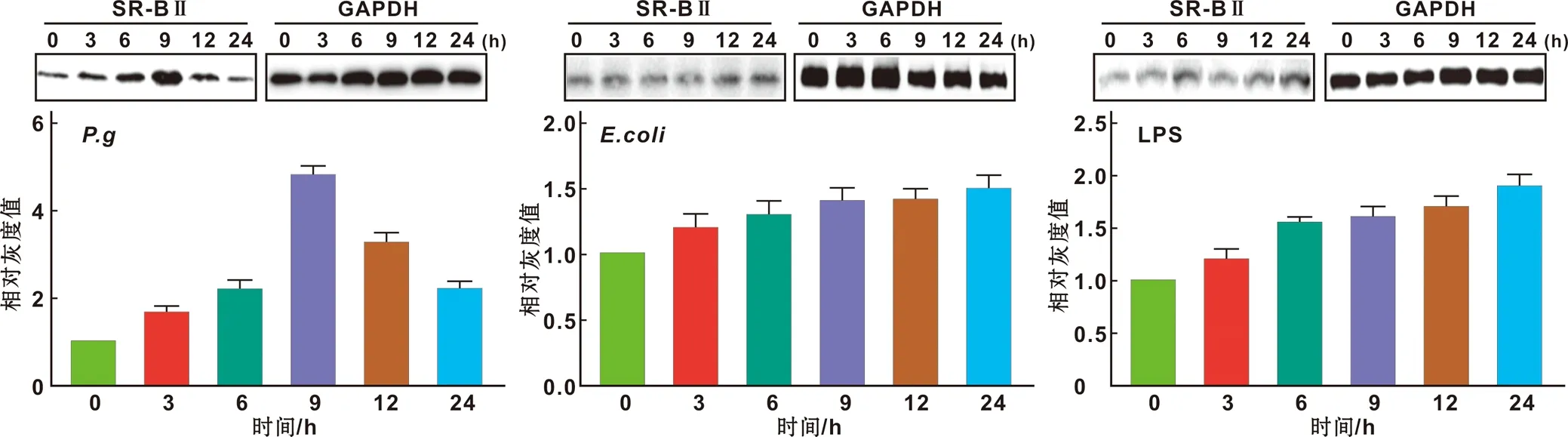
图 4 P.g诱导SR- BⅡ表达增加具有特异性
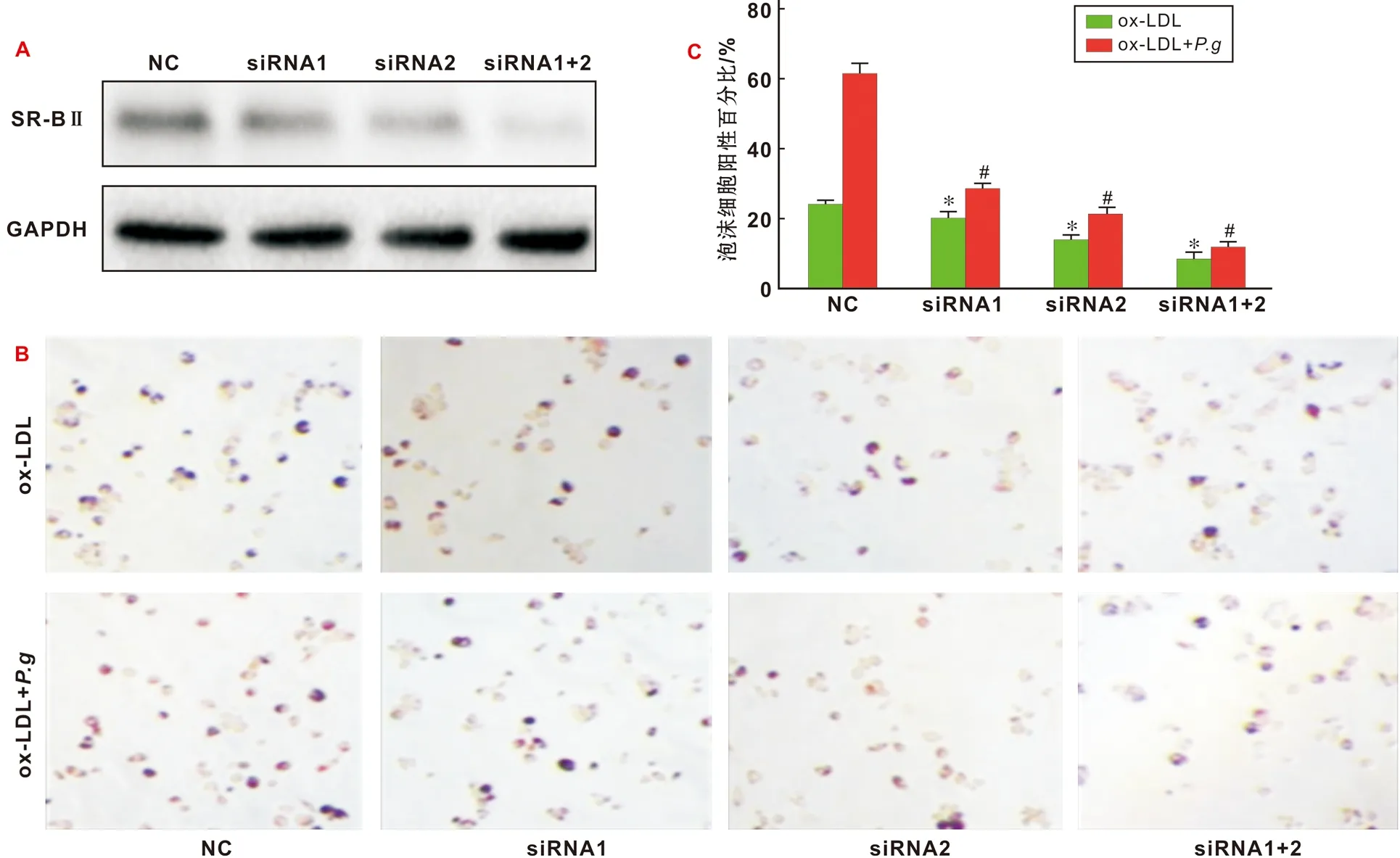
图 5 SR- BⅡ表达沉默后泡沫细胞生成减少(*, P<0.05; #, P<0.05)
3 讨 论
本研究发现P.g、ox- LDL共同刺激能明显增加小鼠腹腔巨噬细胞泡沫化的形成。ox- LDL单独诱导泡沫细胞形成过程中有SR- BⅡ的表达;单独采用P.g刺激巨噬细胞,SR- BⅡ的表达有所增强;而在二者共同刺激下,SR- BⅡ的表达呈现出非常明显的叠加效果。在进一步的实验中,我们分别采用P.g、E.coli和LPS刺激巨噬细胞,发现P.g对SR- BⅡ表达的上调具有特异性。同时,干扰沉默SR- BⅡ的表达,也会影响到P.g促进的泡沫细胞形成。
既往研究表明,SR- BⅡ在对溶酶体蛋白的转运、介导某些病毒及细菌的侵入及心肌肥厚等方面发挥作用,与进行性肌痉挛性癫痫、代谢病、心肌炎、手足口病等疾病有不同程度的关联[12-14],但尚未有文献报道其在脂蛋白代谢及AS中的作用。Brown等[15]通过建立低密度脂蛋白受体基因敲除小鼠模型研究P.g在加快动脉粥样硬化进程中的作用及机制,研究结论是TLR2- CD36/ SR- B2依赖的通路会促进P.g介导的动脉粥样硬化形成,但文中采用的抗体是针对CD36/ SR- B2的抗体,并非仅针对SR- BⅡ的特异性的研究。
心脑血管疾病是发展中国家的第一死亡原因[16]。AS是心脑血管疾病的主要病理基础。目前公认[17-18],长期反复的慢性炎症是动脉粥样硬化形成与扩展的一个重要原因。清道夫受体家族和P.g是动脉粥样硬化形成的2 个关键要素。由于SR- BⅡ主要介导溶酶体对β- 葡糖脑苷脂酶的转运,也是肠道病毒71型和柯萨奇病毒的受体,所以研究者更多关注其在代谢病、手足口病等疾病中的作用。最近的研究证实[19],SR- BⅡ蛋白形成螺旋束结构负责与配体的结合(如β- 葡糖脑苷脂酶),而根据同源性推断,CD36,SR- BI也是通过相似的结构结合配体。这一发现为进一步深入研究SR- BⅡ在脂蛋白代谢中的作用奠定了基础。我们的研究表明,SR- BⅡ在泡沫细胞形成中,尤其是牙龈卟啉单胞菌促进的泡沫细胞形成过程中发挥关键作用。这对未来进一步研究AS病理过程、了解P.g在AS过程中的致病机制有重要意义。
