磷酸钙复合材料构建模式对颌骨缺损修复效率的影响
2017-03-19李元吴迪王天珏周宏志胡开进
李元 吴迪 王天珏 周宏志 胡开进
因炎症、外伤、肿瘤等原因所致的牙槽骨、颌骨缺损可严重影响患者口腔功能及美观,骨替代材料引导和诱导骨再生是骨缺损修复重建的研究热点[1-2]。自固化磷酸钙(calcium phosphate cement, CPC)可与水或水溶液调拌为糊剂后自行固化形成磷灰石,具有良好的生物相容性、骨引导性、可塑形性和抗压性,是骨缺损区域理想的生物充填材料[3-4]。但是,单纯的CPC材料存在缺乏诱导骨再生活性、体内降解速度较慢等问题,不适合牙槽骨或颌骨缺损修复。近年来研究表明神经多肽P物质(Substance P,SP)不仅是痛觉传导分子,还是骨再生与改建的信号分子,能够诱导骨髓间充质细胞向成骨细胞分化,并诱导血管新生[5-9]。据此,本研究采用SP、Ⅰ型胶原(Col- Ⅰ)与CPC模块化仿生设计构建复合骨替代材料,观察不同构建模式对材料修复颌骨缺损效率的影响。
1 材料与方法
1.1 模块化复合材料的构建
自固化磷酸钙人工骨(商品名:瑞邦骨泰)[国食药监械(准)字2013第3460199号,上海瑞邦生物材料有限公司];P物质(多肽氨基酸序列RPKPQQFFGLM- NH2,纯度>98%)购自上海生工公司,配制工作浓度10-3mol/L;Ⅰ型胶原取材于SD雄性大鼠尾腱,5 mol/L醋酸溶解48 h,离心去除杂质,双蒸水半透膜(截留分子量25 000)透析72 h去除醋酸,获得3%胶原溶液;胶原溶液-60 ℃冻干24 h,剪切获得1 mm×1 mm×1 mm胶原海绵颗粒;胶原溶液内加入0.1 mol/L浓度MES配制中性缓冲液,再加入10-3mol/L SP及共价交联剂EDC/NHS,SP/EDC/NHS摩尔比1∶1.2∶0.6,磁力搅拌反应24 h,双蒸水半透膜透析72 h去除交联剂,获得共价交联SP/Col- Ⅰ溶液。
CPC粉与各种固化液混合调拌(粉/液质量体积比:3.0 g/ml)制成糊剂后,充填于直径8 mm、厚度2 mm不锈钢模具中,自行固化6 h后脱模,获得实验试件。对照组试件采用原配售固化液与CPC调拌制备,记为A组。实验组共5 组:采用共价交联SP/Col- Ⅰ溶液与CPC调拌制备试件记为B组;将SP多肽按照10-3mol/L浓度直接加入3%胶原溶液混合后再与CPC调拌制备试件记为C组;SP加入普通固化液与CPC调拌制备糊剂,再混合50%体积比的Col- Ⅰ海绵颗粒,固化制备试件记为D组;SP加入普通固化液与CPC调拌制备试件记为E组;3%胶原溶液与CPC调拌制备试件记为F组。
1.2 材料试件扫描电镜观察
各组试件取横断截面干燥喷金,扫描电镜(德国卡尔蔡司公司)1 000 倍观察试件的内部超微结构,D组试件内胶原海绵颗粒截面采用300 倍观察(图 1)。

图 1 扫描电镜下各组材料横断面形貌
1.3 兔颌骨缺损修复动物实验
将30 只成年新西兰兔(第四军医大学实验动物中心提供)随机分为6 组,每组5 只。术前给予头孢唑啉钠肌注,麻醉后取颌下切口显露一侧下颌骨体部,用环钻于第一至第三臼齿区制备8 mm直径圆形半层颌骨缺损,分别植入预制的各组材料试件,分层缝合伤口。术后进软食,抗生素注射3 d预防感染,7 d拆除缝线。8 周后4%戊巴比妥静脉注射处死动物,取下颌骨体,标本固定备用。
1.4 骨缺损影像学检查
使用Micro CT(德国西门子公司)对标本进行扫描重建,精度40 μm,观察骨缺损区材料降解与新骨再生情况。
1.5 骨缺损组织学检查
颌骨标本甲酸-甲酸钠混合溶液脱钙2 周,常规包埋切片,Masson三色法染色,光学显微镜观察缺损区组织学变化。
1.6 统计学处理
采用SPSS 17.0统计软件行ANOVA分析,P<0.05时认为差异有统计学意义。
2 结 果
2.1 复合材料内部结构
扫描电镜显示:A组材料微孔隙多为数微米直径,无超过50 μm孔隙;B、C、F组结构相似,空隙直径较大,多为50 μm左右;D组可见Col- Ⅰ海绵颗粒在CPC内形成300~1 000 μm大孔隙;E组与A组结构相似(图 1)。
2.2 影像学检查结果
Micro- CT显示植入体内8 周后,A组材料仅表面出现少量坑状吸收,新生骨骨量较少。B组材料形态较完整,新生骨量少。C组材料吸收较明显,新生骨骨量较多。D组材料吸收明显,原有形态丧失,吸收部分已被大量新生骨组织占据。E组材料表面吸收,被较多新生骨组织覆盖。F组材料不规则吸收,部分新骨长入。Micro- CT数据统计分析结果证实,D组新生骨量及材料降解率明显优于其余5 组,存在统计学差异(P<0.05)(图 2)。
2.3 组织学检查结果
Masson三色法染色显示,A组材料周边有引导骨爬行替代表现。B组材料周边仅有少量新骨再生。C组材料吸收较明显,有较多新骨长入。D组材料形态丧失,大量新骨组织包裹残余材料。E组有较多新骨与材料紧密结合。F组材料有不规则新骨长入(图 3)。
3 讨 论
理想的的骨替代材料应具备“4F”性能:Form即能够填充复杂三维骨缺损,Fixation即能够承载一定压力,Function即能够与周围骨组织功能性整合,Formation即能够诱导促进骨再生[8]。模块化设计构建骨替代材料是实现这些目标的有效途径,并有利于临床转化应用,其中的关键问题包括材料的骨引导能力、骨诱导能力、孔隙结构、生物相容性及安全性等。
CPC固化后形成磷灰石结晶,与天然骨组织的无机成分类似,具有良好的骨引导性及生物相容性,但单纯CPC缺乏诱导骨再生能力,且降解速率缓慢[11]。Ⅰ型胶原是天然骨中最主要的有机成分,常用作组织工程载体,利于成骨细胞粘附生长和增殖分化[12-13]。但单纯胶原材料无法获得足够的机械强度。本研究拟采用仿生模块化设计构建复合骨替代材料,提高材料综合性能,使其具备良好的成骨转化效率,其中,CPC作为无机成分,可塑形填充缺损、保障材料强度以及提供骨引导功能,Ⅰ型胶原作为有机成分,可调整材料内部结构并提供骨引导、骨诱导功能,P物质作为生物活性分子,可提供体内诱导骨再生和血管新生功能。
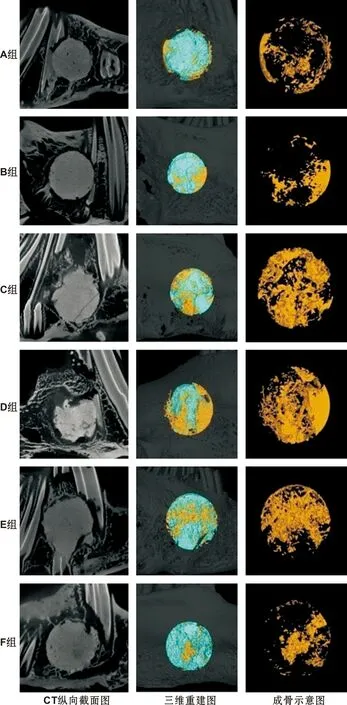
图 2 各组材料植入8 周后Micro- CT扫描三维重建对比(蓝绿色: 材料; 黄色: 新生骨组织)
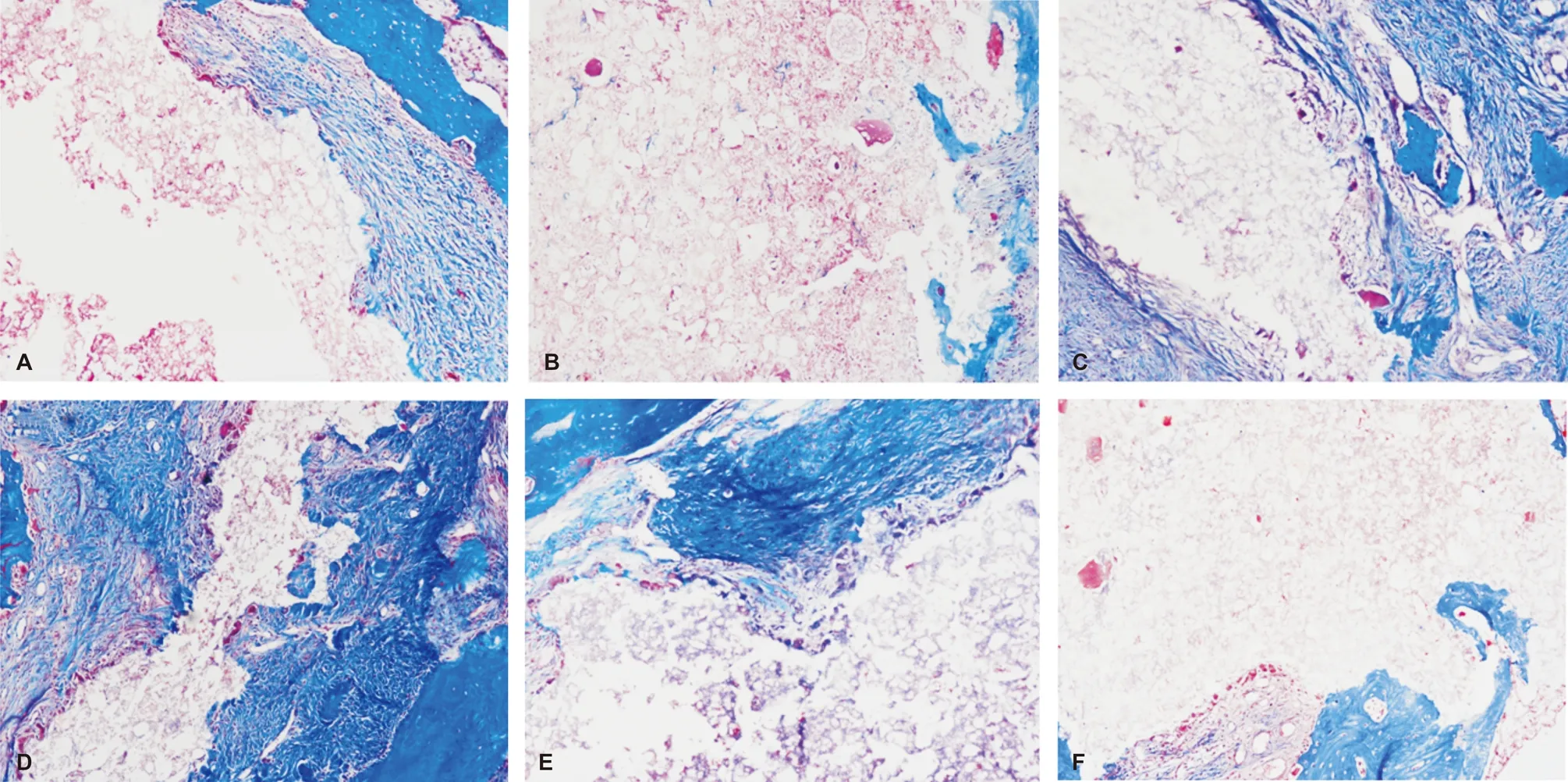
图 3 各组材料植入8 周后组织学表现对比
材料孔隙结构和孔隙率是影响骨替代材料成骨能力的重要因素。研究表明,使用胶原溶液调拌固化CPC可以优化材料内部微孔隙结构,增大孔隙直径至50 μm左右。理想的成骨材料孔隙直径应达到200~900 μm[14],为此,我们采用胶原海绵颗粒混入CPC糊剂,固化后电镜观察确定实现预期目的,动物实验也表明大孔隙结构显著增强材料降解和新骨再生。值得指出的是,材料强度和材料孔隙结构是相对的两面,胶原海绵颗粒混入CPC会降低材料的整体强度,但本研究前期相关生物力学测试表明,其强度与松质骨类似,因此适合于初期负载强度较低的牙槽骨缺损修复。
与BMP等常用骨诱导高分子蛋白相比,SP是一种小分子多肽,具有易于合成、保存等优点,使用成本较低。SP体内水解半衰期时间约为5 min[15-17],因此,SP需要合适的运载、定位、缓释系统以保持其稳定诱导成骨作用。本研究设计中,通过蛋白共价交联技术,将Ⅰ型胶原分子与SP互相连接形成大分子结构,意图避免SP过早水解[18-19]。但在动物实验中发现,与直接添加SP多肽至CPC复合材料内部的3 组相比(C组、D组、E组),Col- Ⅰ/SP共价交联组(B组)的成骨效果最差。分析其原因应为共价交联过度限制了SP的释放,导致其活性减弱甚至丧失。CPC本身即是一种良好的蛋白、药物运载缓释材料,其固化反应温和,不影响蛋白活性,固化后孔隙微小,可以阻挡蛋白水解酶等大分子通过,随CPC逐渐降解,其中活性分子即可缓释发挥作用[20]。
综上所述,模块化设计构建由CPC、SP和Col- Ⅰ组成的复合材料具有诱导骨再生活性,并促进材料体内降解;材料构建模式影响其内部结构和活性分子SP缓释,进而影响材料诱导成骨效率;CPC、SP及Ⅰ型胶原海绵构建的多孔材料可能在牙槽骨缺损修复方面具有良好应用潜力。
