肝细胞LO2中细胞因子诱导的含CISH基因的表达及其炎性因子调控的研究*
2017-03-17李腊梅杨雪梅伍洋平陈洁胡章勇
李腊梅,杨雪梅,伍洋平,陈洁,胡章勇△
1.成都医学院 基础医学院(成都 610083);2.成都医学院 第一附属医院(成都 610500);3.四川大学生物治疗国家重点实验室(成都 610411)
肝细胞LO2中细胞因子诱导的含CISH基因的表达及其炎性因子调控的研究*
李腊梅1,杨雪梅2,伍洋平3,陈洁2,胡章勇2△
1.成都医学院 基础医学院(成都 610083);2.成都医学院 第一附属医院(成都 610500);3.四川大学生物治疗国家重点实验室(成都 610411)
目的 建立SH2结构域蛋白(cytokine inducible SH2-containing protein,CISH)基因上、下调的肝细胞模型,探讨CISH基因在正常肝细胞中的表达及其对炎性因子的调控。方法 实验组分别为转染CISH siRNA组和CISH过表达质粒组,对照组分别为转染空质粒的阴性对照组和未转染任何物质的空白对照组;分别用CISH siRNA和CISH过表达质粒借助lipo 2000转染肝细胞LO2构建CISH基因表达的上、下调肝细胞模型;采用实时荧光定量PCR和蛋白质印迹法(Western Blot)分别检测肝细胞LO2中CISH基因在mRNA和蛋白水平的变化;利用ELISA法检测LO2肝细胞中CISH基因表达水平改变后对炎症因子TNF-α、IL-1β水平的影响。结果 实时荧光定量PCR和Western Blot法检测表明,与未转染的LO2肝细胞比较,被转染CISH过表达质粒的细胞能够上调目的基因CISH的表达,被转染CISH siRNA的细胞可下调目的基因CISH的表达;ELISA法检测表明,与未转染的LO2肝细胞比较,被转染CISH过表达质粒的细胞分泌的炎症因子TNF-α和IL-1β水平表现出降低趋势,而被转染CISH siRNA的细胞分泌的炎症因子TNF-α和IL-1β水平则表现出升高趋势。结论 成功构建了CISH高、低表达的LO2肝细胞系,CISH基因表达改变可影响LO2肝细胞系炎性因子的分泌。
慢性乙肝;肝细胞LO2;CISH基因;炎症因子
SH2结构域蛋白(cytokine inducible SH2-containing protein,CISH)是SOCS蛋白家族的一员,于1995年由Yoshimura等研究首次发现[1]。SOCS蛋白家族包含8个成员,各个成员之间结构相似,中间含有一个SH2结构域,能够结合磷酸化酪氨酸残基,其决定着SOCS蛋白家族的识别作用;C端有一段保守序列,称为“SOCS盒”[2-3]。既往研究[4-6]表明,CISH基因与过敏性哮喘、钩端螺旋体病、肺结核、菌血症及疟疾等多种感染性疾病相关。研究[7]报道,处于免疫清除期的e抗原阳性慢性乙型肝炎患者,若CISH基因rs414171位点为AA基因型,则有更高概率发生HBV自发清除。本课题组前期研究[8]显示,CISH基因rs414171和rs2239751位点单核苷酸的多态性与持续HBV感染相关。为验证正常肝细胞内是否存在CISH基因的表达及其对炎性因子的调控,本研究拟在LO2正常肝细胞中建立CISH基因表达上调、下调的细胞模型,并探讨CISH基因表达改变后对肝细胞分泌的炎性因子的影响。
1 材料与方法
1.1 主要仪器
荧光定量PCR仪(美国BioRad公司)、倒置荧光显微镜(日本Nikon公司)。
1.2 主要抗体
兔抗CISH单克隆抗体、辣根酶标记山羊抗兔IgG抗体购自美国CST公司,鼠抗β-actin抗体、辣根酶标记山羊抗鼠IgG抗体购自北京中杉金桥生物科技有限公司。
1.3 其他试剂
CISH siRNA购自广州市锐博生物科技有限公司,CISH过表达质粒、阴性空载质粒购自上海吉凯基因科技有限公司,ELISA试剂盒购自欣博盛生物科技有限公司,Lipofectamine 2000 Reagent购自美国Life Technologies公司。
1.4 实验方法
1.4.1 实验分组 实验组分为实验组1(转染CISH siRNA组)和实验组2(转染CISH过表达质粒组);对照组分为转染空质粒的阴性对照组和未转染任何物质的空白对照组。
1.4.2 细胞培养 LO2正常人肝细胞由“四川大学生物治疗国家重点实验室”惠赠。用含10%胎牛血清的RPIM 1640培养基培养,每隔2~3 d传代1次。
1.4.3 肝细胞模型构建 肝细胞LO2传代后用含10%胎牛血清的RPIM 1640培养基培养2 d,胰酶消化细胞,用不含血清的RPIM 1640培养基重悬细胞后,按1.0×105个细胞/孔铺入6孔板中,细胞融合度达50%~70%时,实验组按Lipofectamine 2000 Reagent操作说明书分别进行CISH siRNA和CISH 过表达质粒转染,空白对照组只替换为不含血清的RPIM 1640培养基,阴性对照组转染空载质粒,培养6 h后更换成新鲜含10%胎牛血清的1640培养基继续培养,从而构建肝细胞CISH基因上、下调表达模型。
1.4.4 RT-PCR测定 CISH siRNA和CISH 过表达质粒转染肝细胞LO2,24 h后使用美国Promega公司的Eastep Super总RNA提取试剂盒提取肝细胞LO2的总RNA,反转录合成cDNA。按YBR Slect Master Mix说明书进行RT-PCR反应,检测CISH基因在 mRNA水平的变化。
1.4.5 Western Blot法测定 CISH siRNA和CISH 过表达质粒转染肝细胞LO2,48 h后使用高效RIPA裂解细胞提取总蛋白,Western Blot法检测CISH基因在蛋白水平的变化。
1.4.6 ELISA法测定 CISH siRNA和CISH 过表达质粒转染肝细胞LO2,48 h后收集上清按ELISA试剂盒说明书检测炎症因子TNF-α和IL-1β的水平。
1.5 统计学方法
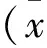
2 结果
2.1 正常肝细胞LO2中CISH基因的表达
将LO2细胞用含10%胎牛血清的RPIM 1640培养基培养,待细胞融合度达到90%时用高效RIPA裂解细胞提取总蛋白,BCA法测得蛋白浓度后做Western Blot检测。结果显示,正常肝细胞LO2中有CISH基因的表达(图1)。
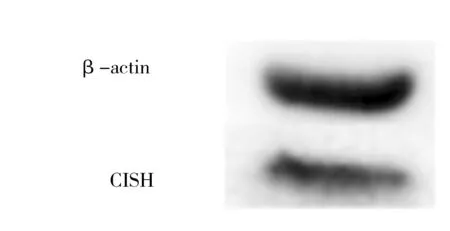
图1 正常肝细胞LO2中CISH基因的表达
2.2 CISH siRNA转染肝细胞LO2后CISH基因在mRNA水平的表达变化
用无血清培养液将CISH siRNA(#1)利用Lipofectamine 2000 Reagent转染进LO2细胞,6 h后更换成新鲜含10%胎牛血清的RPIM 1640培养基继续培养,24 h后提取总RNA,反转录成cDNA,进行荧光定量PCR分析,结果见图2A。结果显示,实验组1的CISH基因相对表达量低于空白对照组,差异具有统计学意义(t=2.851,P=0.046)(图2B)。
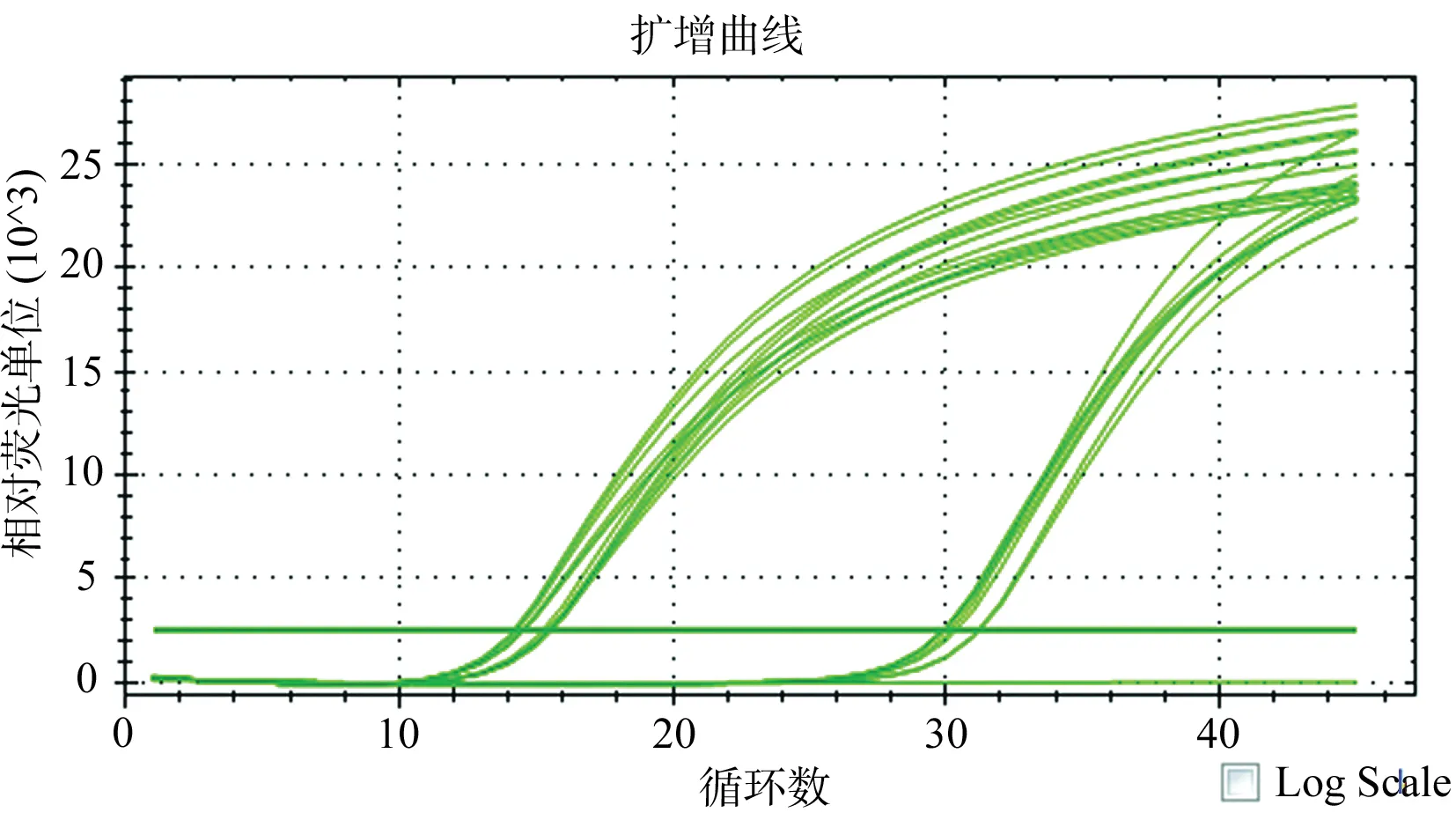

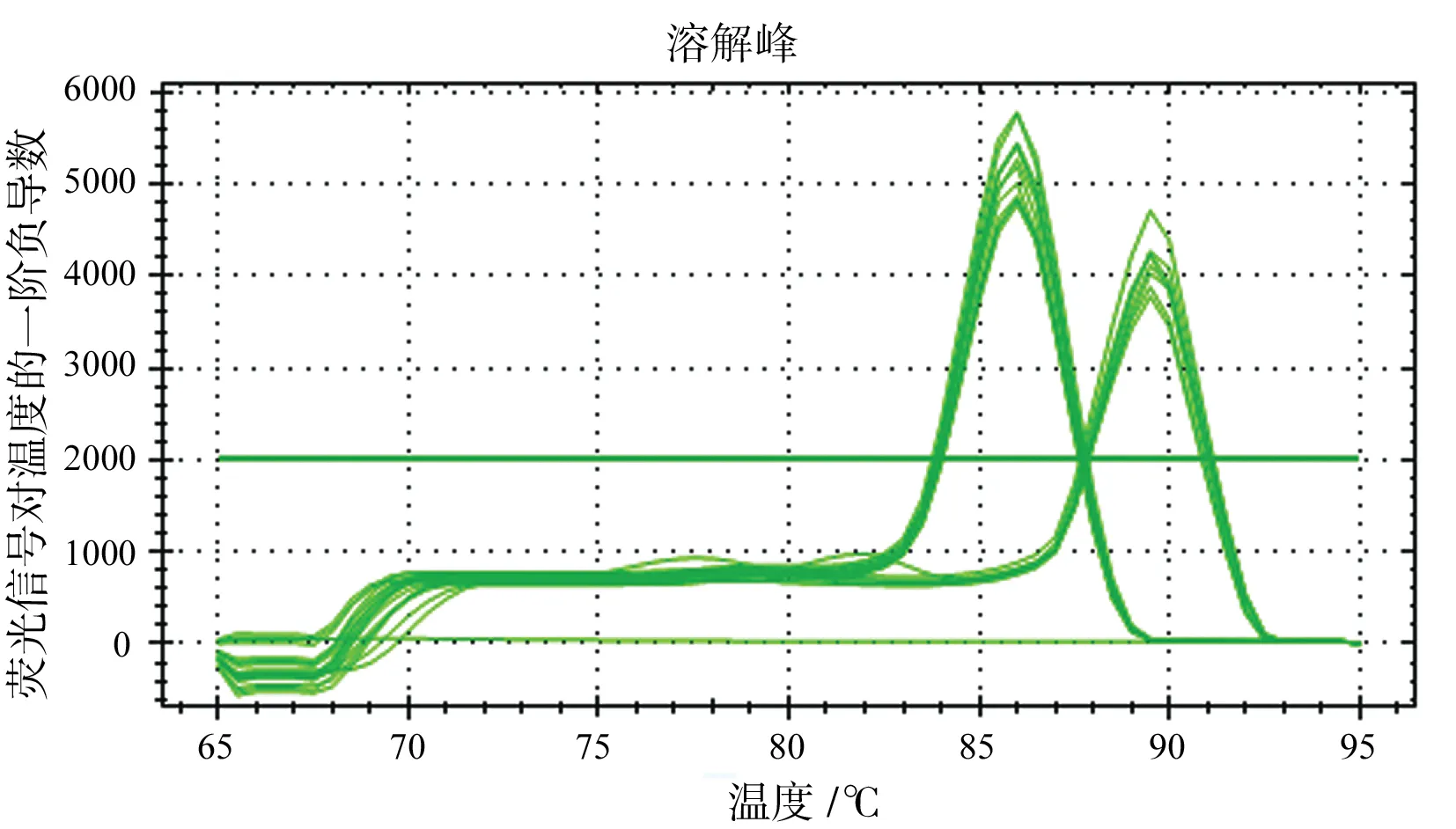

2.3 CISH siRNA转染肝细胞LO2后CISH基因在蛋白水平的表达变化
用无血清培养液将CISH siRNA(#1)利用Lipofectamine 2000 Reagent转染进LO2细胞,6 h后更换成新鲜含10%胎牛血清的RPIM 1640培养基继续培养,48 h后用高效RIPA裂解细胞提取总蛋白,BCA法测得蛋白浓度后做Western Blot检测。结果显示,实验组1的CISH蛋白表达量明显低于空白对照组(图3A),灰度值分析得到相同的结果(图3B)。
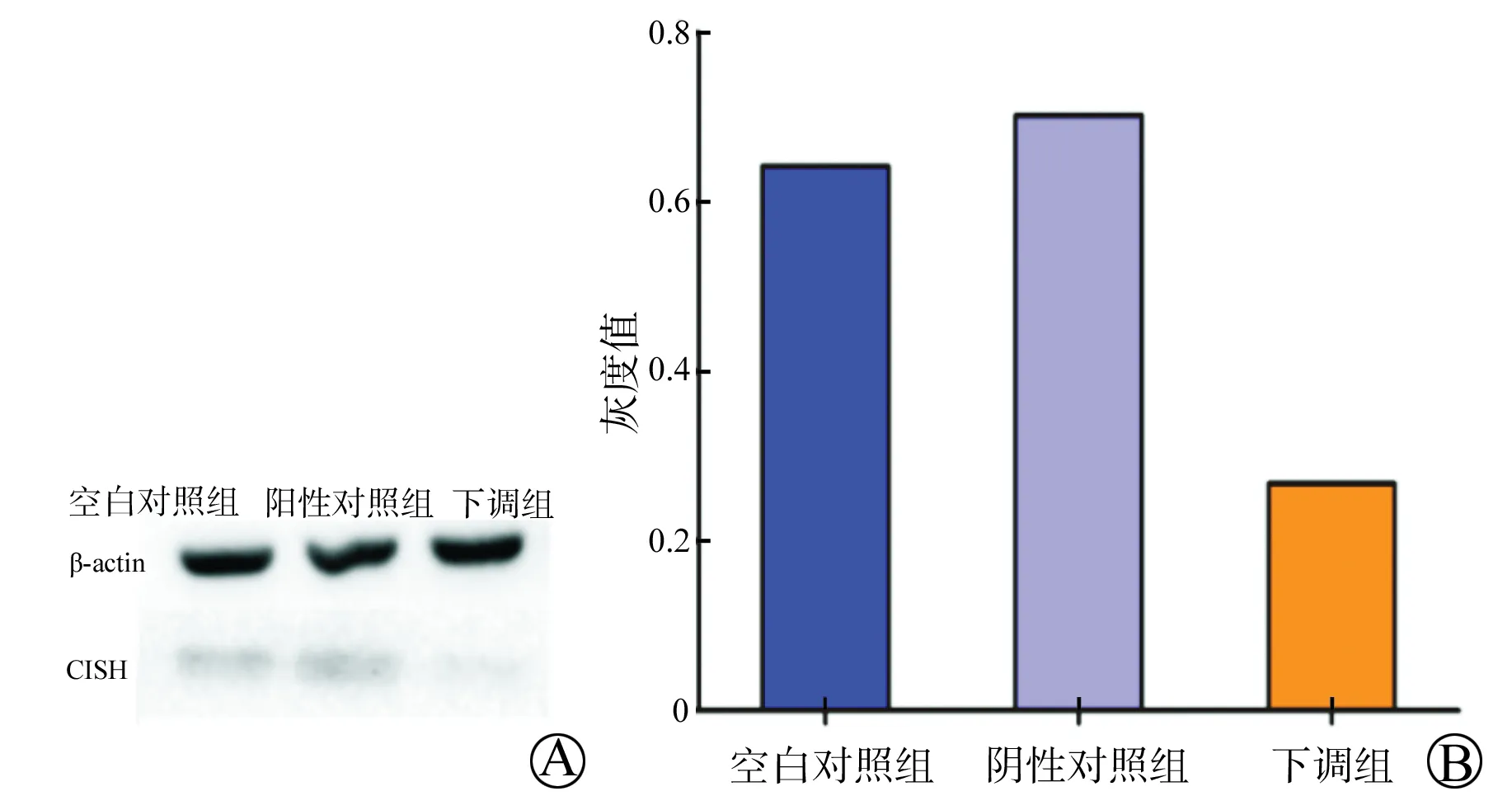
图3 Western Blot检测肝细胞LO2中CISH基因下调后蛋白水平的表达变化
2.4 CISH过表达质粒转染肝细胞LO2后CISH基因在mRNA水平的表达变化
用无血清培养液将CISH 过表达质粒和阴性空载质粒利用Lipofectamine 2000 Reagent转染进LO2细胞,6 h后更换成新鲜含10%胎牛血清的RPIM 1640培养基继续培养,12 h时转染效率达90%以上(图4A),24 h后提取总RNA,反转录成cDNA,进行荧光定量PCR分析。结果显示,实验组2的CISH相对表达量高于空白对照组和阴性对照组(F=8.175,P=0.009)(表1)。

表1 荧光定量PCR检测肝细胞LO2中CISH基因上调后CISH相对表达量的表达变化
2.5 CISH过表达质粒转染肝细胞LO2中CISH基因在蛋白水平的表达
用无血清培养液将CISH 过表达质粒和阴性空载质粒利用Lipofectamine 2000 Reagent转染进LO2细胞,6 h后更换成新鲜含10%胎牛血清的RPIM 1640培养基继续培养,12 h转染效率达90%以上(图4A),48 h后用高效RIPA裂解细胞提取总蛋白,BCA法测得蛋白浓度后做Western Blot检测。结果显示,实验组2的CISH表达量明显高于空白对照组和阴性对照组(图4B),灰度值分析得到相同的结果(图4C)。
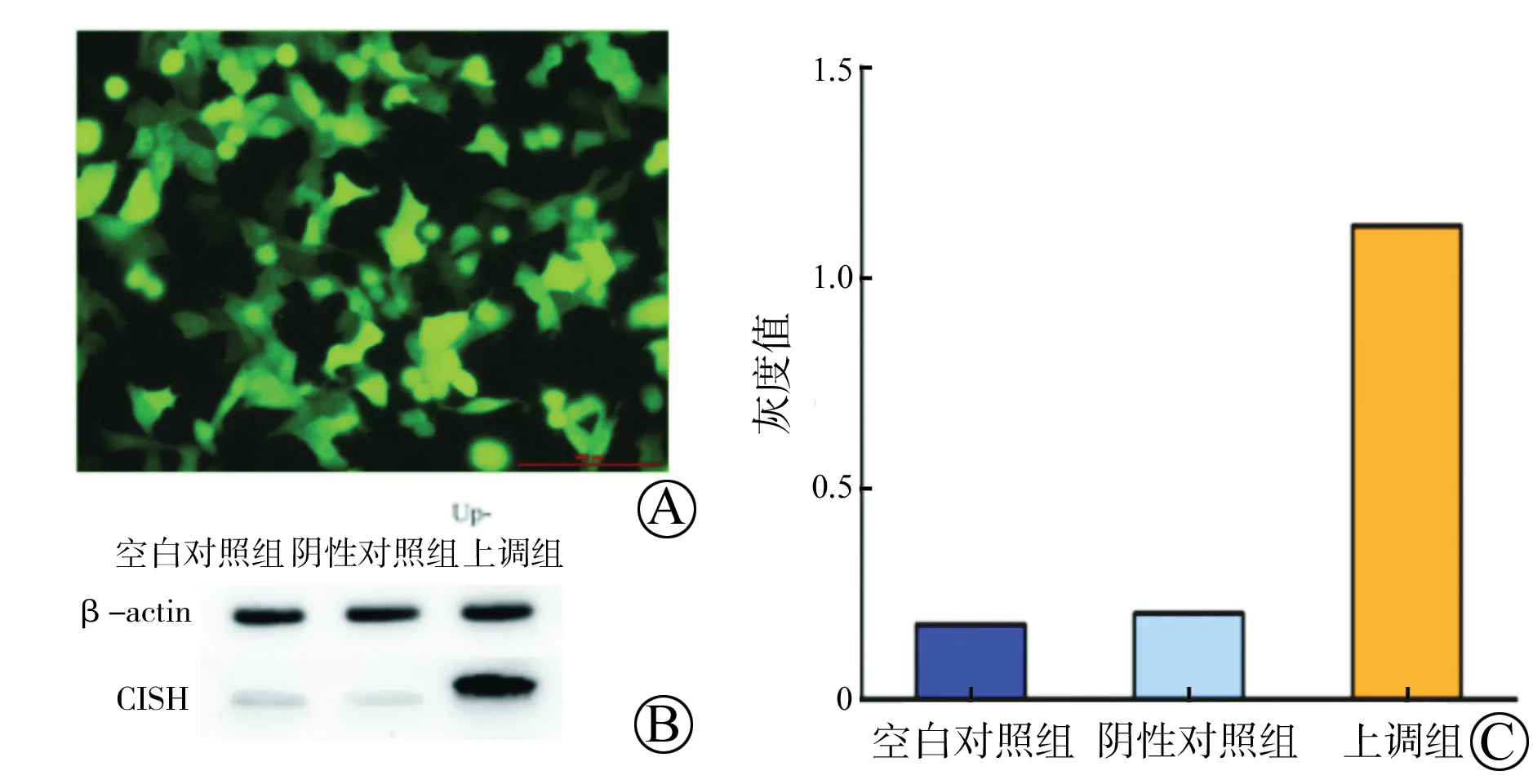
图4 Western Blot检测肝细胞LO2中CISH基因上调后蛋白水平的表达变化
2.6 ELISA检测肝细胞LO2中CISH基因上、下调后肝细胞分泌的炎性因子的改变
用无血清培养液将CISH 过表达质粒和CISH siRNA(#1)利用Lipofectamine 2000 Reagent转染进LO2细胞,6 h后更换成新鲜含10%胎牛血清的RPIM 1640培养基继续培养,48 h后ELISA检测上清中TNF-α和IL-1β水平,结果如下:实验组1、2和空白对照组的上清中TNF-α水平差异具有统计学意义(F=88.70,P<0.000)(图5A),其中,实验组1与空白对照组(t=6.667,P=0.003)、实验组2与空白对照组(t=4.819,P=0.008)及实验组1与实验组2(t=22.980,P<0.000)的上清中TNF-α水平差异也具有统计学意义。实验组1、2和空白对照组的上清中IL-1β水平差异同样具有统计学意义(F=10.88,P=0.010),其中,实验组1与对照组(t=3.454,P=0.026)、实验组2与空白对照组(t=7.490,P=0.002)及实验组1与实验组2(t=5.47,P=0.0054)的上清中IL-1β水平差异也具有统计学意义(图5B)。

图5 ELISA检测肝细胞LO2中CISH基因上、下调后其上清中炎症因子的变化
3 讨论
CISH基因作为SOCS蛋白家族中最早发现的成员,主要调控细胞因子信号,尤其是IL-2介导的信号通路。与SOCS蛋白家族其他成员不同,CISH可以通过结合细胞因子受体的酪氨酸残基,从而占据STAT5的结合位点。因此,CISH可以抑制STAT5的激活,进而抑制其下游的信号分子[8]。有研究[5,9]表明,过敏性哮喘及小儿肺结核患者中,CISH能负性调控STAT5信号从而影响疾病的进展。
本研究中,WB和RT -PCR的实验结果都证实人类LO2肝细胞中有CISH基因的表达。细胞实验中,将CISH 过表达质粒和CISH siRNA转染进肝细胞LO2中构建CISH基因上、下调肝细胞模型,在mRNA和蛋白水平都证实实验组1的CISH表达明显低于空白对照组;相反,实验组2的CISH表达却明显高于空白对照组及阴性对照组,差异具有统计学意义。研究结果表明,笔者成功构建了CISH基因上、下调的肝细胞模型。
本研究使用CISH 过表达质粒和CISH siRNA重新转染肝细胞LO2,48 h后收取细胞上清做ELISA实验,观察肝细胞中CISH基因表达水平发生变化后,对肝细胞分泌的炎性因子的影响。结果表明,实验组1中的肝细胞分泌的促炎因子TNF-α和IL-1β的水平明显高于空白对照组;相反,实验组2中的肝细胞分泌的促炎因子TNF-α和IL-1β的水平却明显低于空白对照组。Lewis等[10]研究表明,在造血系统中,CISH可以调节JAK2/STAT5信号通路的活性,在过敏性气道感染疾病中,CISH也可以调节STAT3/STAT5/STAT6的活性[11]。Palmer等[12]研究表明,CISH/STAT5还与肿瘤耐受相关。据此推测,在肝细胞中,CISH基因也可能通过JAK2/STAT5信号通路调控炎性因子的分泌进而调节肝细胞功能表型,本课题组下一步将以此作为研究重点。
综上所述,本研究结果表明,肝细胞中有CISH基因的表达且CISH基因能负性调节肝细胞促炎因子TNF-α、IL-1β的分泌。
[1]Tefferi A. Essential thrombocythemia, polycythemia vera, and myelofibrosis: current management and the prospect of targeted therapy[J]. Am J Hematol, 2008, 83(6): 491-497.
[2]O'Shea J J, Gadina M, Schreiber R D. Cytokine signaling in 2002: new surprises in the Jak/Stat pathway[J]. Cell, 2002, 109(Suppl): S121-S131.
[3]Alexander W S. Suppressors of cytokine signalling (SOCS) in the immune system[J]. Nat Rev Immunol, 2002, 2(6): 410-416.
[4]Yang X O, Zhang H, Kim B S,etal. The signaling suppressor CIS controls proallergic T cell development and allergic airway inflammation[J]. Nat Immunol, 2013, 14(7): 732-740.
[6]Khor C C, Vannberg F O, Chapman S J,etal. CISH and susceptibility to infectious diseases[J]. N Engl J Med, 2010, 362(22): 2092-2101.
[7]Song G, Rao H, Feng B,etal. Association between CISH polymorphisms and spontaneous clearance of hepatitis B virus in hepatitis B extracellular antigen-positive patients during immune active phase[J]. Chin Med J, 2014, 127(9): 1691-1695.
[8]Hu Z, Yang J, Wu Y,etal. Polymorphisms in CISH gene are associated with persistent hepatitis B virus infection in Han Chinese population[J]. PLoS One, 2014, 9(6): e100826.
[9]Sun L, Jin Y Q, Shen C,etal. Genetic contribution of CISH promoter polymorphisms to susceptibility to tuberculosis in Chinese children[J]. PLoS One, 2014, 9(3): e92020.
[10] Lewis R S, Noor S M, Fraser F W,etal. Regulation of embryonic hematopoiesis by a cytokine-inducible SH2 domain homolog in zebrafish[J]. J Immunol, 2014, 192(12): 5739-5748.
[11] Yang X O, Zhang H, Kim B S,etal. The signaling suppressor CIS controls proallergic T cell development and allergic airway inflammation[J]. Nat Immunol, 2013, 14(7): 732-740.
[12] Palmer D C, Guittard G C, Franco Z,etal.Cish actively silences TCR signaling in CD8+ T cells to maintain tumor tolerance[J]. J Exp Med, 2015, 212(12): 2095-2113.
A Study on the Gene Expression of Cytokine-inducible SH2-containing Protein (CISH) in Hepatocyte LO2 and the Regulation of Its Inflammatory Factors
LiLamei1,YangXuemei2,WuYangping3,ChenJie2,HuZhangyong2△.
1.SchoolofBasicMedicalSciences,ChengduMedicalCollege,Chengdu610083,China; 2.TheFirstAffiliatedHospital,ChengduMedicalCollege,Chengdu610500,China; 3.StateKeyLaboratoryofBiotherapy,SichuanUniversity,Chengdu610041,China
Objective To establish the hepatocyte models up-regulated and down-regulated by cytokine-inducible SH2-containing protein (CISH) gene and investigate the expression of CISH gene in the normal hepatocyte and the regulation of its inflammatory factors. Methods The experiment groups consisted of the groupinfected by CISH siRNA and that infected by CISH over-expression plasmid; while the control groups involved the negative group infected by empty plasmid and the uninfected blank group. The hepatocyte LO2 was transfected with CISH over-expression plasmid and CISH siRNA by Lipo 2000to establish the hepatocyte models up-regulated and down-regulated by CISH gene. Real-time Fluorescence Quantitative PCR and Western Blotting were used to detect the level changes of CISH mRNA and protein and Enzyme-linked immunosorbent assay (ELISA) was adopted to detect the effect of the CISH gene expression change on the levels of the inflammatory factors TNF-α and IL-1β in hepatocyte LO2.Results According to the results of Real-time Fluorescence Quantitative PCR and Western Blotting, the cells infected by CISH over-expression plasmid up-regulated the expression of CISH gene and those infected by CISH siRNA down-regulated the expression of CISH gene when compared with the uninfected hepatocyte LO2.The results of ELISA indicated that the levels of the inflammatory factors TNF-α and IL-1β secreted by the cells infected by CISH over-expression plasmid decreased and those secreted by the cells infected by CISH siRNA increased when compared with the uninfected hepatocyte LO2.Conclusion Thehepatocyte LO2 cell lines up-regulated and down-regulated by CISH gene are established successfully, and the changes of the CISH gene expression can affect the secretion of inflammatory factors in hepatocyte LO2 cell lines.
Chronic hepatitis B; Hepatocyte LO2; CISH gene; Inflammatory factor
http://www.cnki.net/kcms/detail/51.1705.R.20170221.2247.004.html
10.3969/j.issn.1674-2257.2017.01.011
四川省科技厅资助项目(No:2016JY0207)
R363.1
A
△通信作者:胡章勇,E-mail:chendu47@163.com
