锁阳对肝纤维化模型大鼠血细胞分型的影响
2017-03-17李卉园黄小梅郭莉娜李荣华陈建文迪林友胜王航宇刘漪沦邓峰美
李卉园,黄小梅,郭莉娜,李荣华,李 灿,陈建文,黄 迪林友胜,王航宇,刘漪沦,邓峰美△
1.成都医学院 基础医学院 (成都 610500); 2.石河子大学药学院(石河子 832000);3.成都医学院第一附属医院(成都 610500)
锁阳对肝纤维化模型大鼠血细胞分型的影响
*李卉园1,黄小梅1,郭莉娜1,李荣华1,李 灿1,陈建文1,黄 迪1林友胜1,王航宇2,刘漪沦3,邓峰美1△
1.成都医学院 基础医学院 (成都 610500); 2.石河子大学药学院(石河子 832000);3.成都医学院第一附属医院(成都 610500)
目的 探讨锁阳对四氯化碳( CCl4) 诱导的大鼠肝纤维化血细胞分型影响。方法 将60只SD大鼠随机分为正常对照组、模型组、秋水仙碱组(0.2 mg/kg)和锁阳组(200 mg/kg),每组各15只。前6周,正常对照组大鼠用花生油,其余组大鼠2次/周,以3 mL/kg的剂量,用 CCl4与花生油(4∶6)混合液,皮下注射复制肝纤维化模型。6周后,秋水仙碱组与锁阳组大鼠分别以相应剂量,1次/d,灌胃,正常对照组和模型组大鼠给予等容生理盐水,持续 6 周。12周末,大鼠麻醉后处死,取血清,采用血细胞分析仪进行外周血常规分析。结果 与模型组相比,锁阳组大鼠白细胞数目(WBC)、中性粒细胞比值(NEUT%)、嗜酸性粒细胞百分比(EOS%)、血小板分布宽度(PDW%)和红细胞分布宽度(RDW%)较模型组明显降低,淋巴细胞百分比(LYM%)、红细胞数目(RBC)、红细胞压积(HCT%)、血红蛋白含量(MCH)和平均红细胞体积(MCV)较模型组明显升高,差异有统计学意义(P<0.05)。结论 锁阳对肝纤维化大鼠的血细胞分型产生了影响。
肝纤维化; 锁阳; 血细胞分型
肝纤维化是肝脏组织受到急、慢性损伤刺激后,进行持续自我修复所致的病理改变,其病理特征是肝内纤维结缔组织异常增生,是肝内细胞之间及其与细胞外基质(extracellular matrixc, ECM)相互作用的结果[1]。锁阳是锁阳属锁阳科一种多年生、全寄生肉质草本植物。文献[2-3]表明,锁阳具有调节免疫、抗氧化作用,而炎症与自由基损伤是肝纤维化的重要致病因素。因此,课题组前期与教育部新疆特种植物药资源重点实验室合作,开展了锁阳进行肝纤维化的初步干预研究[4-6],结果发现,锁阳对四氯化碳( CCl4) 所致的肝损伤动物模型具有保护作用,与模型组相比,锁阳组大鼠血清中谷丙转氨酶(ALT)和谷草转氨酶(AST)均有明显降低[7]。但是,锁阳对外周血细胞分型变化的影响却未见报道。
1 材料与方法
1.1 动物
雄性SD大鼠,SPF级别,体质量140~160 g,60只,购买于成都达硕公司,实验动物生产许可证SCXK(川)2013-024。
1.2 试剂与仪器
锁阳由新疆石河子大学药学院提供;秋水仙碱,云南玉药生物制药有限公司,批号H53021904; CCl4分析纯 AR( 500 mL /瓶), 购于成都科龙化工试剂厂,批号20120220;SF-3000型血细胞分析仪,日本SYSMEX株式会社产品。
1.3 动物分组与给药方法
将60只SD大鼠随机分为正常对照组、模型组、秋水仙碱组和锁阳组,每组各15只。前6周,正常对照组大鼠用花生油,其余组大鼠2次/周,以3 mL/kg的剂量,用 CCl4与花生油(4∶6)混合液,皮下注射,复制肝纤维化模型。6周后,秋水仙碱组与锁阳组大鼠分别以0.2 mg/kg、200 mg/kg的剂量,1次/d,灌胃,正常对照组和模型组大鼠给予等容生理盐水,持续 6周。
1.4 取材
将大鼠固定,麻醉,于锁骨中点以上0.5 cm 处切开皮肤,离出颈总静脉,结扎远心端,将静脉留置管向近心端插入,取颈静脉血。
1.5 指标检测
取血后,在2 h内用血细胞分析仪,检测大鼠血中白细胞数目(WBC),中性粒细胞比值(NEUT%)、单核细胞百分比(MONO%)、淋巴细胞百分比(LYM%)、嗜酸性粒细胞百分比(EOS%)、红细胞数目(RBC)、血小板分布宽度(PDW%)、红细胞压积(HCT%)、血红蛋白含量(MCH)、平均红细胞体积(MCV)和红细胞分布宽度(RDW%)各项指标的变化。
1.6 统计学方法
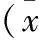
2 结果
2.1 各组大鼠WBC、NEUT%测定结果
与正常对照组相比,模型组大鼠血细胞WBC、NEUT%较正常组明显升高,差异有统计学意义(P<0.05);与模型组相比,秋水仙碱组和锁阳组大鼠WBC、NEUT%较模型组明显降低,差异有统计学意义(P<0.05)(表1)。
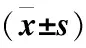
表1 各组大鼠WBC,NEUT%测定结果
注:与正常对照组比较,△P<0.05;与模型组比较,▲P<0.05
2.2 各组大鼠MONO%、LYM%、EOS%比较
与正常对照组相比,模型组大鼠MONO%、EOS%明显升高,LYM%明显降低,差异有统计学意义(P<0.05);与模型组相比,秋水仙碱组和锁阳组EOS%明显降低,差异有统计学意义(P<0.05);与模型组相比,锁阳组LYM%明显升高,秋水仙碱组MONO%明显降低,差异有统计学意义(P<0.05)(表2)。

表2 各组大鼠MONO%、LYM%、EOS%测定结果
注:与正常对照组比较,△P<0.05;与模型组比较,▲P<0.05
2.3 各组大鼠RBC、PDW%、HCT%比较
与正常对照组相比,模型组大鼠的RBC、HCT%明显降低,PDW%升高,差异有统计学意义(P<0.05);与模型组相比,秋水仙碱组和锁阳组的RBC、HCT%明显升高,PDW/%降低,差异有统计学意义(P<0.05)(表3)。
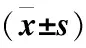
表3 各组大鼠RBC、PDW%、HCT%测定结果
注:与正常对照组比较,△P<0.05;与模型组比较,▲P<0.05
2.4 各组大鼠MCH、MCV、RDW%比较
与正常对照组相比,模型组大鼠的MCH、MCV明显降低,RDW%升高,差异有统计学意义(P<0.05);与模型组相比,秋水仙碱组和锁阳组MCH明显升高,差异有统计学意义(P<0.05);与模型组相比,锁阳组MCV升高,RDW%降低,差异有统计学意义(P<0.05)(表4)。
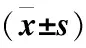
表4 各组大鼠MCH,MCV、RDW%测定结果
注:与正常对照组比较,△P<0.05;与模型组比较,▲P<0.05
3 讨论
肝纤维化的产生,实质上是细胞外基质的合成与降解的平衡被打破,从而导致肝内纤维结缔组织异常沉积。在此病理过程中,ECM主要来源为肝星状细胞(HSC)的激活。正常情况下,HSC处于静息状态,一旦发生肝细胞损伤,HSC就会被激活。目前,有文献[8]报道,肝细胞被损伤后,参与HSC激活的细胞因子除了TGF-β1之外,血小板等也参与到了激活HSC的病理过程中。此外,另有文献[9]证实,慢性肝病患者外周WBC、RBC、PDW%与肝脏病理分期有明显相关性,随病理分期的增加而逐步减少,大部分病人外周血表现为WBC、RBC、HCT%也明显低于正常。或许可以利用外周血细胞的分型变化以及数量的改变作为判断肝纤维化进程的理论依据,这也能为临床诊断肝纤维化提供有利指标,从而减少肝脏活检。
本研究数据显示,WBC、NEUT%和EOS%明显升高,LYM%明显降低,表明细胞内炎症增多。而炎症反应和炎症因子在HSC的活化、凋亡中起重要作用,可以促进肝纤维化的形成[10-12]。同时,肝纤维化发生后,脾功能亢进,会加速血细胞在脾脏中的破坏[13]。本实验结果显示,RBC,HCT%,MCH,MCV明显降低,符合大鼠肝纤维化的病理特点,证明实验造模成功。在用锁阳干预后,与模型组相比,WBC、HCT%、RBC、MCV、RDW%等指标有一定程度回升,表明锁阳能够在一定程度上改变肝纤维化大鼠静脉血中的细胞分型,缓解肝纤维化症状。以上实验结果提示,锁阳对肝纤维化大鼠的血细胞分型产生了一定影响,同时,能够减轻肝纤维化症状。至于血细胞分型的变化和肝纤维化症状减轻之间是否具有直接的因果关系,仍需进一步证实,这将作为本实验室研究的新方向。总之,本实验结果能够为锁阳的临床使用提供一定的理论支持。
[1]Saxena N K, Anania F A. Adipocytokines and hepatic fibrosis[J]. Trends Endocrinol Metab, 2015, 26(3): 153-161.
[2]李振华, 郭静霞, 崔占虎, 等. 锁阳的研究进展与资源保护[J]. 中国现代中药, 2014, 16(10): 861-869.
[3]Marra F, Tacke F. Roles for chemokines in liver disease[J]. Gastroenterology, 2014, 147(3): 577-594.e1.
[4]苏韫, 刘永琦, 吴建军, 等. 锁阳对衰老模型大鼠脾淋巴细胞转化能力、脾病理学变化及血清SOD、MDA、NO水平的影响[J]. 中国老年学杂志, 2009, 29(8): 927-929.
[5]谢石安, 李国玉, 王航宇, 等. 锁阳化学成分的研究[J]. 中国药师, 2012, 15(7): 911-914.
[6]谢石安, 李国玉, 张珂, 等. 锁阳化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2012, 29(7): 525-528.
[7]李荣华, 林友胜, 王航宇, 等. 锁阳对大鼠肝纤维化干预作用的实验研究[J]. 成都医学院学报, 2016, 11(3): 286-291.
[8]石之驎, 戴炜, 曾辉, 等. 血常规、Child-Pugh分级、肝功能、HBV-DNA在HBeAg阴性及阳性乙肝肝硬化患者中的对比分析[J]. 临床和实验医学杂志, 2016, 15(10): 984-986.
[9]李静, 周利霞, 王俊明, 等. 非酒精性脂肪性肝病胰岛素抵抗程度与全血细胞计数的相关性[J]. 中国老年学杂志, 2012, 32(16): 3371-3373.
[10] Tahtaci M, Yurekli O T, Bolat A D,etal. Increased mean platelet volume is related to histologic severity of primary biliary cirrhosis[J]. Eur J Gastroenterol Hepatol, 2015, 27(12): 1382-1385.
[11] Abbas A S, Sheikh N. Counter effects of N. Sativa L. and P. ovate L. on indicative markers of non alcoholic fatty liver disease [J]. Pak J Pharm Sci, 2016, 29(1): 185-191.
[12] Xu W S, Qiu X M, Ou Q S,etal. Red blood cell distribution width levels correlate with liver fibrosis and inflammation: a noninvasive serum marker panel to predict the severity of fibrosis and inflammation in patients with hepatitis B[J]. Medicine (Baltimore), 2015, 94(10): e612.
[13] 吴小梅. 血小板计数与慢性肝炎纤维化程度和合并脾亢的关系[J]. 检验医学与临床, 2010, 7(24): 2719-2720.
Effect of Cynomorium on the Blood Cell Type of Rats with Hepatic Fibrosis
LiHuiyuan1,HuangXiaomei1,GuoLina1,LiRonghua1,LiCan1,ChenJianwen1,HuangDi1,LinYousheng1,WangHangyu2,LiuYilun3,DengFengmei1△.
1.SchoolofBasicMedicalSciences,ChengduMedicalCollege,Chengdu610500,China; 2.SchoolofPharmacy,ShiheziUniversity,Shihezi832000,China;3.TheFirstAffiliatedHospitalofChengduMedicalCollege,Chengdu610500,China
Objective To explore the effect of cynomorium on CCl4induced fibrosis in rats and analyze the blood cell type. Methods Sixty Sprague Dawley (SD) rats were divided randomly into 4 groups including the control group, model group, colchicine group (0.2 mg/kg), and cynomorium group (200 mg/kg), and each group consisted of fifteen rats. In the first six weeks, the rats in control group were injected with peanut oil twice a week. In order to make the fibrosis models, the rats in the other groups were injected with the mixure of CCl4and peanut oil in the ratio of 4∶6. After six weeks, the rats in the colchicine group and cynomorium group were given the intragastric administration with the corresponding dose once a day for 6 weeks. The rats in the control and model group were injected with the equal volume of saline. The rats were sacrificed after anesthesia by the end of the 12th week. The serum was collected and analyzed by the blood cell analyzer. Results In comparison with the model group, there were significant decreases in the number of white blood cell (WBC), percentage of neutrophil and eosinophil, platelet distribution width (PDW) and the red blood cell distribution width (RDW) (P<0.05), and significant increases in the lymphocyte percentage, number of red blood cells, hematocrit, hemoglobin content, and the mean corpuscular volume (MCV) (P<0.05) in the cynomorium group. Conclusion Cynomorium has a certain effect on the blood cell type in rats with hepatic fibrosis.
Liver fibrosis; Cynomorium; Blood cell type
http://www.cnki.net/kcms/detail/51.1705.R.20170116.1700.002.html
10.3969/j.issn.1674-2257.2017.01.005
国家自然科学基金资助项目(No:81560566,81570558);四川省教育厅重点项目(No:2017JY0151、No:17ZA0113、No:15ZA0266);发育与再生四川省重点实验室基金重点项目(No:SYS15-004);四川省大学生创新实验计划训练项目(No:CXXS201303);成都医学院科研创新团队项目(No:CYTD15-04);成都医学院大学生创新实验计划训练项目(No:2013705011)。
R31
A
△通信作者:邓峰美,E-mail:dengfm2004@163.com
