CJ016对人肺癌裸鼠移植瘤的抑制活性研究
2017-03-17谭永红金伟华王玲洁于波涛
甘 萍,谭永红,金伟华,王玲洁,于波涛
(成都军区总医院药剂科,四川 成都 610083)
CJ016对人肺癌裸鼠移植瘤的抑制活性研究
甘 萍,谭永红,金伟华,王玲洁,于波涛
(成都军区总医院药剂科,四川 成都 610083)
目的 研究CJ016对人肺癌模型的治疗效果及其作用机制。方法 建立人肺腺癌细胞A549裸鼠移植瘤模型,考察CJ016体内抑制肿瘤生长效果;同时将肿瘤进行免疫组化检测,考察其对肿瘤内CD31和细胞凋亡的影响。结果 CJ016对A549细胞增殖有明显抑制作用,其IC50值为34.22 nmol·L-1;动物实验表明其具有较好的肿瘤抑制效果,抑瘤率、T/C%值分别为70.08%和27.75%(20 mg·kg-1);同时,CJ016能降低肿瘤细胞内CD31的表达,促进肿瘤细胞凋亡。结论 CJ016能明显抑制A549细胞荷瘤小鼠肿瘤生长,其可能的作用机制是减少血管生成和诱导肿瘤细胞凋亡。
肺癌;作用机制;CJ016;A549;IC50;CD31;细胞凋亡
癌症,即恶性肿瘤,是目前严重威胁人类健康的疾病之一。长期以来,体内基因的表达异常如基因突变、缺失、重组以及扩增被认为是肿瘤发生发展的起因。与此同时,越来越多的证据表明,除了基因序列的改变外,表观遗传的改变也会致使肿瘤的发生和发展。其中值得注意的是,与基因突变相比,表观遗传的变化过程是可逆的。因此,调节或干预表观遗传渐渐成为治疗肿瘤的一个很有吸引力的靶点[2-3]。近年来,研究发现组蛋白的乙酰化和去乙酰化作用是调节染色质结构和基因表达的重要的表观遗传现象,这与肿瘤的发生发展有着密切的联系。组蛋白的乙酰化和去乙酰化作用分别受到组蛋白乙酰转移酶(HATs)和组蛋白去乙酰化酶(HDACs)的调节。其中,组蛋白去乙酰化酶(HDAC)是一类能调节染色质结构和基因表达的蛋白酶。HDACs的主要作用是催化组蛋白氨基酸末端赖氨酸残基的去乙酰化,导致染色质凝结和转录抑制。此外,HDACs还能通过调节蛋白的乙酰化状态,影响蛋白转录后修饰。肿瘤细胞中常见HDACs的表达异常,抑制肿瘤细胞中HDACs的活性,可诱导肿瘤细胞生长阻滞、分化或者凋亡,能够从多通路、多靶点共同作用来阻止肿瘤的发生发展,因而HDAC抑制剂已渐渐成为抗肿瘤药物研发中炙手可热的靶点[6-8]。通过前期筛选工作,编号为CJ016的化合物被筛选出为最优化合物,本文初步探索了化合物CJ016的体内外抗肿瘤活性、作用靶点及抗肿瘤分子机制。
1 材料与方法
1.1 材料
1.1.1 药物与试剂 CJ016来自本课题组;DMEM培养基、RPMI 1640培养基、胰蛋白酶、100×青霉素-链霉素混合液购自美国HyClone公司;胎牛血清购自内蒙古呼和浩特市草原绿野生物工程材料有限公司;紫杉醇注射液购自太极集团四川太极制药有限公司;CD31抗体购自Santa Cruz公司;凋亡检测试剂盒购自北京中杉金桥公司。
1.1.2 主要仪器 CO2恒温培养箱、超净工作台、数码倒置显微镜、常温离心机、全波长酶标仪、石蜡切片机。
1.1.3 实验动物和细胞株 BALB/c裸鼠,SPF级,♀,购自北京华阜康生物科技股份有限公司,实验动物生产许可证号编号:SCXK(京)2014-0004;所用细胞来源于美国典型培养物保藏中心(American Type Culture Collection,ATCC),由本实验室培养并保种。
1.2 方法
1.2.1 MTT法测定CJ016对细胞生长的抑制作用 取对数生长期细胞,用0.25%胰酶消化细胞并制成细胞悬液,以3×107·L-1的细胞浓度接种于96孔板中,每孔100 μL,在5% CO2饱和湿度的37℃培养箱中培养[1,4]。24 h后,加入不同浓度的CJ016处理,继续培养72 h。按每孔10%加入MTT(以PBS配成5 g·L-1),继续孵育4 h,弃上清,每孔加入150 μL DMSO,酶标仪上震荡10 min,检测490 nm处吸光度(A)值,计算细胞存活率:细胞存活率/%=(实验组A值-阴性对照组A值)/(空白对照组A值-阴性对照组A值)×100%,并统计出IC50值,以上实验重复3次(n=6)。
1.2.2 A549细胞裸鼠移植瘤模型建立 将A549细胞进行传代扩大培养,收集细胞并用生理盐水调节细胞浓度为每毫升2×107个细胞。于超净工作台内,按0.1 mL每鼠接种于裸鼠右侧腋下,待肿瘤体积超过100 mm3时开始进行分组、给药[5,12]。实验分为5组:空白对照组,生理盐水,尾静脉注射,0.2 mL每鼠,2 d一次;阳性对照紫杉醇组,紫杉醇(paclitaxel,PTX)20 mg·kg-1,腹腔注射,7 d一次;CJ016给药组(5、10、20 mg·kg-1),尾静脉注射,0.2 mL每鼠,2 d一次。给药期间观察并记录裸鼠状态,每2天测量肿瘤体积和裸鼠体重,给药d 20时处死裸鼠,剖离肿瘤,称重并计算抑瘤率(n=6)。
1.2.3 抗肿瘤活性评价方法 抑瘤率/%=(空白对照组肿瘤重量-治疗组肿瘤重量)/空白对照组肿瘤重量×100%;肿瘤体积(tumor volume,TV)的计算公式为:TV=1/2×a×b2,其中a、b分别表示长宽。根据测量结果计算出相对肿瘤体积(relative tumor volume,RTV ),计算公式为:RTV=Vt/V0,其中V0为开始给药时所测得肿瘤体积,Vt为每次测量时的肿瘤体积。同时计算出相对肿瘤增殖率(T/C%值):T/C%=TRTV/CRTV×100%,其中TRTV为治疗组相对肿瘤体积,CRTV为空白对照组相对肿瘤体积[9-10]。
1.2.4 免疫组化检测 治疗终点时,将瘤组织于4%多聚甲醛中固定,经脱水、透明、渗蜡、包埋、切片,用CD31抗体进行染色,观察肿瘤组织中微血管密度(MVD)。按凋亡检测试剂盒操作方法,经酶处理、标记、DBA显色、苏木精复染、镜检,凋亡细胞呈棕黄色,记录肿瘤细胞凋亡情况(n=3)。
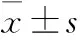
2 结果
2.1 CJ016对肿瘤细胞生长的抑制作用 实验结果显示,CJ016对多种肿瘤细胞株有抑制作用,其中对肺癌细胞系最为敏感(Tab 1)。在多株肺癌细胞IC50结果均小于1 μmol·L-1,其中在A549细胞株的IC50值达34.22 nmol·L-1,显示出较好的抑制作用。
2.2 CJ016体内抗肿瘤药效结果 肿瘤体积生长曲线和肿瘤重量称量结果见Fig 1、Tab 2。由结果可以看出,CJ016在5 mg·kg-1时即显示肿瘤抑制作用,体积测量和瘤重称量结果与空白对照组比较差异有显著性(P<0.01);同时,随剂量增加抑制作用也相对增强,在20 mg·kg-1剂量时对肿瘤生长抑制作用最好,其抑瘤率达70.08%,超过阳性对照紫杉醇组(69.54%),显示出较好的抗肿瘤效果;此外,治疗终点时,CJ016各剂量组裸鼠体重称量结果较空白对照组下降值比紫杉醇组要小,实验过程中裸鼠体重相对稳定。
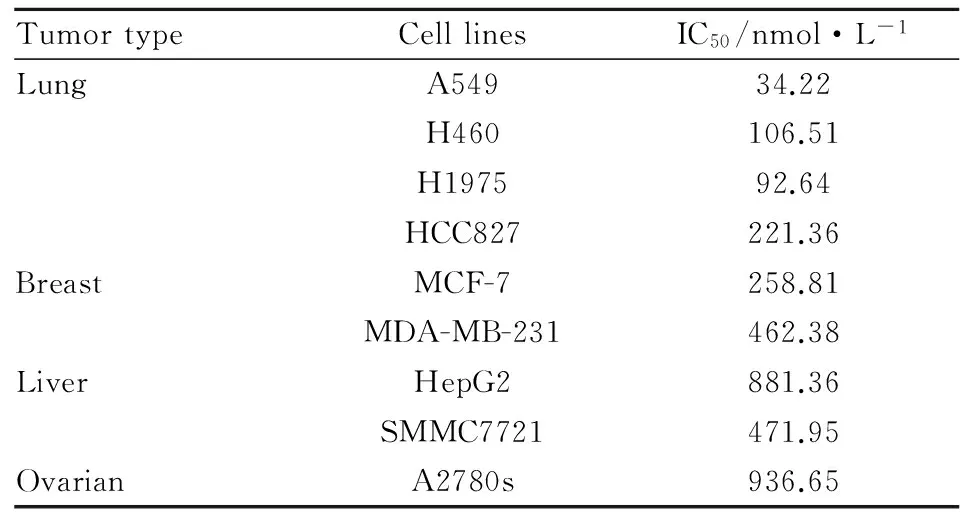
Tab 1 Effects of CJ016 on cell proliferation
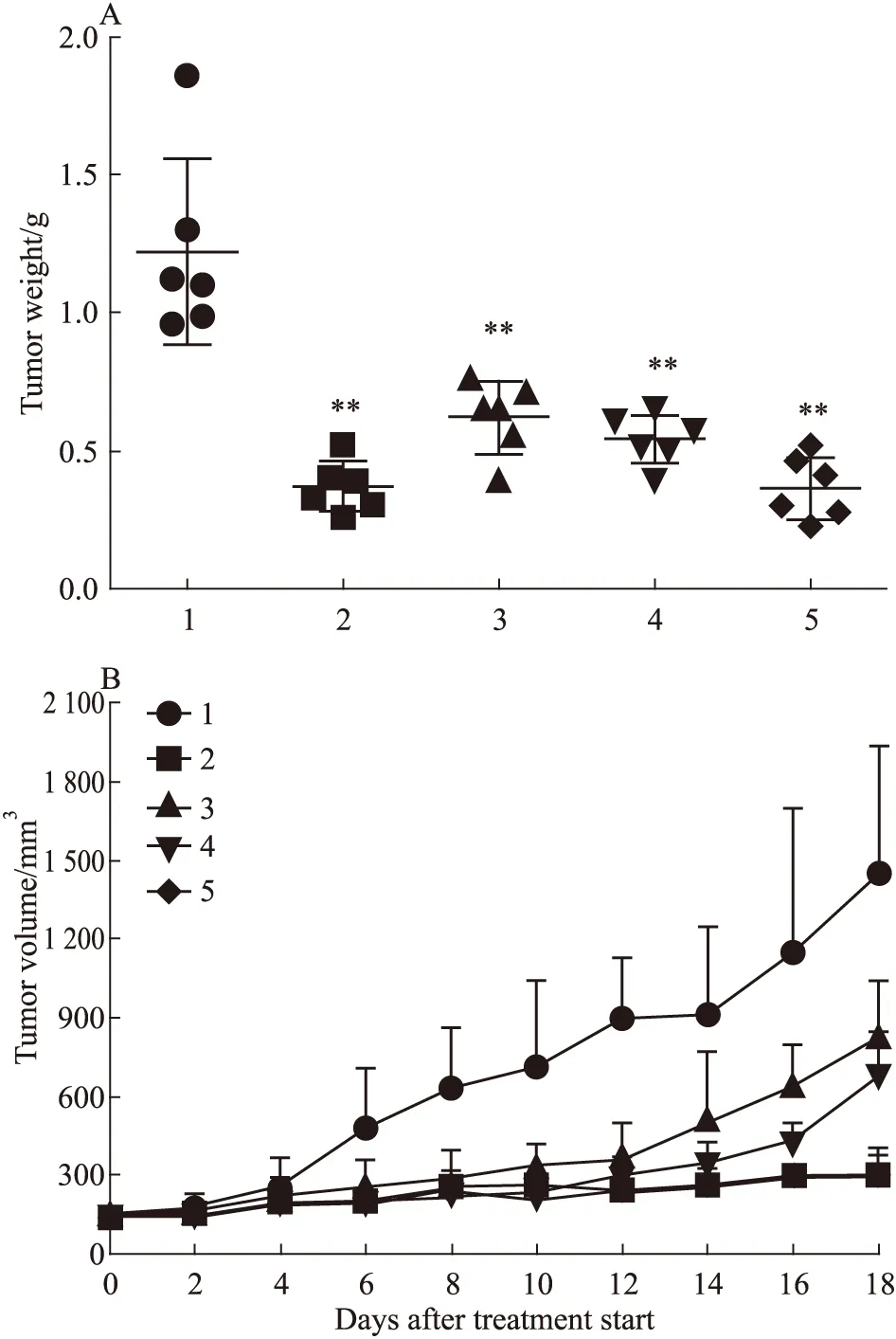
Fig 1 Effects of CJ016 on growth of A549 cell transplantation tumor
1:Control,2:PTX(20 mg·kg-1),3:CJ016(5 mg·kg-1),4:CJ016(10 mg·kg-1),5:CJ016(20 mg·kg-1).**P<0.01vscontrol

Fig 2 The immunohistochemical results of CJ016 on tumor(10×)
A:CD31;B: Apoptosis.1:Control,2:PTX(20 mg·kg-1),3:CJ016(5 mg·kg-1),4:CJ016(10 mg·kg-1),5:CJ016(20 mg·kg-1)

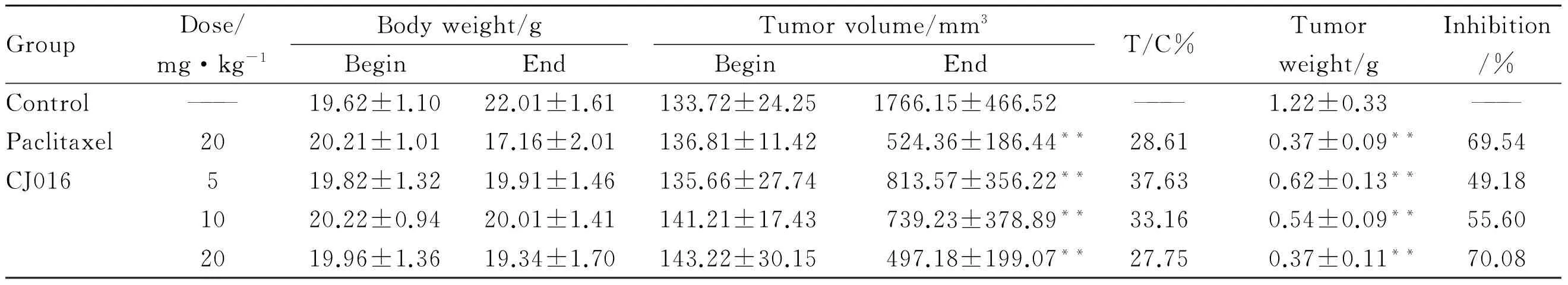
GroupDose/mg·kg-1Bodyweight/gBeginEndTumorvolume/mm3BeginEndT/C%Tumorweight/gInhibition/%Control———19.62±1.1022.01±1.61133.72±24.251766.15±466.52———1.22±0.33———Paclitaxel2020.21±1.0117.16±2.01136.81±11.42524.36±186.44**28.610.37±0.09**69.54CJ016519.82±1.3219.91±1.46135.66±27.74813.57±356.22**37.630.62±0.13**49.181020.22±0.9420.01±1.41141.21±17.43739.23±378.89**33.160.54±0.09**55.602019.96±1.3619.34±1.70143.22±30.15497.18±199.07**27.750.37±0.11**70.08
**P<0.01vscontrol
2.3 免疫组化检测结果 免疫组化检测结果如Fig 2所示:治疗终点时,CJ016各给药组瘤体新生血管数目较空白对照组明显减少(Fig 2A),显示出较好的抑制血管生成作用;同时,瘤体细胞凋亡数目与空白对照组比较明显增加(Fig 2B),说明CJ016对诱导肿瘤细胞凋亡有一定的促进作用。
3 讨论
近年来,越来越多的努力已投入到HDAC抑制剂的开发中。目前,美国食品和药品管理局(FDA)已批准4种HDAC抑制剂上市,分别是:Vorinostat(SAHA)、Romidepsin、Panobinostat(LBH589)和Belinostat;而我国自主知识产权的亚型选择性HDAC抑制剂西达苯胺(chidamide)已在全球获准上市[11]。这些HDAC抑制剂临床上主要用于皮肤或外周T细胞淋巴瘤以及多发性骨髓瘤的治疗,而对实体瘤的治疗效果欠佳。为扩大HDAC抑制剂的抗瘤谱,本课题组合成了一系列新型HDAC抑制剂,并优化得到编号为CJ016的小分子化合物,旨在用于实体瘤治疗[13]。体外研究表明(Tab 1),CJ016对多株人源肿瘤细胞株增殖有明显抑制作用,对多株肺癌细胞IC50检测结果均小于0.25 μmol·L-1。因此,本文选取A549细胞株(IC50=34.22 nmol·L-1)建立裸鼠移植瘤模型,探讨其体内抗肿瘤活性和可能的作用靶点。
HDAC抑制剂能通过调节表观遗传学与蛋白质的翻译后修饰,影响细胞基因表达和蛋白质的功能,从而导致肿瘤细胞分化、衰老、生长停滞以及凋亡,并抑制血管生成。不同的HDAC抑制剂由于分子特征、选择性、作用浓度和时间不同,其抗肿瘤的机制也会有差异。目前,已报道的文献指出,HDAC抑制剂能够抑制肿瘤细胞微环境内血管的生成、诱导肿瘤细胞周期阻滞和凋亡,同时也可直接作用非组蛋白,影响其乙酰化状态,调节多种基因的表达,从而发挥抗肿瘤活性。此外,越来越多的证据表明,HDAC抑制剂可通过直接影响恶性肿瘤细胞使其成为更有吸引力的免疫靶标,一定程度上加强宿主自身抗肿瘤免疫能力[14]。实验结果表明(Fig 1、Tab 2),CJ016对A549荷瘤小鼠肿瘤生长有明显抑制作用,20 mg·kg-1剂量时抑瘤率达70.08%(P<0.01)。免疫组化结果显示(Fig 2),CJ016各给药组肿瘤细胞CD31表达明显减少,其对瘤体周围血管生成有明显抑制作用;同时,瘤体细胞凋亡发生明显增加,肿瘤细胞增殖被有效抑制,共同起到抑制肿瘤细胞生长的作用。然而,CJ016抑制瘤体内血管生成和诱导肿瘤细胞凋亡可能的分子机制有待进一步研究。
细胞的凋亡途径主要包括死亡受体(细胞外)途径和线粒体(细胞内)途径,这两个途径均会诱导Caspase级联反应。大量的研究表明,HDAC抑制剂可激活多种肿瘤坏死因子(TNF)受体超家族成员及其配体的转录,同时还能影响Bcl-2家族基因表达和蛋白质的活性。Bcl-2家族包括促凋亡蛋白(Bax、Bak、Bim、Bmf、Bid等)和抗凋亡蛋白(Bcl-2、Bcl-XL、Bcl-w、Mcl-1等)。Bcl-2家族基因转录及蛋白质的活性在线粒体凋亡途径中起着重要作用[15]。因此,本课题组后续研究将围绕CJ016对Caspase家族和Bcl-2家族相关蛋白的影响展开进一步研究,以期更好地阐明其抑瘤机制。此外,裸鼠体重称量结果显示(Tab 2),治疗终点时,阳性药紫杉醇组裸鼠体重较分组时明显减少,而CJ016各给药组裸鼠体重基本保持恒定,说明其在药物刺激性和毒性反应上具有优势。综上,CJ016在治疗肺癌方面效果较为明显,且进入体内后未见明显的不良反应,其低毒、安全、有效的特点,颇具进一步开发的价值。
(致谢:感谢四川大学生物治疗国家重点实验室叶昊宇老师在移植瘤裸鼠模型建立及实验过程中的悉心指导和帮助,并提供动物饲养场所。)
[1] 潘智育,李 竟,陈云龙,等.8-溴乙氧基大黄酸的合成及其对肝癌HepG2.2.15细胞乙肝病毒抑制作用的研究[J].中国药理学通报,2016,32(8):1175-80.
[1] Pan Z Y,Li J,Chen Y L,et al.Synthesis of 8-bromo-ethoxy Rhein and evaluation of its inhibition effsct on hepatitis B virus in human hepatoma cells HepG2.2.15[J].ChinPharmacolBull,2016,32(8):1175-80.
[2] Falkenberg K J,Johnstone R W.Histonedeacetylases and their inhibitors in cancer,neurological diseases and immune disorders[J].DrugDiscovery,2014,13,673-91.
[3] 黄银妹,刘华钢,苏桂玉,等.二去水卫矛醇对肺癌NCI-H460细胞DNA拓扑异构酶Ⅱ的抑制作用[J].中国药理学通报,2016,32(11):1601-7.
[3] Huang Y M,Liu H G,Su G Y,et al.Inhibitory effect of dianhydrogalactitol on DNA Topo Ⅱ in NCI-H460 cells[J].ChinPharmacolBull,2016,32(11):1601-7.
[4] 陈前昭,曾于桦,邵 英,等.白藜芦醇抑制人结肠癌细胞增殖与p38MAPK的关系研究[J].中国药理学通报,2016,32(8):1110-4.
[4] Chen Q Z,Zeng Y H,Shao Y,et al.Anti-proliferation effect of resveratrol and p38 MAPK in human colon cancer cells[J].ChinPharmacolBull,2016,32(8):1110-4.
[5] 王佳艺,何俊劲,郝静超,等.多肽AP25与多西他赛联合用药对人乳腺癌裸鼠抑制癌的抑制活性研究[J].中国药理学通报,2015,31(9):1233-8.
[5] Wang J Y,He J J,Hao J C,et al.Combination of polypeptide AP25 and docetaxel in the treatment of breast cancer[J].ChinPharmacolBull,2015,31(9):1233-8.
[6] 骆 敏,罗燕妹,覃贵慧,等.缝隙连接蛋白43对人非小细胞肺癌HCC827细胞吉非替尼获得性耐药机制的初步研究[J].中国药理学通报,2016,32(11):1510-6.
[6] Luo M,Luo Y M,Qin G H,et al.Effect of Cx43 on acquired gefitinib-resistance mechannisms in human NSCLC HCC827 cells[J].ChinPharmacolBull,2016,32(11):1510-6.
[7] 孟令旗,刘 畅,孙虎男,等.醌茜素对人肺癌A549细胞增殖、凋亡的影响及初步机制研究[J].中国药理学通报,2016,32(11):1625-6.
[7] Meng L Q,Liu C,Sun H N,et al.Effects of quinalizarin and apoptosis of human lung cancer A549 cells and its possible mechanism[J].ChinPharmacolBull,2016,32(11):1625-6.
[8] West A C,Johnstone R W.New and emerging HDAC inhibitors for cancer treatment[J].JClinInvestig,2014,124:30-9.
[9] 施叶叶,苗筠杰,陈亚运,等.番茄枝内脂类化合物对耐紫杉醇肺癌细胞A549/Taxol的体外活性研究[J].中国中药杂志,2016,41(10):1884-8.
[9] Shi Y Y,Miao J J,Chen Y Y,et al.Structure activity relationship of annonaceousacetogenins against multidrug resistant human lung cancer cell line A549/Taxolinvitro[J].ChinJChinMatMed,2016,41(10):1884-8.
[10]张倩雯,张媛媛,晁振华,等.羟氯喹对人乳腺癌MDA-MB-435细胞增殖及凋亡的影响[J].中国药理学通报,2013,29(11):1549-53.
[10]Zhang Q W,Zhang Y Y,Zhao Z H,et al.Influence of hydroxychloroquine on the proliferation and apoptosis of breast cancer cell MDA-MB-435[J].ChinPharmacolBull,2013,29(11):1549-53.
[11]Bose P,Dai Y,Grant S,et al.Histonedeacetylase inhibitor (HDACI) mechanisms of action:emerging insights[J].PharmacolTherap,2014,143:323-6.
[12]严 晨,邬亚华,王子瑶,等.水飞蓟素对人骨肉瘤Saos-2细胞的抑制作用及相关机制[J].中国药理学通报,2016,32(7):966-70.
[12]Yan C,Wu Y H,Wang Z Y,et al.Inhibitory effect of silymarin on human osteosarcoma Saos-2 cells and its mechanism[J].ChinPharmacolBull,2016,32(7):966-70.
[13]Li D,Marchenko N D,Moll U M,et al.SAHA shows preferential cytotoxicity in mutant p53 cancer cells by destabilizing mutant p53 through inhibition of the HDAC6-Hsp90 chaperone axis[J].CellDeathDifferent,2011,18:1904-13.
[14]Santo L,Hideshima T,Kung A L,et al.Preclinicalactivity,pharmacodynamic,and pharmacokinetic properties of a selective HDAC6 inhibitor ACY-1215,in combination with bortezomib in multiple myeloma[J].Blood,2012,119:2579-89.
[15]Wang J,Pursell N W,Samson M E,et al.Potential advantages of CUDC-101,a multitargetedHDAC,EGFR,and HER2 inhibitor,in treating drug resistance and preventing cancer cell migration and invasion[J].MolCancerTherap,2013,12:925-36.
Study of CJ016 in treatment of lung cancer
GAN Ping,TAN Yong-hong,JIN Wei-hua, WANG Ling-jie,YU Bo-tao
(DeptofPharmacy,GeneralHospitalofChengduMilitaryCommand,Chengdu610083,China)
Aim To study the therapeutic effect of CJ016 on human lung cancer model and the mechanism.Methods An experimental human lung adenocarcinoma model of A549 was set up to investigate the anti-tumor effect of CJ016, while the effect of angiogenesis and apoptosis in tumor were detected.ResultsInvitro,the cell proliferation was inhibited significantly by CJ016,and the value of IC50was 34.22 nmol·L-1.Invivo, the tumor inhibition rate and T/C% value were 70.08% and 27.75%, respectively, at the dose of 20 mg·kg-1.Meanwhile,CJ016 could reduce the expression of CD31 and promote the apoptosis of tumor cells.Conclusion CJ016 can inhibit the growth of A549 cells, and the possible mechanism may be related to the reduction of angiogenesis and inducing tumor cell apoptosis.
lung cancer; mechanism; CJ016; A549; IC50; CD31;apoptosis
时间:2017-3-4 11:50
http://kns.cnki.net/kcms/detail/34.1086.R.20170304.1150.036.html
2016-10-25,
2016-12-21
国家自然科学基金青年基金资助项目(No 81402493)
甘 萍(1987-),女,硕士,药剂师,研究方向:肿瘤药理学,E-mail:ganping_2007@163.com; 于波涛(1965-),男,博士,主任药师,通讯作者,E-mail:cj_yubotao@163.com
10.3969/j.issn.1001-1978.2017.03.018
A
1001-1978(2017)03-0384-05
R-332;R329.25;R363-332;R73-352;R734.2;R916.4;R979.1
