1-甲基乙内酰脲抑制家兔生长激素的分泌
2017-03-17赵晓春梁庆模
龙 飞,赵晓春,梁庆模
(南华大学附属第一医院1.胃肠外科、2.乳甲外科,湖南 衡阳 421001)
1-甲基乙内酰脲抑制家兔生长激素的分泌
龙 飞1,赵晓春1,梁庆模2
(南华大学附属第一医院1.胃肠外科、2.乳甲外科,湖南 衡阳 421001)
目的 探索1-甲基乙内酰脲(1-methylhydantoin, MH)抑制家兔生长激素(growth hormone, GH)基础分泌以及拮抗生长激素释放激素促分泌的作用。方法 将36只家兔按给药种类不同,随机分为生理盐水组(A组)、MH组(B组)、奥曲肽组(C组)、生长激素释放激素组(D组)、生长激素释放激素+MH组(E组)和生长激素释放激素+奥曲肽组(F组),每组6只。各组家兔均在注射药物之前和之后5、15、30、45、60 min各采血1.0 mL,利用酶联免疫吸附测定试剂盒检测血清GH水平,同时,密切观察各组家兔在注射相应药物后的行为活动情况(1周)。结果 ①A组家兔各个时间点的GH水平无差异(P>0.05);②与A组相比,B组和C组家兔GH水平明显降低(P<0.05),而D组家兔GH水平明显升高(P<0.05);③与D组相比,E组和F组家兔GH水平明显降低(P<0.05);④各组实验家兔在静脉注射相应药物后,1周之内未观察到明显的毒副反应。结论 ① MH能抑制家兔GH的基础分泌;②MH能拮抗生长激素释放激素的促分泌作用。
1-甲基乙内酰脲;家兔;生长激素;生长激素释放激素;生长抑素;生长抑素类似物;奥曲肽
天然的生长抑素(somatostatin, SST)半衰期极短(<3 min),且缺乏特异性,限制了它的临床应用。于是科学家们研发了一系列肽类生长抑素类似物(somatostatin analogues, SSTAs),如奥曲肽(octreotide, SMS 201-995)、兰瑞肽(lanretide, BIM 23014)、伐普肽(vapreotide, RC 160)及帕瑞肽(pasireotide, SOM-230)等。目前,肽类SSTAs已应用于急性胰腺炎、消化道瘘、消化道出血、肢端肥大症、库欣病等疾病的治疗[1-3],并且在神经内分泌肿瘤的诊断和治疗中占据重要地位[4-5]。虽然人工合成的肽类SSTAs相对于天然的SST有了很大改进,但是它们在临床应用中仍存在许多弊端,如仅限于注射给药,受体亚型选择性欠佳,很难渗透入血-脑屏障、血-视网膜屏障,具有免疫原性等。于是非肽类生长抑素类似物(non-peptide somatostatin analogues, NPSSTAs)应运而生。NPSSTAs为无氨基酸肽链结构的模拟肽化合物,可以通过与各型生长抑素受体结合而发挥类似于SST的生物学作用。1-甲基乙内酰脲(1-methylhydantoin, MH)是乙内酰脲类化合物中的一种,化学结构分析显示其具有与某些NPSSTAs相似的空间结构。MH是否具有SST的生理功能,是否属于NPSSTAs,值得深入研究。本实验将探索MH抑制家兔生长激素(growth hormone, GH)基础分泌以及拮抗生长激素释放激素(GHRH)促分泌的作用,从而验证MH具有SST的基本功能,为NPSSTAs的研发提供实验依据。
1 材料与方法
1.1 动物 健康♂新西兰白兔36只,3月龄,体质量约2.5 kg,购自南华大学实验动物学部,生产许可证号:SCXK(湘)2015-0002,使用许可证号:SYXK(湘)2010-0006。动物的饲养条件遵照《实验动物饲养条例》,饲养于南华大学实验动物学部,环境符合普通级国家标准,即温度恒定为18℃~29℃,相对湿度为40%~70%,室内保持安静、清洁、干燥和通风,光照模式为12 h的光/暗周期。实验前,适应性喂养2周,采用全价颗粒饲料,每天定时、定量,上午、下午各1次,自由进水。所有实验选在下午14 ∶00~16 ∶30进行,整个实验过程中禁食禁水。
1.2 试剂与耗材 ①1-甲基乙内酰脲:Sigma公司,用无菌生理盐水配制成浓度分别为50、100 g·L-1的1-甲基乙内酰脲溶液;②奥曲肽:Sigma公司,用无菌生理盐水配制成浓度分别为5、10 mg·L-1的奥曲肽溶液;③人生长激素释放激素(growth hormone-releasing hormone, GHRH):Sigma公司,用无菌生理盐水配制成浓度分别为5、10 mg·L-1的人GHRH溶液;④无菌生理盐水:湖南科伦制药有限公司;⑤家兔GH酶联免疫吸附测定试剂盒:武汉伊莱瑞特生物科技有限公司(Elabscience)提供(产品编号:E-EL-RB2030c)。
1.3 仪器 ①电子天平:北京赛多利斯(Sartorius)天平有限公司;②超纯水器:上海同田生物技术股份有限公司;③恒温箱:德国Eppendorf公司;④离心机:德国Eppendorf公司;⑤冰箱:中国海尔股份有限公司;⑥酶标生化多功能仪:美国BIO-TEK公司(型号:ECX808);⑦高精度移液器:德国Eppendorf公司。
1.4 实验分组 将36只家兔按给药种类不同,随机分为生理盐水组(A组)、1-甲基乙内酰脲组(B组)、奥曲肽组(C组)、生长激素释放激素组(D组)、生长激素释放激素+1-甲基乙内酰脲组(E组)和生长激素释放激素+奥曲肽组(F组),共6组,每组6只。A组家兔予以生理盐水2.0 mL静脉注射,B组家兔予以50 g·L-1的1-甲基乙内酰脲溶液2.0 mL静脉注射,C组家兔予以5 mg·L-1的奥曲肽溶液2.0 mL静脉注射,D组家兔予以5 mg·L-1的人生长激素释放激素溶液2.0 mL静脉注射,E组家兔先后静脉注射10 mg·L-1的人生长激素释放激素溶液和100 g·L-1的1-甲基乙内酰脲溶液各1.0 mL,F组家兔先后静脉注射10 mg·L-1的人生长激素释放激素溶液和10 mg·L-1的奥曲肽溶液各1.0 mL。
1.5 实验步骤 ① 采血:将家兔用兔笼固定,拔去兔耳中央动脉局部的被毛,酒精消毒,用手指轻弹兔耳,使动脉扩张充血;用左手固定兔耳,右手持注射器,在中央动脉的末端,沿着与动脉平行的向心方向刺入动脉,即可见血液进入针管,迅速抽取血液1.0 mL,退针并立即压迫止血。采血后,将家兔置于饲养笼,自由活动。血液标本置于1.5 mL的无菌EP管中使其自然凝固。② 给药:采血后,各组家兔分别静脉注射相应药物。具体方法:采用家兔外耳缘静脉注射给药;注射前,先将家兔放入固定笼内固定好,拔去注射部位的被毛,用75%的酒精消毒,手指轻弹兔耳,使静脉充盈;左手食指和中指夹住静脉的近心端,拇指绷紧静脉的远心端,无名指及小指垫在下面,右手持注射器,尽量从静脉的远端刺入血管,回一下血,放松对耳根处血管的压迫,移动拇指于针头上以固定,放开食指、中指,将药液缓慢注入;注射完毕,用棉签压住针眼,拔去针头,继续压迫数分钟。③ 采血:按前述方法分别于给药后5、15、30、45、60 min各采血1.0 mL。④ 离心:全血标本室温放置2 h后,于1 000×g离心20 min,取上清置于1.5 mL的无菌EP管中,并分装保存于-20℃。⑤ 检测:按家兔GH酶联免疫吸附测定试剂盒使用说明检测血清GH水平。⑥ OD值换算:使用curve expert 1.4专业曲线制作软件,每个标准品的OD值减去空白孔值的OD后,以OD值为横坐标,标准品的浓度为纵坐标,绘出标准曲线,并将样品的OD值(减去空白孔后的OD值)代入标准曲线的拟合方程式,计算出样品浓度。根据实验要求,标准曲线的相关系数r应大于0.99。⑦ 密切观察各组家兔在注射相应药物后的行为活动情况(1周)。
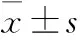
2 结果
2.1 标准品检测结果 标准品的浓度与对应的OD值见Tab 1。根据标准品的浓度与对应的OD值,使用curve expert 1.4专业曲线制作软件绘出标准曲线(Fig 1),并求得标准曲线的拟合方程式:线性拟合y=a+bx,其中a=1.616 472 818 45,b=44.326 933 680 4,相关系数r=0.998 528 37>0.99,可信程度高,符合要求。
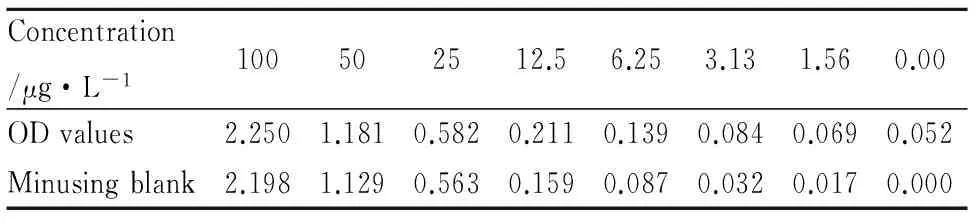
Tab 1 Concentrations of standard substance and corresponding OD values

Fig 1 The standard curve
2.2 样品检测结果 将样品的OD值减去空白孔的OD值后,代入标准曲线的拟合方程式,利用curve expert 1.4软件计算出样品浓度。各组家兔各个时间点血清GH水平计量资料的统计结果见Tab 2。
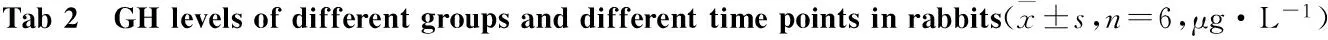

GroupTime/min0515304560A3.97±0.464.05±0.423.96±0.353.92±0.353.84±0.304.01±0.29B3.78±0.182.89±0.20*#2.15±0.20*#2.10±0.20*#2.21±0.19*#3.06±0.19*#C3.86±0.162.62±0.13*#1.56±0.15*#2.18±0.17*#2.87±0.17*#3.54±0.14*#D4.06±0.386.78±0.66*13.67±0.83*10.28±0.98*5.54±0.53*4.10±0.45E3.94±0.225.24±0.31*#7.32±0.25*#5.64±0.28*#4.48±0.28*#3.31±0.19*#F3.82±0.234.80±0.26*#6.88±0.34*#5.76±0.30*#4.92±0.29*#3.84±0.25
*P<0.05vsgroup A;#P<0.05vsgroup D
2.3 A、B、C三组之间的比较 通过重复测量数据的方差分析以及单因素方差分析,结合Fig 2可知:①A组家兔各个时间点的GH水平无差异(P=0.943),提示家兔的基础GH水平在14 ∶00~16 ∶30这一时间段波动较小;②B组家兔在静脉注射MH 100 mg后5、15、30、45、60 min,血清GH浓度均明显低于同一时间点的A组(P<0.05),提示MH对家兔GH的基础分泌有抑制作用,并且100 mg的MH静脉注射后5 min左右家兔血清GH水平开始下降,15 min~30 min达到低谷,其作用时间可能超过60 min;③C组家兔在静脉注射奥曲肽10 μg后5、15、30、45、60 min,血清GH浓度均明显低于同一时间点的A组(P<0.05),从而验证了奥曲肽对家兔GH基础分泌的抑制作用;④B、C两组之间无差异(P=0.999),提示100 mg的MH和10 μg的奥曲肽对家兔GH基础分泌的抑制效果相当。

Fig 2 Changes of rabbits’ serum GH concentration in group A, B and C over time
*P<0.05vsgroup A
2.4 A、D两组之间的比较 通过重复测量数据的方差分析结合Fig 3可知:D组家兔在静脉注射人GHRH 10 μg后5、15、30、45、60 min,血清GH浓度均明显高于同一时间点的A组(P<0.05),从而验证了人GHRH对家兔GH分泌的促进作用,10 μg的人GHRH静脉注射后5 min左右家兔血清GH水平开始升高,15 min左右达到高峰,其作用时间可维持60 min左右。
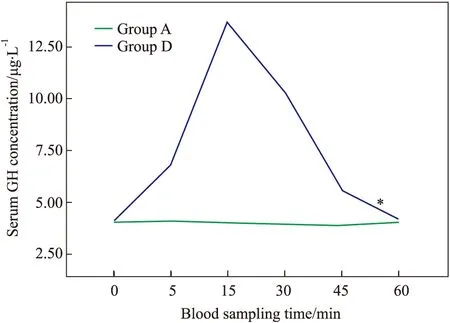
Fig 3 Changes of rabbit serum GH concentration in group A and D over time
*P<0.05vsgroup A
2.5 D、E、F三组之间的比较 通过重复测量数据的方差分析结合Fig 4可知:① E组家兔在先后静脉注射人GHRH 10 μg和MH 100 mg后5、15、30、45、60 min,血清GH浓度均明显低于同一时间点的D组(P<0.05),提示MH能拮抗人GHRH的促分泌作用;②F组家兔在先后静脉注射GHRH 10 μg和奥曲肽10 μg后5、15、30、45 min,血清GH浓度均明显低于同一时间点的D组(P<0.05),从而验证了奥曲肽对人GHRH的拮抗作用;③E、F两组之间无差异(P=1.000),提示100 mg的1-甲基乙内酰脲和10 μg的奥曲肽对人GHRH的拮抗作用相当。
2.6 各组家兔在注射相应药物后的行为活动情况 各组家兔在静脉注射相应药物后,1周之内未出现死亡,也未观察到明显的行为活动异常,如撕咬、尖叫、攻击行为等,无明显的进食、饮水异常,无呕吐、腹泻及烦躁不安,无大小便异常及眼鼻异常分泌物等。
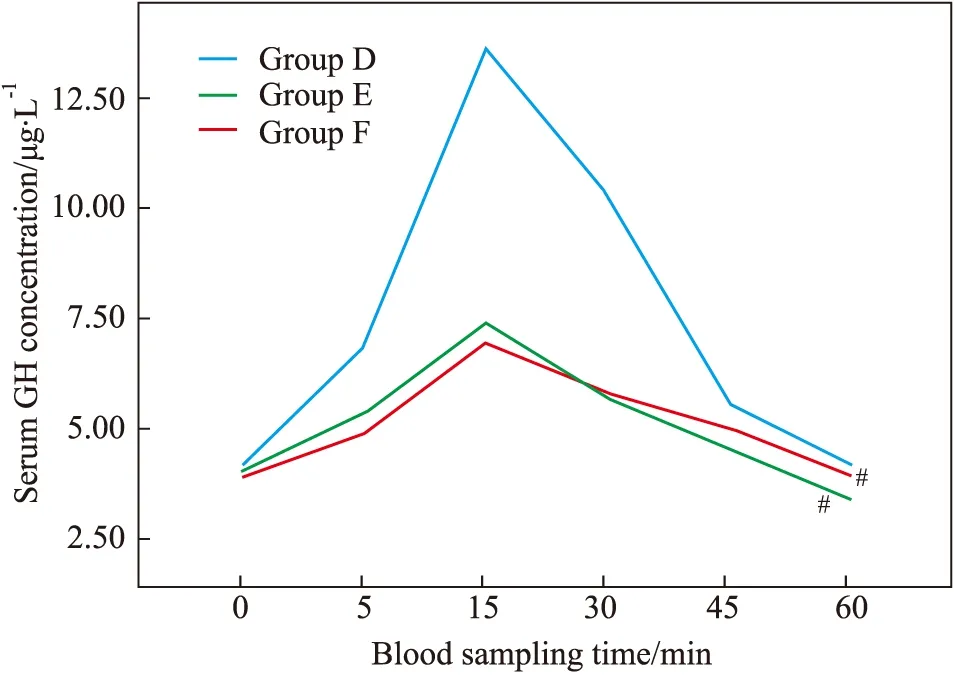
Fig 4 Changes of rabbit serum GH concentration in group D, E and F over time
#P<0.05vsgroup D
3 讨论
3.1 乙内酰脲类化合物 乙内酰脲(hydantoin)是一种五元杂环化合物,化学名为2,4-咪唑烷二酮(2,4-imidazolidinedione)。除了C2和C4上的羰基,乙内酰脲杂环上的C5、N1和N3均可连接不同的取代基,从而形成各种乙内酰脲的衍生物,并产生不同的理化特性和药理作用。但目前除了卤代乙内酰脲类化合物应用于消毒杀菌和苯基乙内酰脲类化合物用于抗惊厥和心律失常外,大部分乙内酰脲类化合物的药理作用(如消除活性氧和自由基、降低血糖、阻滞钠离子通道、抑制尿毒症毒素的产生以及抗炎、抗肿瘤等)还处于研究阶段[6]。1-甲基乙内酰脲是乙内酰脲类化合物中的一种,又称为1-甲基海因,其分子质量小、结构简单[7-9]、原料价廉易得、合成方法简便[9],并且口服生物利用度高、透膜性强、毒性极低、符合口服药物标准[10]。此外研究还显示,1-甲基乙内酰脲可能具有抗炎[11]、消除活性氧和自由基[12-14]、抗肿瘤[15-18]、止咳平喘[11,19]、抗抑郁[20]等药理作用。故将其作为一种新药进行研发,有广阔的应用前景。
3.2 1-甲基乙内酰脲可能是一种新型的非肽类生长抑素类似物 近几年来,本课题组一直致力于MH及NPSSTAs的研究,尤其是探索二者之间的关系。我们通过分子结构分析了解到MH具有与某些NPSSTAs相似的化学基团。例如,美国佛罗里达州阿拉楚阿市RFE制药公司合成的SCR007就是一种咪唑烷二酮(imidazolidinedione)衍生物,同时也是一种高选择性作用于生长抑素2型受体的非肽类生长抑素受体激动剂,具有很好的镇痛作用[21];2007年发布的专利号为US7189856的一种NPSSTA的核心结构为乙内酰脲,故属于乙内酰脲类化合物,可选择性作用于生长抑素2型受体[22]。基于以上事实,我们猜测MH可能也是一种非肽类生长抑素受体配体。为了证实这一猜想,我们研究了MH对SD大鼠生长激素水平的影响,发现MH能降低苯巴比妥造模大鼠生长激素的水平[23],提示其可能具有生长抑素的功能,但有必要通过更加完善及有说服力的实验予以进一步证实。
在本实验中,静脉注射MH或奥曲肽后,家兔的GH水平明显降低,提示MH和奥曲肽对家兔GH的分泌均有抑制作用;静脉注射人GHRH后,家兔的GH水平明显升高,提示人GHRH对家兔GH的分泌有促进作用;静脉注射GHRH后立即注射MH或奥曲肽,家兔GH水平的升高幅度明显下降,提示MH和奥曲肽对GHRH均有拮抗作用。此外,本实验还发现:①家兔的GH基础水平在14 ∶00~16 ∶30这一时间段波动较小;②100 mg的MH静脉注射后5 min左右家兔GH水平开始下降,15~30 min达到低谷,其作用时间可能超过60 min。这些实验结果证实了MH对家兔GH分泌的抑制作用以及对GHRH的拮抗作用,表明MH具有生长抑素及其类似物最基本的功能,可能是一种新型的NPSSTA。
3.3 1-甲基乙内酰脲与奥曲肽的作用效果比较 目前,关于MH的药理作用(如止咳平喘、抗抑郁等)的研究主要使用大鼠作为研究对象,给药途径一般是灌胃,剂量通常为10~200 mg·kg-1不等[19-20]。Ienaga等[24]研究MH在哺乳动物中的代谢途径时发现,给大鼠一次性口服50 mg·kg-1的MH后,大约15 min达到最大血药浓度,Cmax=44.7 mg·L-1。由此可以推测,当MH的血药浓度达到44.7 mg·L-1时足以发挥止咳平喘、抗抑郁等药理作用。本实验因为要反复多次采血检测血清GH水平,故选择了同为哺乳动物且更大型的家兔作为研究对象,同时,为了便于与奥曲肽对比作用效果,给药途径采用静脉注射。家兔的血容量约为45~70 mL·kg-1,本实验家兔体质量约2.5 kg,若要达到上述血药浓度,则静脉给药量需要5.0~7.8 mg。故在预实验中,我们设定了3个剂量组:低剂量组(1.0 mg,MH)、中剂量组(10 mg,MH)和高剂量组(100 mg,MH)。结果发现:与对照组(生理盐水)相比,低、中、高剂量组家兔血清GH浓度均明显降低(P<0.05),且下降水平高剂量组>中剂量组>低剂量组(P<0.05),提示MH对家兔GH的分泌有抑制作用,并且在1.0~100 mg有剂量依赖性,剂量越大抑制作用越强、越持久。奥曲肽是一种人工合成的八肽环状化合物。作为最经典的SSTAs,奥曲肽具有与内源性SST相似的作用,但作用更强且持久,其半衰期较天然的SST长30倍。目前,奥曲肽已广泛用于急性胰腺炎、消化道瘘、消化道出血、肢端肥大症、库欣病、神经内分泌肿瘤等疾病的治疗,并取得较好的效果。但奥曲肽作为一种肽类SSTAs,在临床应用中仍存在一些弊端,如仅限于注射给药,受体亚型选择性欠佳,很难渗透入血-脑屏障、血-视网膜屏障,并且具有免疫原性。而NPSSTAs也许能弥补这些不足。
在本实验中,B组和C组以及E组和F组家兔GH水平的差异无统计学意义(P>0.05),提示100 mg的MH和10 μg的奥曲肽对家兔GH基础分泌的抑制效果和对GHRH的拮抗作用相当。但由于缺乏统一的比较标准,尚不能认定MH和奥曲肽的作用效果孰强孰弱。二者的作用效果比较有待进一步研究。但既然实验结果提示MH可能属于NPSSTAs,倘若又能证实其作用效果与奥曲肽相当,则MH将发挥其口服生物利用度高、半衰期长、选择性强、透膜性好、无免疫原性等优点,可能取代奥曲肽而应用于急性胰腺炎、消化道瘘、消化道出血、肢端肥大症、库欣病、神经内分泌肿瘤等疾病的治疗。
3.4 1-甲基乙内酰脲的毒副作用 几乎所有的药物都可能出现不良反应,只是反应的程度和发生率不一样。药物的毒副作用可能制约其临床应用范围及疗程,并影响其最大疗效的发挥。所以,研发毒副反应小的药物对疾病的治疗至关重要。有报道称MH的毒性极低[10]。在本实验中,家兔在静脉注射100 mg的MH后,1周之内未出现死亡,也未观察到明显的行为活动异常,如撕咬、尖叫、攻击行为等,无明显的进食、饮水异常,无呕吐、腹泻及烦躁不安,无大小便异常及眼鼻异常分泌物等,也表明MH的毒副反应较轻。但这仅限于1周的行为活动观察,尚需进行更长时间的观察及相应的实验室检测(如肝肾功能等),并且可以考虑通过胃饲加大剂量,以进一步研究MH的作用效果及毒副作用。
3.5 本实验的意义与展望 综上所述,MH具有生长抑素及其类似物最基本的功能,可能是一种新型的NPSSTA,并具有广阔的应用前景。目前,国外仍在不断开发新型、高效的NPSSTAs,但尚无关于MH作为NPSSTAs的文献报道,而国内在这一领域更是空白。故本实验为NPSSTAs的研发提供了新的方向,但尚需通过其他实验(如受体结合分析、功能实验等)进一步证实。此外,关于MH的药代动力学和毒理学尚不明确,其抑制GH分泌的作用机制尚需进一步研究,并且是否存在其他更好的具有生长抑素功能的乙内酰脲类化合物也是我们要继续探索的方向。
[1] Rai U, Thrimawithana T R, Valery C, et al. Therapeutic uses of somatostatin and its analogues: current view and potential applications[J].PharmacolTher, 2015, 152:98-110.
[2] Sliwińska-mossoń M, Vesel M, Milnerowicz H.The clinical significance of somatostatinin pancreatic diseases[J].AnnEndocrinol(Paris),2014,75(4):232-40.
[3] Martin-grace J, Tamagno G. Somatostatin analogs in the medical management of occult bleeding of the lower digestive tract[J].GastroenterolResPract, 2015,2015:702921.
[4] Taïeb D, Garrigue P, Bardiès M, et al. Application and dosimetric requirements for Gallium-68-labeled somatostatin analogues in targeted radionuclide therapy for gastroenteropancreatic neuroendocrine tumors[J].PETClin, 2015,10(4): 477-86.
[5] Narayanan S, Kunz P L. Role of somatostatin analogues in the treatment of neuroendocrine tumors[J].JNatlComprCancNetw, 2015,13(1):109-17.
[6] 颜翔鹏,梁庆模.乙内酰脲类化合物药理作用研究进展[J].中国药事,2014,28(6): 651-4.
[6] Yan X P, Liang Q M. Research progress in the pharmacological effects of hydantoin compounds[J].ChinPharmAff, 2014,28(6): 651-4.
[7] Puszynska-tuszkanow M, Daszkiewicz M, Maciejewska G, et al. Principle and Nickel(II) ion reactivity towards 1-methyhydantoin[J].Polyhedron, 2011, 30: 2016-25.
[8] Nogueira B A, Ildiz G O, Canotilho J, et al. Molecular structure, infrared spectra, photochemistry, and thermal properties of 1-methylhydantoin[J].JPhysChemA, 2014, 118(31): 5994-6008.
[9] 王永生, 杨桠楠, 李亚巍, 等.1-甲基海因的合成及其晶体结构分析[J].吉林大学学报(理学版), 2007, 45(4): 658-61.
[9] Wang Y S, Yang Y N, Li Y W, et al. Synthesis of 1-methylhydantoin and its crystal structure [J].JJilinUniv(SciEd), 2007, 45(4): 658-61.
[10] Miyoda Y, Saito M, Shibuya A, et al. Method for producing 1-alkylhydantoin.Japan:JP20032171367[P], 2003-06-30.
[11] Lu H B, Kong D J, Wu B, et al.Synthesis and evaluation of anti-inflammatory and antitussive activity of hydantoin derivatives[J].LettDrugDesDiscov, 2012, 9(6): 638-42.
[12] Ienaga K, Park C H, Yokozawa T. Protective effect of an intrinsic antioxidant, HMH(5-hydroxy-1-methylhydantoin, NZ-419), against cellular damage of kidney tubules[J].ExpToxicolPathol, 2013, 65(5): 559-66.
[13] Ienaga K, Sohn M, Naiki M, et al. Creatinine metabolite, HMH (5-hydroxy-1-methylhydantoin; NZ-419), modulates bradykinin-induced changes in vascular smooth muscle cells[J].JReceptSignalTransductRes, 2014, 34(3): 195-200.
[14] 高利娜, 杨 爽, 刘俊亭, 等. 5-羟基-1-甲基海因对百草枯所致大鼠肾毒性防护作用的实验研究[J].中华危重病急救医学, 2015, 27(4): 246-9.
[14] Gao L N, Yang S, Liu J T, et al. Preventive effects of 5-hydroxy-1-methylhydantoin on paraquat-induced nephrotoxicity in rat[J].ChinCritCareMed, 2015, 27(4): 246-9.
[15] 李 卫, 梁庆模, 周筱筠, 等. 1-甲基乙内酰脲对SW480细胞作用的研究[J]. 中国现代医学杂志, 2014, 24(9): 17-20.
[15] Li W, Liang Q M, Zhou X J, et al. Research of SW-480 cells by 1-methylhydantoin[J].ChinaJModMed, 2014, 24(9): 17-20.
[16] 许云吉.1-甲基乙内酰脲及5-Fu抑制结肠癌SW480细胞的研究[D].衡阳:南华大学, 2013.
[16] Xu Y J. Inhibitory effect of 1-methylhydantoin and 5-Fu on colonic cancer SW480 cells[D]. Hengyang: University of South China, 2013.
[17] 肖美华. 1-甲基乙内酰脲及顺铂对SGC-7901细胞增殖侵袭迁移的研究[D].衡阳:南华大学, 2015.
[17] Xiao M H. Study of 1-methyl-hydantoin and cisplatin of proliferation, invasion and metastasis in SGC-7901 cell [D].Hengyang: University of South China, 2015.
[18] 毛 武. 1-甲基乙内酰脲与5-Fu对胃癌SGC-7901细胞抑制增殖及诱导凋亡的研究[D].衡阳:南华大学, 2015.
[18] Mao W. Effects of anti-proliferation and induced apoptosis by 1-methylhydantoin and 5-Fu on gastric cancer SGC-7901 cells [D].Hengyang: University of South China, 2015.
[19] 韩 冬, 董雪莲, 邱智东. 1-甲基海因对哮喘大鼠模型的平喘作用及其机制[J].吉林大学学报(医学版), 2014, 40(3): 543-8.
[19] Han D, Dong X L, Qiu Z D. Antiasthmatic effect of 1-methylhydantoin on rat asthma model and its mechanism[J].JJilinUniv(MedEd), 2014, 40(3): 543-8.
[20] 游杰舒, 张瑞睿, 王春国, 等. 1-甲基海因对抑郁大鼠行为学的影响及机制初探[J].中国药理学通报, 2013, 29(8): 1104-8.
[20] You J S, Zhang R R, Wang C G, et al. Effects of 1- methylhydantoin on behavior changes in depressive rats and its possible mechanisms[J].ChinPharmacolBull, 2013, 29(8): 1104-8.
[21] Ji G C, Zhou S T, Shapiro G, et al. Analgesic activity of a non-peptide imidazolidinedione somatostatin agonist:invitroandinvivostudies in rat[J].Pain, 2006,124(1-2):34-49.
[22] Shapiro G, Natchus M G, Lockwood MA, et al. Non-peptide somatostatin receptor ligands. US: 7189856[P]. 2007-03-13.
[23] 颜翔鹏.1-甲基乙内酰脲抑制大鼠生长激素的研究[D].衡阳: 南华大学, 2014.
[23] Yan X P. The study of 1-methyl-hydantoin inhibits the growth hormone of rats[D]. Hengyang: University of South China, 2014.
[24] Ienaga K, Nakamura K, Naka F, et al. The metabolism of 1-methylhydantoin via 5-hydroxy-1-methylhydantoin in mammals[J].BiochimBiophysActa, 1988, 967(3): 441-3.
1-methylhydantoin inhibits secretion of growth hormone in rabbits
LONG Fei1, ZHAO Xiao-chun1, LIANG Qing-mo2
(1.DeptofGastrointestinalSurgery,2.DeptofBreastandThyroidSurgery,theFirstAffiliatedHospitalofUniversityofSouthChina,HengyangHunan421001,China)
Aim To explore whether 1-methylhydantoin(MH) could inhibit the basal secretion of growth hormone(GH) and suppress the promoting effect of growth hormone-releasing hormone(GHRH) in rabbits. Methods Thirty-six rabbits were randomly divided into six experimental groups according to the kind of dosing drugs, namely normal saline group(A), MH group(B), octreotide group(C), GHRH group(D), GHRH + MH group(E), GHRH + octreotide group(F), with 6 rabbits in each group. Blood was sampled (1.0 mL each time) from each rabbit before injecting drugs and 5, 15, 30, 45, 60 min after drug administration. Clotting spontaneously, rabbits blood samples were centrifugated for 20 minutes at approximately 1 000×gand the supernatant was collected. Serum GH concentrations were determined by enzyme linked immunosorbent assay kit(ELISA Kit). Meanwhile, the behavior of rabbits in each group after injecting drugs was closely observed. Results The GH level of rabbits in group A at each time point had no significant differences(P>0.05). Group B and group C rabbit GH levels were significantly lower than those of group A(P<0.05), while GH levels in group D were obviously higher than those of group A(P<0.05). Compared with group D, rabbit GH levels in group E and group F decreased markedly(P<0.05). No obvious toxic and side effects had been observed within one week after the experimental rabbits were administered corresponding drugs by intravenous injection. Conclusions 1-methylhydantoin could inhibit the basal secretion of GH in rabbits. 1-methylhydantoin could suppress the promoting effect of GHRH in rabbits.
1-methylhydantoin; rabbits; growth hormone; growth hormone-releasing hormone; somatostatin; somatostatin analogues;octreotide
时间:2017-3-4 11:50
http://kns.cnki.net/kcms/detail/34.1086.R.20170304.1150.042.html
2016-11-16,
2016-12-17
湖南省自然科学基金资助项目(No 12JJ9030)
龙 飞(1989- ),男,硕士生,住院医师,研究方向:非肽类生长抑素类似物的研发,Tel:0734-8578608,E-mail:984210652@qq.com; 梁庆模(1956- ),男,教授,主任医师,硕士生导师,研究方向:非肽类生长抑素类似物的研发,通讯作者, Tel:0734-8578566,E-mail:642286498@qq.com
10.3969/j.issn.1001-1978.2017.03.021
A
1001-1978(2017)03-0401-06
R-332;R979.1
