上海株犬冠状病毒的分离鉴定及S基因的遗传进化分析
2017-03-16
(山东畜牧兽医职业学院,山东潍坊 261061)
上海株犬冠状病毒的分离鉴定及S基因的遗传进化分析
沈美艳,孙秋艳,李 舫,王彩霞
(山东畜牧兽医职业学院,山东潍坊 261061)
利用A72细胞(犬纤维肉瘤细胞系)从上海市某宠物医院临床表现为急性胃肠炎症状的幼犬腹泻粪便中分离到1株病毒,通过噬斑纯化、病毒理化特性检测以及动物回归实验和RT-PCR鉴定,证明所分离到的病毒为犬冠状病毒(Canine coronavirus,CCV),将其命名为CCV-SHdc株。根据GenBank公布的CCV S基因序列,设计合成4对特异性引物,利用RT-PCR成功扩增获得CCV-SHdc株S基因序列,同时进行序列测定和核苷酸系统发育进化树绘制。结果显示,CCV-SHdc株的S基因序列全长4 364 bp;该毒株与日本分离的CCV 5821株亲缘关系最近,处于同一分支,与意大利分离的CCV 23/03和CCV Elmo/02株亲缘关系较远。核苷酸与氨基酸同源性分析表明,CCV-SHdc株与CCV 23/03和CCV Elmo/02株可能属于不同基因型,已有很多点发生突变,这种突变的累积有可能引起病毒毒力的变化。
犬冠状病毒;分离鉴定;S基因;RT-PCR;遗传进化分析
犬冠状病毒(Canine coroanvires,CCV)是引起犬冠状病毒病的主要病原[1],1971年由Binn等[2]首次从腹泻的德国军犬中分离到,之后世界各地相继有报道[3-5]。CCV可感染不同年龄、性别、品种的犬,但以幼犬发病率最高,狼、大熊猫等其它动物也有易感性[6-8]。CCV主要引起犬的急性胃肠炎,临床上表现为频繁呕吐、腹泻、沉郁、厌食,发病率和死亡率均较高。该病毒既能单独致病,也能与其他病原发生混合感染,是当前对我国养犬业危害较大的病原。CCV具有高传染性,其分离鉴定和早期确诊对该病的预防控制具有重要意义。
CCV是一类有包膜的单股正链RNA病毒,基因组编码4种结构蛋白。其中,纤突蛋白(S)位于病毒最外层,具有严格的细胞感染特异性。S蛋白的N端与宿主细胞表面的受体结合,可使病毒与细胞膜靠近,并参与膜融合。这在病毒侵染细胞的过程中起着至关重要的作用。S蛋白含有的抗原表位是诱导机体产生中和抗体的主要保护性抗原。S蛋白的C端参与病毒粒子的装配及蛋白的胞内运输,并在一定程度上决定病毒的致病性,是CCV致病作用的主要成分。因此研究S基因有利于了解冠状病毒的基因重组、抗原变异、病毒感染细胞机制和基因变化规律。
本研究从上海市某宠物医院临床表现为急性胃肠炎症状的3月龄幼犬腹泻粪便中,通过细胞分离培养,成功分离到1株病毒,并通过病毒理化特性检测、动物回归实验和RT-PCR鉴定,确诊分离的病毒株为CCV。为研究该毒株与其他CCV的亲缘关系,对分离毒株的S基因进行测序,并对分离毒株的遗传进化进行探讨。
1 材料和方法
1.1 细胞及毒株
A72细胞(犬纤维肉瘤细胞系)、MDCK细胞及参考毒株CCV 1-71株,由本实验室保存。
1.2 试剂
病毒RNA提取试剂盒,购自天根生化科技有限公司;AMV第一链cDNA合成试剂盒,购自生工生物工程(上海)股份有限公司;PCR引物,由生工生物工程(上海)股份有限公司合成。
1.3 病毒分离
将采集的粪便用含15%胎牛血清的DMEM培养液1:4稀释,9 000 r/min 离心30 min;用0.22 µm的微孔滤膜过滤上清液,将其接种于长满单层的A72细胞和MDCK细胞;将不出现细胞病变效应(CPE)的病毒连续传7代,如仍不出现CPE则视为阴性;如有CPE,就继续传代,直到CPE稳定;然后进行噬斑试验,纯化病毒。
1.4 噬斑试验
[9]中的方法进行。
1.5 病毒理化特性试验
1.5.1 病毒核酸类型的鉴定。用5-BUDR(5-溴脱氧尿核苷)法进行鉴定[10]。
1.5.2 病毒抵抗力的鉴定。将分离的病毒相应处理后,接种A72细胞,进行耐乙醚、耐氯仿、耐胰酶、耐酸、耐热等试验[10]。
1.6 病毒TCID50的测定
按Reed-Muench法测定病毒的TCID50。
1.7 动物回归试验
取5只3月龄SPF幼犬,随机分成2组(试验组3只、对照组2只)。将CCV-SHdc经口接种试验组幼犬,剂量为10 000 TCID50/只;对照组用同样的方法和剂量接种无菌细胞培养液。观察病毒对幼犬的致病性,同时进行病原分离。
1.8 RT-PCR的鉴定
1.8.1 引 物 合 成。 参 照GenBank编 号 为AY796289.1的CCV S基因的核苷酸序列,设 计1对特 异 性 引 物,Primer(Forward):5'GCAACTAGTTCTGATTTTGTTC 3';Primer(Reverse):5'GCGTTAATTAACCTGCAGGGGCTGTGA 3',由生工生物工程(上海)股份有限公司合成。
1.8.2 RNA的提取。将参考株CCV 1-71、处理后的粪便上清液、第11代细胞培养物、纯化病毒和动物回归试验中的肠道病料,按照病毒RNA提取试剂盒说明书提取RNA。参考株CCV 1-71作为阳性对照。
1.8.3 cDNA的合成。按照AMV第一链cDNA合成试剂盒说明书合成cDNA。
1.8.4 PCR反应。按参考文献[9]中的方法进行。
1.9 CCV-SHdc株S基因遗传进化分析
1.9.1 引物合成。参照GenBank中CCV S基因的核苷酸序列,设计4对引物(表1),由生工生物工程(上海)股份有限公司合成。
1.9.2 RT-PCR扩增。实验方法同1.8。
1.9.3 目的片段回收及测序。用天根公司生产的琼脂糖凝胶回收试剂盒,分别回收纯化病毒的PCR产物,送往上海杰李生物工程技术有限公司进行测序。

表1 CCV S基因的引物设计
1.9.4 S基因序列分析。将得到的4个S基因片段拼接成完整的S基因序列,应用DNAStar软件,将拼接完整的S基因序列与GenBank中登录的9株CCV毒株的完整S基因序列,进行同源性比较,并绘制系统发育进化树。
2 结果
2.1 CCV分离培养
将处理好的病毒液分别接种A72细胞、MDCK细胞,盲传至第7代,24 h后观察到明显的CPE;48 h后,85%的单层细胞脱落,对照细胞正常。MDCK细胞在盲传第7代后仍无病毒生长。
2.2 噬斑试验
CCV-SHdc株在A72细胞上形成的噬斑同参考毒株CCV 1-71形成蚀斑特征相同,蚀斑形态均一,直径在5 mm左右,外形圆而规则(图1)。

图1 CCV 1-71和CCV-SHdc株在A72细胞上形成的噬斑
2.3 病毒理化特性试验
2.3.1 病毒核酸类型。试验组的TCID50为10-5.41/0.1 mL,对照组的TCID50为10-5.57/0.1 mL,二者的TCID50的对数差值小于1,表明5-BUDR不能抑制该病毒的增殖,证明该毒株的核酸类型为RNA。
2.3.2 病毒抵抗力。病毒抵抗力的试验结果表明,分离的病毒株均耐酸、耐胰酶,对乙醚、氯仿、热较敏感,符合RNA病毒的特性。
2.4 病毒TCID50的测定CCV-SHdc第11代培养物的TCID50为10-5.57/0.1 mL。
2.5 动物回归试验
在接种28 h后,试验组幼犬出现精神沉郁、厌食、呕吐、腹泻;接种48 h后,腹泻加重,粪便呈灰白或淡黄色,并带有腥臭气味,体重下降,脱水;第7天,实验组幼犬死亡1只,剖检发现肠管扩张变薄,充满液体,小肠壁变薄,肠黏膜充血、出血,肠系膜淋巴结肿大;第10 天,犬全部死亡,说明分离病毒株的毒力较强。应用RT-PCR方法检测试验组粪便处理液,结果CCV均为阳性,对照组为阴性。
2.6 RT-PCR的鉴定
CCV-SHdc毒株病料处理液、纯化病毒、第11代细胞培养物和动物回归试验中的肠道病料均能扩增出与参考株CCV 1-71相同的553 bp目的片段(图2),从而确定该株病毒为CCV。对照组的犬肠道病料扩增结果为阴性。

图2 RT-PCR鉴定结果
2.7 S基因遗传进化分析
2.7.1 遗传进化分析。将CCV-SHdc株S基因序列与GeneBank中登录的9株CCV毒株(基因登录号分别为CCV1-71:AY 796289.1;CCV-V1:AY390342.1;K378:X77047.1;23/03:AY307021.1;Elmo/02:AY307020.1;5821:AB017789.1;CCV-6:A22882.1;V54:A22886.1;GP:AY436637.1)的相应完整S基因序列,绘制核苷酸系统发育进化树。结果显示,CCV-SHdc株与日本分离的CCV 5821株亲缘关系最近,处于同一分支,与意大利分离的CCV 23/03和CCV Elmo/02株亲缘关系较远(图3)。
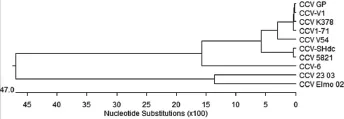
图3 CCV-SHdc分离株S基因进化树分析
2.7.2 核苷酸与氨基酸同源性分析。CCV-SHdc株 与 23/03、5821、Elmo、GP、K378、V54、1-71、CCV-6和CCV-V1株的核苷酸序列同源性分别为38.3%、99.5%、36.4%、90.6%、90.4%、76.6%、90.7%、49.8%和90.6%,氨基酸序列同源性分别为43.7%、98.5%、44.2%、91.9%、91.7%、4.2%、92.3%、6.3%和92.1%(表2)。
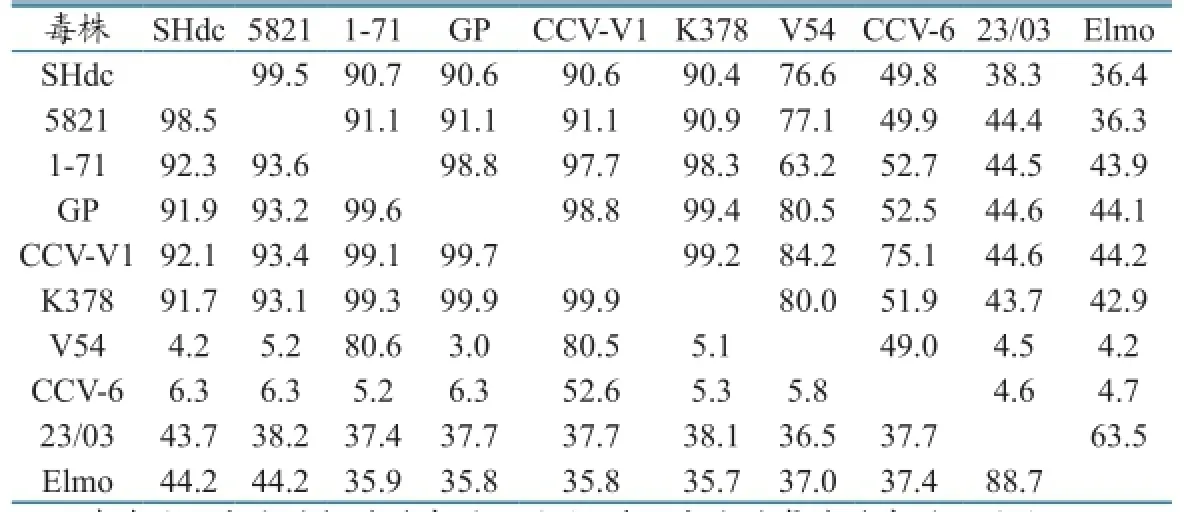
表2 CCV-SHdc株与CCV毒株S基因核苷酸和氨基酸序列的同源性比较
3 讨论
CCV通过其表面纤突和易感细胞表面的特异性受体结合可侵入易感细胞。由于CCV纤突较大,在理化因素的作用下极易脱落,所以本实验在对采集的粪便病料进行初步处理时,采用了含10%胎牛血清的DMEM进行稀释,这样可以提高分离CCV的成功率。Binn等[11]在首次从腹泻的军犬粪便中成功分离到CCV的过程中,采用犬肾原代细胞,并向培养液中添加多聚葡萄糖等营养成分。Keenan等[12]采用同样方法分离获得成功。Binn等[13]建立了对CCV极为敏感的犬纤维瘤传代细胞系,即A72细胞;Carmichael等[13]采用该细胞系相继分离到CCV。
CCV在适应细胞之前,培养很不稳定,也不易产生细胞病变。因此,本实验选择了最为敏感的传代细胞系A72细胞来分离CCV,而且尽可能的盲传多代,直到CPE稳定后,才对病毒进行其它鉴定。初次分离的CCV在MDCK细胞上很难生长,所以A72细胞是分离CCV病毒的最适生长细胞,可对分离到的病毒株做出初步鉴定。由于粪便中病毒种类较杂,TGEV(猪传染性胃肠炎病毒)、FCV(猫冠状病毒)等也能在A72细胞上生长,所以本实验采用噬斑克隆进行病毒纯化。不同病毒在同种细胞上形成的蚀斑特征不一样,同一种病毒在同一种细胞上形成蚀斑特性一般比较稳定,因此根据分离株与CCV参考株相同的噬斑特征,可以提高病毒的检出率。
由于粪便中常存在类似CCV的病毒粒子,因此电镜检查的结果并不理想,所以本实验没有采用电镜,而是通过病毒理化特性进行病毒的形态学鉴定,证实该病毒是一种有囊膜、对热比较敏感的RNA病毒,符合CCV理化特性。为了深入研究分离病毒的致病性,采用动物回归试验,发现攻毒组动物出现特征性的CCV临床症状和病理剖检变化,由此证实分离毒株对犬有致病性,为深入开展该病毒的致病机理奠定了基础。本实验最后采用RT-PCR方法鉴定分离毒株,排除了细小病毒感染的可能,结合序列测定和分析,确证分离的病毒为CCV。
核苷酸系统发育进化树表明,CCV-SHdc株与意大利分离的CCV 23/03和CCV Elmo/02株亲缘关系最远,核苷酸同源性为38.3%和36.4%,氨基酸的同源性为43.7%和44.2%;与5821、GP、K378、1-71和CCV-V1株核苷酸同源性在90.4%~99.5%之间,氨基酸的同源性在91.7%~98.5%之 间。CCV 23/03和CCV Elmo/02株与其他毒株核苷酸同源性分别在36.5%~38.3%和35.8%~38.3%之间,氨基酸的同源性分别在4.5%~44.6%和4.2%~44.4%之间,因此CCV 23/03和CCV Elmo/02株在系统发育进化树上处于独立同一分支。由此说明CCV-SHdc株与CCV 23/03和CCV Elmo/02株可能属于不同的基因型,CCV 23/03和CCV Elmo/02株属于同一基因型。目前CCV仍只有1个基因型,但也曾有新基因型CCVⅠ型存在的报道。CCV-SHdc株与荷兰分离的CCV-6和CCV-V54株核苷酸同源性分别为76.6%和49.8%,氨基酸的同源性分别为4.2%和6.3%,由此说明CCV-SHdc株S基因已有多点发生突变。CCV-6和CCV-V54株都是强毒株,这种突变的累积有可能引起病毒毒力的变化[14]。这个问题有待进一步研究。
参考文献:
[1]张伯强,陆承平,陈怀清. ELISA法检测犬腹泻粪样中的犬冠状病毒[J]. 中国兽医学报,1997,17 (5):437-439.
[2]BINN L N,LAZAR E C,KEENAN K P,et al. Recovery and characterization of a coronavirus from military dogs with diarrhea [J]. Proc Annu Meet US Anim Health Assoc,1974,78:359-366.
[3]TENNANT B J,GASKELL R M,JONES R C,et al. Studies on the epizootiology of canine coronavirus[J].Vet Rec,1993,132:7-11.
[4] PRATELLI A,BUONAVOGLIA D,MARTELLA V,et al. Diagnosis of canine coronavirus infection using nested-PCR[J]. J Virol Meth,2000,84:91-94.
[5]MOCHIZUKI M,SUGIURA R,AKUZAWA M. Microneutralization test with canine coronavirus for detection of coronavirus antibodies in dogs and cats[J]. Jpn J Vet Sci,1987,49:563-565.
[6] WOODS R D,WESLEY R D. Immune response in sows given transmissible gastroenteritis or canine coronavirus[J]. Am J Vet Res,1986,47(6):1239-1242.
[7]何爱华,杜胜芳,林桂华,等. 首次从腹泻熊猫粪便中检出冠状病毒简报[J]. 中国人兽共患病杂志,1998,4(3):4-7.
[8]MAINKA S A,QIU X,HE T,et al. Serologic survey of giant pandas(Ailuropoda melanoleuca) and domestic dogs and cats in the WolongReserve China[J]. Journal Wild Disease,1994,30(1):86-89.
[9]孙秋艳,郭红梅,沈美艳,等. 猪传染性胃肠炎病毒的分离鉴定及S基因进化分析[J]. 动物医学进展,2015,36(7):7-12.
[10] 殷震,刘景. 动物病毒学[M]. 2版. 北京:北京科学出版社,1997.
[11]BINN L N,LAZAR E C,KEENAN K P,et al. Recovery and characterization of coronavirus from military dogs with diarrhea[J].Proceeding of the Annual Meeting of the us Animal Health Association,1974,78:359-366.
[12] KEENAN K P,JERVIS H R,MARCHWICKI R H,et al. Intestinal infection of neonatal dogs with canine coronavirus 1-71:studies by virologic,histochemical and immuno fl uorescent techniques[J].Vet Res,1976,3:274-276.
[13] BINN L N,MARCHWICKI R H,STEPHEHON E H. Establishment of canine cell line:Derivation characterization,and viral spectrum[J].Vet Res,1980,41:855-860.
[14]陈安莉,谢芝勋,刘家波,等. 7株广西鸭源NDV分离株全基因序列测定及遗传进化分析[J]. 中国兽医学报,2013,33(9):1323-1328.
(责任编辑:朱迪国)
Isolation and Identi fi cation of Canine Coronavirus Shanghai Strain and Phylogenetic Analysis of S Gene
Shen Meiyan,Sun Qiuyan,Li Fang,Wang Caixia
(Shandong Vocational Animal Science and Veterinary College,Weifang,Shandong 261061)
A strain of virus was isolated by A72 cells from feces of a diarrhea puppy with clinical manifestation of acute gastroenteritis in a pet clinic in Shanghai city. Through identi fi cation experiments containing plaque puri fi cation,detection of physicochemical properties,animal regression test,and RT-PCR method,the virus strain was con fi rmed as canine coronavirus(CCV)and named CCV-SHdc. Based on the sequence of S gene of CCV published in GenBank,4 pairs of primers were designed to ampli fi ed S gene by RT-PCR. Then sequencing the ampli fi ed gene and drawing a phylogenetic tree. Results indicated that the length of S gene of CCV-SHdc was 4 364 bp. It was closest to strain CCV 5821 that isolated from Japan,belonging to the same one clade,however,it has a farther relationship with CCV 23/03 and CCV Elmo/02 of Italy strain. Analysis of amino acid homology and nucleotide sequence homology indicated genotype of CCV-SHdc strain may be different from strains of CCV 23/03 and CCV Elmo/02. CCV-SHdc strain had multipoint mutation,the accumulation of which would lead to virulence change
canine coronavirus;isolation and identi fi cation;S gene;RT-PCR;phylogenetic analysis
S852.65
B
1005-944X(2017)03-0097-05
10.3969/j.issn.1005-944X.2017.03.025
山东省潍坊市科学技术发展计划(2015GX054)
李 舫
