猪伪狂犬病毒纳米PCR检测方法的建立
2017-03-16张悦勇南文龙秦立得巩明霞吴发兴陈义平
张悦勇,南文龙,秦立得,巩明霞,吴发兴,单 虎,陈义平
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.青岛农业大学,山东青岛 266109)
猪伪狂犬病毒纳米PCR检测方法的建立
张悦勇1,2,南文龙1,秦立得1,巩明霞1,吴发兴1,单 虎2,陈义平1
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.青岛农业大学,山东青岛 266109)
[目的]快速灵敏检测猪伪狂犬病毒(PRV)[方法]根据PRV gB基因设计特异性引物,建立了PRV纳米PCR检测方法。[结果]PRV纳米PCR方法的最低检出限为10 拷贝/µL,其敏感性比未添加纳米金的对照PCR提高100倍;建立的纳米PCR与猪细小病毒、猪圆环病毒Ⅱ型、猪繁殖与呼吸综合征病毒等常见猪病毒性病原均无交叉反应。应用纳米PCR和PRV国家标准中的PCR方法,对2014—2016年期间采集自17个省市发病猪场的148份临床样品进行平行检测,PRV纳米PCR的阳性检出率为49.3%(73/148),PRV国标PCR方法的阳性检出率为23.6%(35/148),并且PRV纳米PCR检测为阳性,而PRV国标PCR方法检测为阴性的38份样品,测序结果均确认为PRV阳性。[结论]本研究建立的纳米PCR检测方法敏感特异,可用于猪伪狂犬病的病原学检测。
猪伪狂犬病毒;纳米PCR;gB基因
猪伪狂犬病毒(Pseudorabies virus,PRV)是常见的引起猪繁殖障碍性疾病的病原,可引起母猪流产、不孕,产死胎、畸形胎、木乃伊胎及弱胎等。同时,还能使仔猪出现神经症状、严重的呼吸道症状,甚至死亡。PRV在我国猪群中广泛存在,对我国养猪业造成较大的经济损失。建立快速、敏感的PRV检测方法,对该病的防控具有重要意义。常规的病毒分离鉴定方法,虽然准确,但费时费力[1]。PCR方法操作简单,检测快速,已成为PRV检测的常用方法之一。为了提高常规PCR方法的敏感性,本研究拟建立敏感、特异的PRV纳米PCR检测方法。
1 材料与方法
1.1 病毒与临床样品
PRV、猪细小病毒(PPV)、猪圆环病毒Ⅱ型(PCV2)、猪繁殖与呼吸综合征病毒(PRRSV)、古典猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)核酸、H1亚型猪流感病毒(SIV-H1)核酸、H3亚型猪流感病毒(SIV-H3)核酸,均由本实验室保存;148份临床疑似PRV感染的组织样品,主要包括脑、淋巴结、脾等组织,于2014—2016年期间采集于山东、河南、黑龙江等17个省(市)的发病种猪场。
1.2 主要试剂
NanoPCR试剂盒,购自大正医疗器械股份有限公司;Taq DNA Polymerase、2×GC BufferⅡ、dNTPs、DL2000 DNA Marker、pMD18-T载体、Reverse Transcriptase M-MLV(RNase H-)、Oligo(dT)购自TaKaRa公司;DNA提取试剂盒,购自QIAGEN 公司;RNA提取试剂盒购自Roche公司。
1.3 引物设计
比对Genbank上发表的PRV gB基因,选取基因保守区域,应用Primer premier 5.0软件设计1对PRV检测引物,由Takara公司合成(表1)。
1.4 标准阳性质粒的制备
按照DNA提取试剂盒说明书方法提取PRV细胞培养物DNA,以其为模板用表1中的引物进行扩增,PCR产物经纯化后克隆于pMD18-T载体中,构建重组质粒pMD-gB,测序正确后作为标准阳性质粒模板。
1.5 PRV纳米PCR的建立及条件优化
参照NanoPCR试剂盒说明书的方法,将纳米PCR反应体系预设定为:2×Nano Buffer 12.5 µL,gB-F/gB-R(20 µmol/L)各0.5 µL,Taq酶(5 U/µL)0.5 µL,pMD18-gB标准阳性质粒模板2 µL,灭菌水补至25 µL。将不添加纳米金的对照PCR反应体系预设定为:2×GC BufferⅡ 12.5 µL,dNTPs 2 µL,gB-F/gB-R(20 µmol/L)各0.5 µL,Taq 酶(5 U/µL)0.5 µL,pMD18-gB标准阳性质粒模板2 µL,灭菌水补至25 µL。纳米PCR和对照PCR的反应条件,均预设定为94 ℃ 5 min;94 ℃ 45 s,60 ℃ 45 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。
保持预设的其他反应体系指标条件不变,优化纳米PCR退火温度,设定为54~64 ℃,间隔2 ℃。之后,再优化其反应体系组分用量:Buffer体积9.5 ~14.5 µL,间隔1 µL;酶(5 U/µL)体积0.2 ~0.7 µL,间隔0.1 µL;引物(20 µmol/L)体积从0.1 ~1.1 µL进行优化,间隔0.2 µL。
1.6 敏感性试验
使用Qubit 2.0分别测定标准阳性质粒模板的浓度后,进行10倍倍比稀释,选择10-1~10-8作为浓度梯度模板标准品,灭菌水作为阴性对照,应用PRV纳米PCR和对照PCR进行检测,比较二者检测敏感性差异。
1.7 特异性试验
参照DNA提取试剂盒说明书方法,提取PPV和PCV2病毒液的DNA作为模板;参照RNA提取试剂盒说明书方法,提取PRRSV、CSFV病毒液的RNA,对PEDV、SIV-H1亚型及SIV-H3亚型的核酸,按M-MLV说明书方法,应用Oligo(dT)进行反转录,将反转录的cDNA作为模板。应用所建立的纳米PCR方法检测上述模板,确定纳米PCR方法的特异性。
1.8 临床样品的检测
将148份临床样品分别剪碎、研磨,参照DNA提取试剂盒说明书提取DNA,分别用所建立的PRV纳米PCR和PRV国标中的PCR检测方法[2]平行检测,比较检测结果。
2 结果
2.1 目的基因的扩增结果
对PRV细胞培养物DNA进行PCR扩增,扩增出了1条与预期的338bp大小一致的特异性片段(图1)。
2.2 PRV纳米PCR 的建立及条件优化
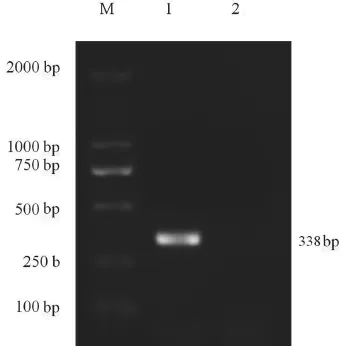
图1 PRV纳米PCR扩增结果
通过对纳米PCR 反应的退火温度、2×Nano Buffer浓度、引物浓度及Taq聚合酶浓度进行优化,最终确定PRV纳米PCR的最佳反应体系为2×Nano Buffer 12.5 µL,gB-F/gB-R (20 µmol/L)各0.5 µL ,Taq 酶(5 U/µL) 0.5 µL,DNA 模板4 µL,灭菌水补至25 µL;最佳反应条件为94 ℃ 5 min,94 ℃ 45 s、58 ℃ 45 s、72 ℃ 45 s,40个循环,72 ℃ 10 min。对照PCR 最佳反体系参考预设,反应条件同纳米PCR一致。
2.3 敏感性试验结果
将重组质粒模板进行10倍梯度稀释后,得到浓度梯度模板标准品(1.0×101~ 1×109拷贝/µL)。结果显示,PRV纳米PCR 方法最低检出限为1.0×101拷贝/µL(图2A),PRV对照PCR的最低检出限为1.0×103拷贝/µL(图2B),PRV纳米PCR方法的敏感性比未添加纳米金的对照PCR提高100倍。
2.4 特异性试验结果
应用所建立的PRV纳米PCR分别检测PRV、PPV、PCV2、PRRSV、CSFV、PEDV、SIV-H1及SIV-H3的DNA 或cDNA模板。只有检测PRV的DNA模板时出现特异性扩增条带,其他7种病原检测均无扩增条带出现(图3),这表明该纳米PCR具有良好的特异性,与常见猪病毒性病原无交叉反应。

图3 PRV纳米PCR 的特异性试验
2.5 临床样品的检测
对148份临床样品进行检测,PRV纳米PCR的阳性率检出为49.3%(73/148),PRV国标PCR方法的阳性检出率23.6%(35/148)。PRV国标PCR检测为阳性的样品,经纳米PCR检测均为阳性;PRV纳米PCR检测为阳性,而PRV国标PCR方法检测为阴性的38份样品,经测序鉴定,结果均确认为PRV阳性。
3 讨论
纳米技术是近年来的研究热点,2012年以来,国内外学者先后将其用于鱼溶藻弧菌病、非洲猪瘟病毒病、猪细小病毒病、猪博卡病毒病、猪伪狂犬病毒病及猪流行性腹泻病毒病等动物疫病的检测[2-8]。
由于PRV的DNA G+C含量高,高达74%,引物的Tm值很高[9],采用常规PCR方法扩增PRV DNA可能会对检测的敏感性产生影响。纳米PCR是一种新型PCR技术,该方法在PCR反应体系中加入1~100 nm的纳米金粒子,PCR反应温度变化过程中,纳米粒子在反应液体中形成纳米流体,提高反应的导热性,提高升温和降温的速度,减少在非目的温度停留的时间,提高引物与模板的配对效率,从而提高PCR反应的特异性和敏感性,减少退火温度对PCR 反应的影响[10-12]。
本研究通过比对Genbank上PRV及其变异株的序列,针对PRV gB基因的保守区域设计了一对目的片段长度为338 bp的特异性引物,经反应体系和反应条件的优化,建立了敏感、特异的PRV纳米PCR检测方法。敏感性试验表明PRV纳米PCR方法可显著提高PCR反应的敏感性,最低检出限为10拷贝/µL,比不添加纳米金的常规PCR方法(最低检出限为1.0×103拷贝/µL)敏感性提高100倍,与Ma Xingjie等[5]的报道一致。同时,本研究还使用PRV细胞培养病毒DNA模板进行了测试,纳米PCR最低检出限约为50个TCID50/0.1mL。本方法具有良好的特异性,与猪细小病毒、猪圆环病毒Ⅱ型、猪繁殖与呼吸综合征病毒、经典猪瘟病毒、H1亚型猪流感病毒及H3亚型猪流感病毒等7种常见猪病毒性病原无交叉反应。
应用建立的PRV纳米PCR检测方法和PRV国标PCR方法对2014—2016年期间采集于我国不同地区发病猪场的148份临床样品进行平行检测,PRV纳米PCR的阳性检出率为49.3%,PRV国标PCR方法的阳性检出率为23.6%。与现行PRV国标PCR方法相比,纳米PCR对PRV的检测具有更高的阳性检出率,经测试其敏感性约为国标方法的100倍。
[1] 曲光刚,沈志强,管宇,等. PPV、PRV双重PCR 检测方法的建立及其应用[J]. 中国动物检疫,2007,24(11):22-23.
[2] 农业部.猪伪狂犬诊断技术中的聚合酶链反应检测方法:GB/T 18641-2002 [S]. 北京:中国标准出版社,2002.
[3] 刘阳,孔繁德,彭小莉,等. 纳米PCR技术检测溶藻弧菌的建立与初步应用[J]. 中国动物检疫,2012,29(03):34-37.
[4] 崔尚金,胡泉博,刘业兵. 非洲猪瘟病毒高效纳米PCR检测方法的建立及初步应用[J]. 中国预防兽医学报,2012(10):807-809.
[5] MA X J,CUI Y,QIU Z,et al. A nanoparticle-assisted PCR assay to improve the sensitivity for rapid detection and differentiation of wild-type pseudorabies virus and gene-deleted vaccine strains[J]. J Virol Methods,2013,193(2):374-378.
[6] CUI Y,WANG Z,MA X,et al. A sensitive and speci fi c nanoparticle-assisted PCR assay for rapid detection of porcine parvovirus[J]. Lett Appl Microbiol,2014,58(2):163-167.
[7] WANG X,BAI A,ZHANG J,et al. A new nanoPCR molecular assay for detection of porcine bocavirus[J]. J Virol Methods,2014,202:106-111.
[8] YUAN W,LI Y,LI P,et al. Development of a nanoparticleassisted PCR assay for detection of porcine epidemic diarrhea virus[J]. J Virol Methods,2015,220:18-20.
[9] LI M,LIN Y C,WU C C,et al. Enhancing the ef fi ciency of a PCR using gold nanoparticles[J]. Nucleic Acids Res,2005,33(21):e184.
[10] 崔宇超,彭永刚,马兴杰,等. 猪细小病毒高效纳米PCR 检测方法的建立[J]. 中国预防兽医学报,2014,36(4):286-288.
[11] 李海阔. 基于纳米金粒子的PCR 方法研究[D]. 上海:上海交通大学,2009.
(责任编辑:孙荣钊)
A NanoPCR Assay for Detection of Pseudorabies Virus
Zhang Yueyong1,2,Nan Wenlong1,Qin Lide1,Gong Mingxia1,Wu Faxing1,Shan Hu2,Chen Yiping1
(1. China Animal Health and Epidemiology Center,Qingdao,Shandong 266032;2. Qingdao Agricultural University,Qingdao;Shandong 266109)
[Objective]In order to develop a rapid and sensitive method for detecting Pseudorabies virus (PRV). [Methods]A nanoPCR assay for detection of PRV was developed with a pair of speci fi c primers that were designed based on sequence of gB gene.[Results]Results showed the detection limit of this assay was 10 copies/µL,sensitivity of which was 100 times higher than conventional PCR assay that no gold nanoparticle was added. Good speci fi city was also identi fi ed that there was no cross reaction with other common viral pathogens of swine such as porcine parvovirus(PPV),porcine circovirus type 2(PCV2),porcine reproductive and respiratory syndrome virus (PRRSV). Using PRV nanoPCR and national standard PCR test of gB gene,148 clinical samples collected from 17 different areas during 2014-2016 were conducted parallel detection. The positive rates by nanoPCR and national standard PRV were 43.5%(73/148)and 27.2%(35/148). 38 samples tested negative by national standard PRV presented a positive result when using the method of nanoPCR,which were consistent with DNA sequencing.[Conclusion]The established PRV nanoPCR method was applicable for pathogenic detection of PRV due to its high sensitivity and good speci fi city.
Pseudorabies virus;nanoPCR;gB gene;detection
S852.651
B
1005-944X(2017)03-0102-04
10.3969/j.issn.1005-944X.2017.03.026
科技部国家重点研发计划(2016YFD0501501)
