紫薯花青素提取及其稳定性的研究
2017-03-15娄文娟河南科技学院河南新乡453003
娄文娟 孔 瑾(河南科技学院,河南 新乡 453003)
紫薯花青素提取及其稳定性的研究
娄文娟 孔 瑾
(河南科技学院,河南 新乡 453003)
花青素在蔬菜水果中广泛存在,是一种天然生成的色素。本试验主要应用单因素及正交试验研究了花青素的提取工艺以及花青素在光照和酸碱条件下的稳定性。结果表明:花青素的最佳提取参数组合为料液比为1∶65,0.5%柠檬酸与95%乙醇的体积比为40∶60,水浴浸提时间为3h。花青素在常温条件下,光照4h,损失率为25%;在pH为0.5~5范围时,花青素的损失率不明显,随着pH的升高,花青素含量急剧降低。
紫薯;粉碎;浸提;稳定性
花青素(anthocyanin),具有水溶性,多存在于深色水果与蔬菜之中,是一种纯天然的色素[1]。花青素是一种可以去除人体内自由基的抗氧化剂,可以保护血管,保护人体内的各个血管的各种生理机能,使人免受心脑血管的威胁[2-3];能够保护人的大脑,防止自由基对人大脑产生伤害,改善退化性老年痴呆综合征;可以避免人体内的基因由于各种外在因素而引起的基因突变,从而可以有效地预防癌症等疾病[4];可以让眼睛中的视紫质再生,保护人的眼睛,也可以被用来做化妆品,让皮肤保持弹性,减少皱纹等皮肤问题的产生[5]。因此它被广泛运用于食品的着色,化妆品的制作,医药的生产等方面。但由于花青素容易受到pH、氧化剂、酶类、金属离子、温度、光照等因素的影响,花青素的应用成了一个难题[6]。目前,很多人工合成食品着色剂都有不同程度的毒性,长期食用会使人患上癌症等其他各种疾病,如何获取纯天然、对人体没有危害的色素就成了一个备受关注的课题,因此对较高纯度花青素提取的研究是有必要的。
1 材料与方法
1.1 材料
1.1.1 紫薯
本实验用紫薯,全部由易购超市购买的普通紫薯。
1.1.2 主要试剂
花青素标样,正丁醇,甲醇,硫酸铁铵,盐酸,柠檬酸(莒县宏德柠檬酸厂),无水乙醇(齐鲁石化有限公司),氢氧化钠(杭州天威工贸有限公司),超纯水(实验室自制),磷酸氢二钠(吴江市杏雄金属化工有限公司)等。
1.1.3 主要仪器
电热鼓风干燥箱 HG101-5型(南京索特烘箱制造有限公司),粉碎机(陶乐TL-0302型),40目筛子(金源304不锈钢),恒温水浴锅HHS21-4型(上海丙林电子科技有限公司),低速离心机SC-3610型(湖南恒诺仪器有限公司),721G可见光分光光度计(深圳市鼎鑫宜实验设备有限公司),pH计(力辰pH-10型),电子天平JY-2502型(梅特勒托利多仪器有限公司),冰箱BCD-216T(青岛海尔股份有限公司)。
1.2 方法
1.2.1 花青素的提取流程
紫薯干粉→水浴浸提→离心→取上清液→过滤→花青素原液[7]
1.2.2 样品处理
将紫薯清洗干净、沥干之后切成2mm左右薄片,置于电热鼓风干燥机中,以60℃的温度干燥,直至质量不再发生变化,再用粉碎机粉碎,过40目筛子,反复打磨,可以得到紫薯干粉,将所得干粉装入棕色试剂瓶中,置于冰箱中以5℃的温度进行储存[8]。
1.2.3 浸提方法(柠檬酸-乙醇)[9]
分别配置0.5%柠檬酸溶液500mL,95%乙醇溶液500mL,之后取出1g紫薯干粉,加入柠檬酸酸化乙醇提取液,再进行恒温水浴浸提,取出浸提所得溶液之后,在离心机中以3 500r/min的速度进行离心,取上清液,进行过滤,就可以得到澄清的紫薯花青素原液。
1.2.4 花青素含量检测[10]
由文献可知,花青素的吸光度为520nm~530nm之间,本实验选取523nm处检测花青素原液的吸光度。
1.2.5 标准曲线的绘制
准确配制质量浓度为0.50mg/mL的花青素标准溶液,分别吸取0mL、0.1mL、0.2mL、0.3mL、0.4mL、0.5mL置于6支10mL具塞比色管中,各加入甲醇溶液至1mL,加入6.0mL正丁醇—盐酸溶液(体积比为95∶5)和0.2mL质量分数为2%的硫酸铁铵溶液(临用时配制),摇匀后,置沸水浴中加热40min,然后迅速冷却,在波长400~600nm处进行扫描,确定其最大吸收波长523nm,于最大吸收波长处测定花青素标准溶液吸光度,得到标准曲线方程。
1.2.6 花青素稳定性[12-13]
调节花青素溶液的pH为2,在室温条件下,分别测定花青素在正常光照和避光条件下花青素的损失率,调节pH为1、3、5、7、9、11,1h后,分别测定测定花青素的含量,从而来探究对于花青素在不同酸碱度下的保存情况。
2 结果与分析
2.1 紫薯花青素提取的影响因素
2.1.1 酸醇比对花青素提取效果的影响
设定水浴浸提时间为2h,浸提温度为60℃,料液比1∶50,分别选取柠檬酸溶液与乙醇溶液的体积比为20∶80, 30∶70, 40∶60, 50∶50, 60∶40五个水平,进行单因素试验,每组样品平行测定三次,取平均值,计算花青素含量,可得试验结果如图1所示:
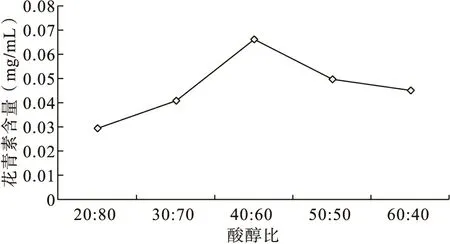
图1 不同酸醇比对花青素提取效果的影响
由图1可知,随着柠檬酸的添加量持续加大,花青素的提取率先升高后降低;当酸醇体积比为40∶60时,花青素的提取率达到最高。说明适当的酸醇比有利于花青素的提取,酸醇比过大或者过小,都会对花青素的浸提效果有所影响。这是由于乙醇的浓度过大时,会破坏花青素的内部结构,导致提取效果差。
2.1.2 提取时间对花青素提取效果的影响
设定酸醇混合溶液体积比50∶50,料液体比1∶50,提取温度为60℃,当提取时间分别为1h、1.5h、2h、2.5h、3h时,测定花青素含量,每组样品平行测定三次,取其平均值,试验结果如图2所示:
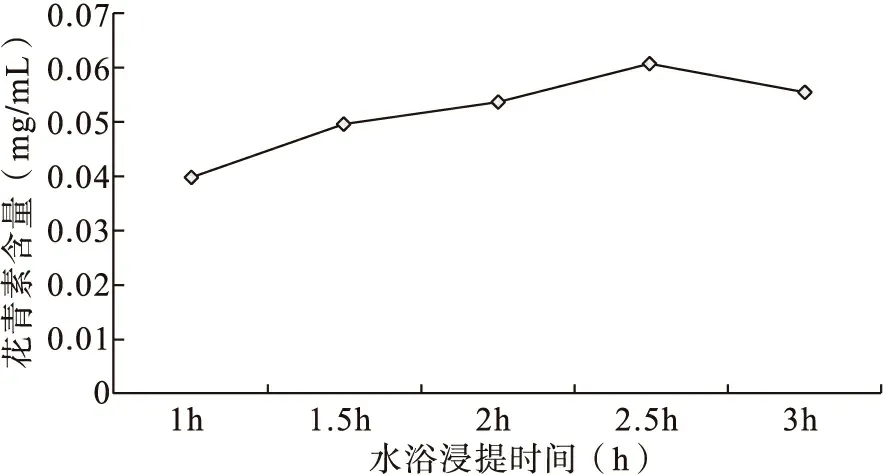
图2 不同提取时间对花青素提取效果的影响
由图2可知,在提取时间为3h范围内时,随着提取时间的延长,花青素的提取率先升高后降低,提取时间为2.5h时,花青素的提取效果达到最好,可能是由于加热的时间过长,造成花青素的分解,导致花青素的提取率下降。
2.1.3 料液比对花青素提取效果的影响[11]
设定酸醇体积比50∶50,水浴浸提温度60℃,浸提时间2h,取料液比分别为1∶25、1∶35、1∶45、1∶55、1∶65,测定样品中花青素含量,每组样品平行测定三次,取其平均值,可得试验结果如图3所示:

图3 不同料液比对花青素提取效果的影响
由图3可知,随着紫薯物料浓度的增大,花青素提取率先增大后减小,当料液比为1∶55时,花青素提取率达到最大,当紫薯物料浓度过高时,溶液黏度过大,不利于后续工序的进行,当物料浓度过低时,溶液过稀,导致提取率降低。
2.2 正交试验
2.2.1 正交试验各因素水平
依据单因素实验结果设计正交试验,设定提取温度为固定条件,选取酸醇体积比,提取时间(h),料液比为试验因子,根据正交表设计实验,以确定花青素提取的最佳条件组合,正交试验设计如表1所示:
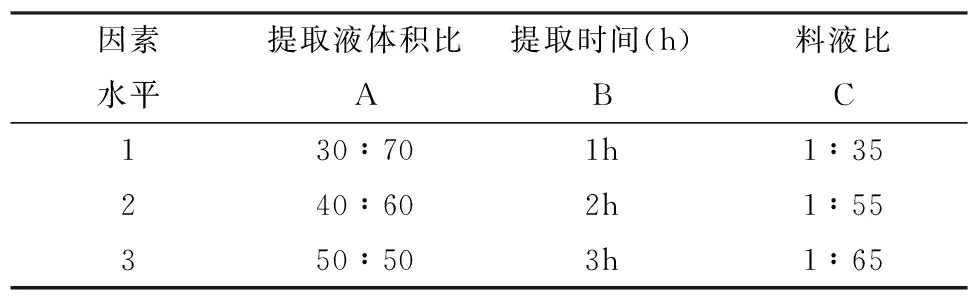
表1 花青素提取影响因素水平表
2.2.2 正交试验结果
正交试验结果如表2所示:

表2 正交试验设计表及结果
由表2中的极差可知,酸醇比、提取时间、料液比对于花青素提取效果的影响程度为:提取时间>酸醇比>料液比,提取时间对提取效果的影响程度远远超过了其他两个因素。由对K值的分析可知,浸提的最优因素水平分别为:提取液酸醇比为40∶60,水浴加热浸提时间为3h,料液比1∶65,为最优因素水平,所以最佳提取方案为:A2B3C3。
正交试验验证:由正交表可知,正交试验中并没有A2B3C3的情况,所以再对A2B3C3的因素水平下进行试验,测得综合了这三个因素水平的情况下的所得花青素含量为0.068mg/mL,所得的试验结果符合正交试验的结论。
2.3 花青素稳定性的研究
2.3.1 光照对花青素稳定性的影响
结果如图4所示:
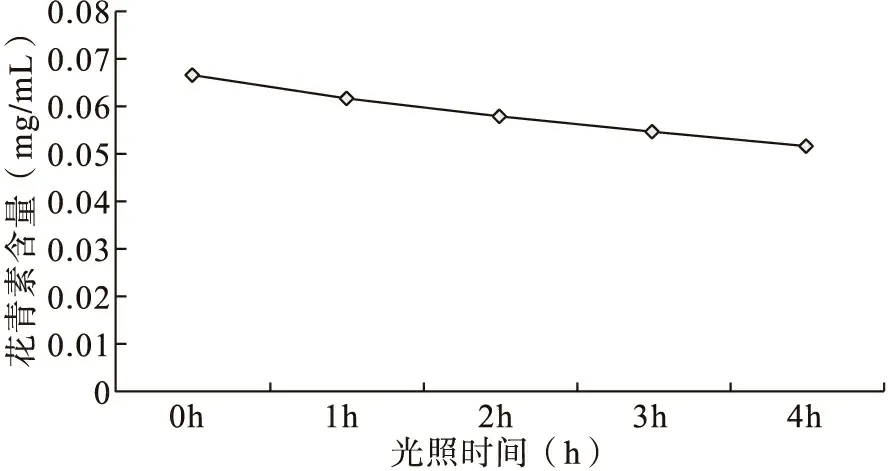
图4 花青素在光照情况下的保存情况
花青素在避光情况下的保存情况,如图5所示:
图5 花青素避光保存的保存情况
由图4-5可知,当存放时间为4h以内,随着存放时间的延长,正常光照条件下花青素的含量迅速下降,当光照时间为4h时,花青素的损失率高达25%,而避光保存条件下花青素损失率为10.12%,故选择避光保存花青素。
2.3.2 花青素在不同酸碱条件下的保存情况
结果如图6:

图6 花青素在不同酸碱条件下的保存情况
由图6可知,在pH为1~5范围时,花青素的保存率下降并不明显,随着pH的继续升高,花青素的损失率急剧增大,当pH为11时,花青素的损失率高达84.6%,这说明花青素在碱性条件下迅速分解。
3 结论
花青素的最优提取条件组合为酸醇体积比为40∶60,水浴浸提时间为3h,料液比为1∶65,花青素在常温条件下,光照4h,损失率为25%;在pH为0.5~5范围,花青素的损失率不明显,当pH为11时,花青素的损失率高达84.6%。
[1]安军,安秀香,周斌. 巧用牵牛花观察酸碱度对花青素颜色的影响[J]. 生物学通报,2004,39(1):49-49.
[2]钱岳晟. 花青素的保健功效[J]. 养生保健指南(上),2015(4):74-74.
[3]叶丹. 有益健康的花青素[J]. 科普天地, 2015(4):4.
[4]汪慧华,赵晨霞.花青素结构性质及稳定性影响因素研究进展[J].农业工程技术:产品加工业,2009(9):32-35.
[5]王敬勉,廖德胜,栗巧功.火棘色素的化学成分及性能研究[J].食品科学, 1992(8):4-6.
[6]Tsuda T. Dietary anthocyanin-rich plants:Biochemical basis and recent progress in health benefits studies[J]. Mol Nutr Food Res, 2012( 56):159-170.
[7]徐博. 紫甘薯花青素的提取纯化工艺[J].才智,2013(18):183-183.
[8]阳翠,秦廷豪,李晓梅,等. 紫甘薯花青素提取工艺参数优化[J]. 西南师范大学学报(自然科学版),2013,38(7):69-72.
[9]陈炼红,伍红,李明珠. 紫薯花青素提取工艺优化研究[J].西南民族大学学报(自然科学版),2012,38(3):396-400.
[10]Petr I G,Krawczyk U,Kery A. Spectrophotometric and Chromatographic Investigation of Bilberry Anthocyanins for Quantification Purposes[J]. Microchemical Journal, 1997, 55 (1):12-23.
[11]秦紫馨,刘芳.紫薯花青素的提取优化及稳定性分析[J]. 广州化工,2013,41(21):66-68.
[12]陈新,周宏,薛蒙伟. 紫甘薯中花青素提取工艺及测定方法研究[J]. 南京晓庄学院学报,2010,26(6):57-61.
[13]左玉,田芳.花青素稳定性研究进展[J].粮食与油脂,2014(7):1-5.
On the Extraction and Stability of Anthocyanin from Purple Sweet Potatoes
LOU Wenjuan KONG Jin
(He’nan Institute of Science and Technology, Xinxiang 453003, Henan, China)
Anthocyanins, a natural pigment, exist widely in fruits and vegetables. Employing single-factor and orthogonal tests, this paper analyzes the extraction of anthocyanin and its stability in terms of illumination and different pH conditions. According to the experiments, the optimum conditions for anthocyanins extraction are that the ration of solid to liquid is 1 to 65, that the volume ratio of 0.5% citric acid to 95% ethanol is 40∶60, and that the extraction time was 3h. In room temperature, anthocyanin loss ratio is 25% under four hours’ illumination, its loss is not obvious when pH ranges from 0.5 to 5, and it suffers dramatic loss as pH values continue to rise.
purple sweet potatoes; comminution; extraction; stability
娄文娟(1989—),女,河南通许人,河南科技学院助理实验师,主要从事功能性食品与食品安全性的教学与研究。 孔瑾(1957—),男,河南太康人,河南科技学院高级实验师,主要从事农副产品加工的教学与研究。
TS972
A
2095-7211(2017)02-0020-03
