磁共振表观扩散系数对肝转移瘤化疗效果的预测价值
2017-03-15王建辉王明文
王建辉, 王明文, 万 华, 王 磊
(1. 辽宁省营口开发区中心医院 磁共振科, 辽宁 营口, 115007;2. 河北医科大学, 河北 石家庄, 050017)
磁共振表观扩散系数对肝转移瘤化疗效果的预测价值
王建辉1, 王明文1, 万 华1, 王 磊2
(1. 辽宁省营口开发区中心医院 磁共振科, 辽宁 营口, 115007;2. 河北医科大学, 河北 石家庄, 050017)
目的 探讨磁共振弥散加权成像(DWI)表观扩散系数(ADC)对肝转移瘤化疗疗效的预测价值。方法 选取本院就诊的胃肠道癌发生肝脏转移的患者80例(转移病灶148个),比较治疗前、治疗后2周和12周转移瘤最大直径,根据治疗后12周肿瘤最大直径变化分为有效组及无效组。比较有效组及无效组治疗前、治疗后2周和12周的ADC值。分析ADC值与肿瘤直径的相关性。利用ROC曲线分析治疗前ADC值和治疗后2周ADC变化率用于预测患者对化疗的效果。结果 治疗前,有效组病灶的ADC值平均值显著低于无效组(P=0.002); 在肿瘤ADC值的变化上,化疗2周、12周后,有效组的ADC较化疗前均显著上升,而化疗无效组的ADC则无显著变化; 治疗前ADC与肿瘤的直径变化呈现负相关(r=-0.662,P=0.000); 治疗后2周ADC变化率与肿瘤的直径变化也呈现负相关关系(r=-0.846,P=0.000)。ROC曲线结果表明,以治疗前ADC值预测转移瘤化疗效果的AUC为0.914; 治疗后2周ADC变化率预测转移瘤的AUC为0.893; 二者联用时对于转移瘤化疗评估的AUC为0.959。结论 化疗前ADC值、治疗后2周ADC值的变化率以及二者联用在胃肠道癌肝转移化疗疗效预测上有较高的临床应用价值。
表观扩散系数; 化疗; 肝脏转移瘤; 磁共振
肿瘤的侵袭和转移是肿瘤发生和发展过程中最危险的阶段,由于肝脏双重血供和肝窦上皮细胞间隙等特点,肿瘤细胞易于侵入肝实质,发生肝转移。在恶性肿瘤的发展过程中有25%~50%的原发性恶性肿瘤转移至肝脏,其中又以消化道肿瘤居多[1-2]。目前手术切除是治疗肿瘤的主要手段,但单纯手术切除的生存率较低[3-4], 易发生侵袭和转移[5]。且发生肝脏转移的患者不适合手术治疗,因此针对这些患者化疗是最主要的治疗方法,可以提高患者的生存率并有机会让患者能够适合手术[6-7]。临床上对于化疗疗效的监测主要通过CT/MRI等影像学方法测量肿瘤的大小,然而影像学成像方法测量肿瘤大小的改变往往晚于功能改变,因此难以用于早期化疗疗效的预测。弥散加权成像(DWI)是近年来发现的磁共振功能检查方法,而表观扩散系数(ADC)可以对DWI信号强度进行准确的量化,使之有望能够在肿瘤大小发生明显改变之前评价化疗疗效。DWI作为一种新的评估肿瘤治疗疗效的方法虽然已经开始在临床应用[8], 但对其研究还较少,其对化疗治疗疗效的预测效果尚不明确。本研究探讨治疗早期ADC值以及治疗后2周ADC值的变化率是否可以作为肝转移瘤患者远期化疗结果进行预测,现报告如下。
1 材料与方法
1.1 一般资料
选取2013年1月—2016年1月在本院进行治疗的胃肠道癌肝脏转移患者80例,其中男46例,女34例,年龄40~70岁,平均55.7±6.8岁。所有80例患者中胃癌患者有28例(52个转移病灶),结直肠癌52例(96个转移病灶),共148个转移病灶纳入本研究。
1.2 检查方法
采用美国GE1.5T HDX超导磁共振进行检测,患者采取仰卧位使上腹部位于线圈内部。患者按照医生引导均匀呼吸,定位线至于剑突水平。常规检查包括呼吸门控压脂轴位T2W1和轴位T1W1, 冠状位T2W1和弥散加权成像(DWI)及增强扫描。所有图像生成后传输至处理工作站, ADC图自动由其软件生成。对DWI扫描结果进行分析生成ADC值,由2名医师在未知化疗情况下阅片,并进行评估。
1.3 治疗方案
所有入选患者均采取化学治疗,具体方案(LV5FU2方案)如下; CF 200 mg/m2静推,第1、2天; 5-FU 400 mg/m2静推,第1、2天; 5-FU 600 mg/m2静推,第1、2天,每2周重复1次。
1.4 肿瘤化疗疗效的评估
以化疗12周后肿瘤大小(最大直径)为结果,且测量在治疗结束1周内完成。病灶消失或最大直径之和减少>30%为化疗有效,否则为无效。
1.5 观察指标
分别测量治疗前、治疗后2周和治疗后12周转移瘤最大直径,根据治疗后12周肿瘤最大直径,分为有效组及无效组。分别检测并比较有效组及无效组治疗前、治疗后2周和治疗后12周的ADC值。
1.6 统计学分析
采用SPSS16.0软件进行统计学分析,各实验数据以均数±标准差表示,两组间差异采用t检验进行分析。采用Pearson相关性分析,对ADC值变化与转移瘤直径变化之间的相关性做出分析。采用ROC曲线分析治疗前ADC以及治疗后2周ADC变化率用于预测转移瘤对化疗疗效的预测价值。P<0.05为差异有统计学意义。
2 结 果
2.1 有效及无效组一般临床资料的比较
在80例胃肠道癌患者的148的转移病灶中,发生于肝左叶的病灶有26个(17.5%), 肝右叶的病灶有122个(82.4%)。其中化疗后有效的病灶有65个(43.9%), 无效的病灶有83个(56.1%)。化疗有效组平均年龄为56.3±6.2岁,化疗无效组患者的平均年龄为57.9±6.4岁,两者比较无显著差异(P>0.05)。化疗前2组肿瘤最大直径均无显著差异(P>0.05); 化疗2周后,有效组的肿瘤直径小于无效组,但差异无统计学意义(P>0.05); 而化疗12周后,有效组肿瘤最大直径显著小于无效组(P<0.05), 见表1。

表1 化疗有效及无效组治疗前后肿瘤最大直径的比较
与有效组比较, *P<0.05。
2.2 有效组和无效组ADC值的变化
治疗前,无效组ADC值显著高于有效组(P<0.05); 治疗2周和12周后,有效组ADC值显著升高,无效组无显著差异。有效组治疗后2周和12周的ADC值增加值百分比分别为6.08%和20.0%, 而无效组无明显变化。见表2。

表2 化疗有效组和无效组治疗前后ADC值变化 ×10-3mm2/s
与治疗前比较, *P<0.05; 与无效组比较, #P<0.05。
2.3 ADC值与肿瘤直径变化的关系
采用Pearson相关性分析,选择治疗前以及治疗后2周这两个具有潜在诊断价值的时间点,对其与肿瘤直径变化的相关性分析,治疗前ADC与肿瘤的直径变化呈现负相关(r=-0.662,P=0.000); 治疗后2周ADC增加率与肿瘤的直径变化也呈现负相关关系(r=-0.846,P=0.000)。见表3、图1、图2。
2.4 治疗前ADC值、治疗后2周ADC增加率
以及二者联用对评价化疗有效的ROC曲线分析
由ROC曲线分析可知,治疗前、治疗后2周ADC变化率以及二者联用的曲线下面积显示其均有较高的诊断效能,其中以二者联用的AUC值最高。见表4、图3。

表3 化疗后12周肿瘤最大直径减少百分比与化疗前ADC值、化疗2周后ADC增加百分比相关性

图1 化疗后12周肿瘤最大直径减少百分比与化疗前ADC的相关性

图2 化疗后12周肿瘤最大直径减少百分比与化疗后2周ADC增加率的相关性
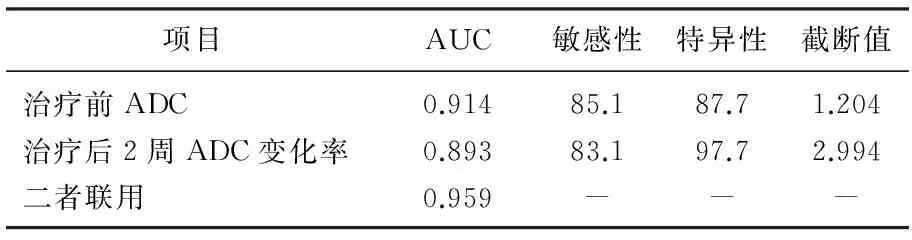
表4 治疗前ADC值、治疗后2周ADC增加率以及二者联用对评价化疗有效的ROC曲线分析
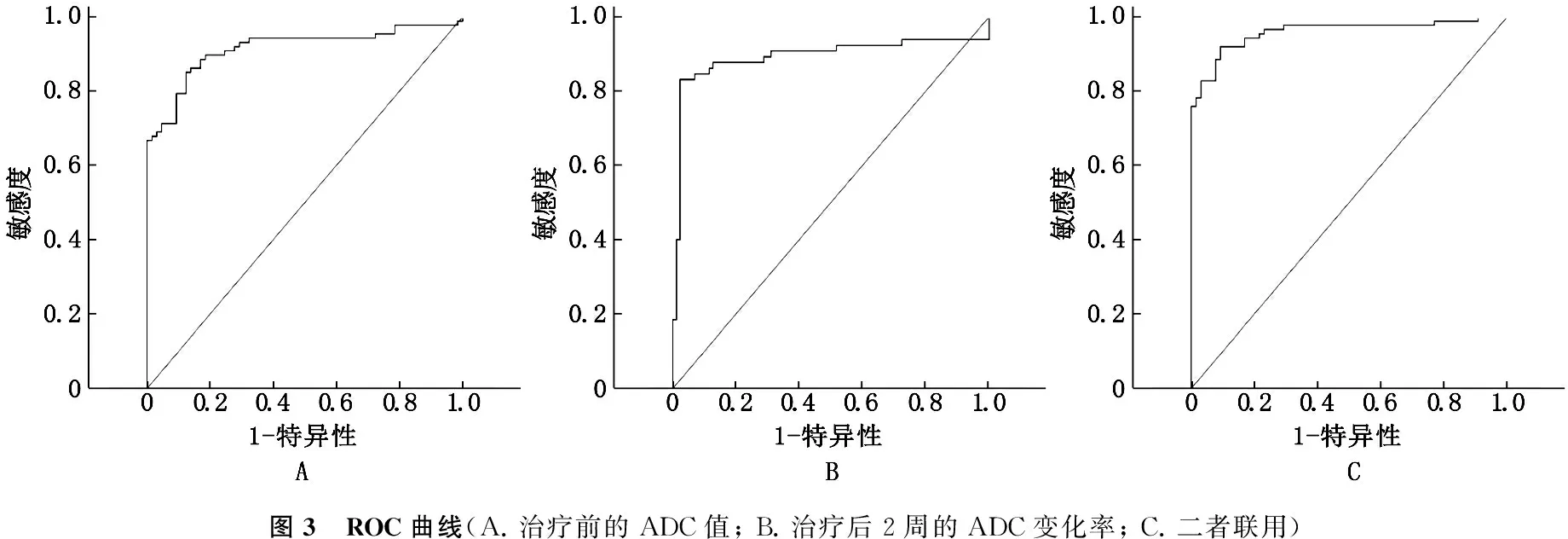
图3 ROC曲线(A.治疗前的ADC值;B.治疗后2周的ADC变化率;C.二者联用)
3 讨 论
肝脏转移瘤来自于胃肠道癌等其他部位的肿瘤,约有60%的胃肠道恶性肿瘤可发生肿瘤肝转移,这同时也是消化道肿瘤的常见死亡因素。虽然手术切除是治疗肿瘤的有效治疗方法,但肝转移瘤患者适应手术切除的比例很少,仅占15%[9-10], 因此化学治疗是不能适应手术切除患者的重要治疗手段。有研究[11-12]表明,有效的化学治疗可以显著降低转移瘤大小,使患者具备手术条件,从而延长患者的生存期。然而由于个体差异,有些患者可能对化疗无效,如果能够在早期预测到化疗对患者是否有效,就能够及时调整治疗方案,减少化疗药物对于病人的伤害。DWI是近年来发现能够评估肿瘤治疗疗效的检测方法, ADC是用于衡量DWI强度的指标,动物实验研究[13]表明化疗前ADC值与治疗结果有效与否有着很强的负相关,提示其有希望用于早期预测化疗疗效的指标。同时,在化疗进行的过程中,如果可以在早期运用化疗后ADC变化率对化疗疗效进行及时反馈,也可帮助医护人员决定是否对治疗不敏感的患者进行进一步化疗。因此本研究选取了化疗前ADC值以及化疗后2周ADC变化率这两个指标,研究二者在单用以及联合应用时是否有希望成为远期化疗效果的预测指标,通过本研究可以有助于医护人员避免对化疗不敏感患者进行病人不必要的治疗。
本研究结果显示,治疗前和治疗后2周有效组和无效组患者转移瘤大小无显著性差异,而治疗12周后有效组转移瘤最大直径显著小于无效组(P<0.05), 说明化疗仅对部分患者具有有效性,而对另一部分患者效果不明显。然而治疗前转移瘤的最大直径与治疗后的肿瘤直径减小百分比无相关性,该结果说明病灶的大小与化疗疗效无关。
ADC值是DWI技术中用以反映组织中水分子扩散特性的指标,可间接反映局部组织细胞密度,新生血管数量及其血管化程度,基质含量及细胞膜完整性等生理病理学特征。对于肿瘤而言,高ADC值常表明该部位水分子活动度大,常常是由于肿瘤组织坏死、液化所导致的。由于该部位组织坏死后缺少必要的血供,组织灌注量低,化疗后药物常无法通过血管输送到该部位,且坏死部位周围组织含氧量也相对较低,新陈代谢缓慢,共同导致了患者对于化疗不敏感。相反的,低ADC值表示该部位水分子活动度小,常由于肿瘤细胞过度增殖所致。因为在拥有充分血供、养料的条件下,肿瘤过度增殖使细胞外基质大大减少,从而限制了水分子在其中的活动,在这种情况下予以化疗,药物可以有效的经过肿瘤的新生血管进入瘤体内部对其进行杀伤[14]。本实验中化疗前无效组ADC值显著高于有效组ADC值,而治疗前的ADC值与转移瘤直径减小百分比呈现负相关,该结果说明化疗前ADC值与化疗疗效有关,化疗前ADC值大说明患者肝脏转移瘤可能对化疗无效,提示其有希望成为预测化疗远期结果的有效指标。通过对其进行ROC曲线分析,作者发现,早期ADC值用于预测化疗效果的AUC为0.914, 具有较高的敏感性和特异性(85.1%、87.7%), 具有一定的临床应用价值。
在对病人进行化疗后,临床上常用18F-FDG PET的方法来对化疗药物的疗效进行早期评估。但是,由于该技术操作复杂、价格昂贵以及X线辐射等缺点限制了其大规模使用[8]。因此,本研究中采用化疗后早期ADC的变化率来评估化疗是否对肿瘤组织的生长起到了抑制作用,并通过此指标来对化疗远期疗效进行评估。通过相关性分析发现,化疗后早期ADC变化率和肿瘤最大直径的下降率呈现明显的负相关,这与研究报道ADC值在乳腺癌等癌症中变化结果相一致[17]; 同时, ROC曲线也显示化疗后2周ADC变化率的AUC为0.893, 敏感性以及特异性分别为83.1%、97.7%, 说明其也具有成为预测指标的潜能。
在此基础上,作者对二者联用后的诊断效能进行了评估,发现联用后其诊断效能有较大的提高,这说明在实际的操作过程中,一次的ADC值的检测对于化疗远期疗效的评估是不足的,若可以联合化疗后合适的时间段内ADC的变化率对远期效果的评估具有更高的准确性。
[1] 李仲启, 傅汉中. 胃肠道癌前病变和癌前疾病研究现状[J]. 临床消化病杂志, 2015 (3): 183-185.
[2] Shi H Y, Zhao X S, Miao F. Metastases to the pancreas: computed tomography imaging spectrum and clinical spectrum and clinical features: a retrospective study of 18 patients with 36 metastases[J]. Medicine, 2015, 94(23): e913-e913.
[3] Dwivedi A. N, Jain R, Dixit R. Gall bladder carcinoma: Aggressive malignancy with protean loco-regional and distant spread[J]. World J Clin Cases. 2015, 3(3): 231-244. Levic K, Bulut O, Hesselffeldt P. Transanal endoscopic microsurgery for giant polyps of the rectum[J]. Tech Coloproctol, 2014, 18(6): 521-527.
[4] Lambertz A, Klink C. D, Roth A, et al. Laser-induced drug release for local tumor control--a proof of concept[J]. J Surg Res, 2014, 192(2): 312-316.
[5] Gourtsoyianni S, Goh V. MRI of anal cancer: assessing response to definitive chemoradiotherapy[J]. Abdom Imaging, 2014, 39(1): 2-17.
[6] 汪国祥, 杨肖华, 汪和平, 等. 胃肠道癌肝转移 DSA 表现与肝动脉化疗栓塞近期疗效的关系[J]. 临床肿瘤学杂志, 2015, 5: 015.
[7] Tajima N, Utano K, Kijima S, et al. Intraductal papillary mucinous neoplasm penetrating to the stomach, duodenum, and jejunum demonstrated on MR cholangiopancreatography with an oral negative contrast agent[J]. J MagnReson Imaging, 2013, 38(1): 206-209.
[8] Busby R. W, Bryant A. P, Bartolini W. P, et al. Linaclotide, through activation of guanylatecyclase C, acts locally in the gastrointestinal tract to elicit enhanced intestinal secretion and transit[J]. Eur J Pharmacol, 2010, 649(1/2/3): 328-335.
[9] Ghevariya V, Malieckal A, Ghevariya N, et al. Carcinoid tumors of the gastrointestinal tract[J]. South Med J, 2009, 102(10): 1032-1040.
[10] Pandanaboyana S, White A, Pathak S, et al. Impact of margin status and neoadjuvant chemotherapy on survival, recurrence after liver resection for colorectal liver metastasis[J]. Annals of surgical oncology, 2015, 22(1): 173-179.
[11] Ippolito E, Mantini G, Morganti A. G, et al. Intensity-modulated radiotherapy with simultaneous integrated boost to dominant intraprostatic lesion: preliminary report on toxicity[J]. Am J ClinOncol, 2012, 35(2): 158-162.
[12] Ohno T, Yokoyama Y, Aihara R, et al. Sudden bilateral sensorineural hearing loss as the presenting symptom of meningeal carcinomatosis of gastric cancer: report of a case[J]. Surg Today, 2010, 40(6): 561-565.
[13] Heo S H, Shin S S, Kim J W, et al. Pre-treatment diffusion-weighted MR imaging for predicting tumor recurrence in uterine cervical cancer treated with concurrent chemoradiation: value of histogram analysis of apparent diffusion coefficients[J]. . Korean J Radiol, 2013, 14(4): 616-625.
[14] Takusagawa S, Ushigome F, Nemoto H, et al. Intestinal absorption mechanism of mirabegron, a potent and selective β3-adrenoceptor agonist: involvement of human efflux and/or influx transport systems[J]. Mol Pharm, 2013, 10(5): 1783-1794.
[15] King A D, Chow K K, Yu K H, et al. Head and neck squamous cell carcinoma: diagnostic performance of diffusion-weighted MR imaging for the prediction of treatment response[J]. Radiology, 2013, 266(2): 531-538.
[16] Ng T S, Wert D, Sohi H, et al. Serial diffusion MRI to monitor and model treatment response of the targeted nanotherapyCRLX101[J]. Clin Cancer Res, 2013, 19(9): 2518-2527.
[17] Kim HS1, Kim C K, Park B K, et al. Evaluation of therapeutic response to concurrent chemoradiotherapy in patients with cervical cancer using diffusion-weighted MR imaging[J]. J MagnReson Imaging, 2013, 37(1): 187-193.
Value of magnetic resonance apparent diffusion coefficient in predicting chemotherapy efficacy for patients with metastatic tumor of liver
WANG Jianhui1, WANG Mingwen1, WAN Hua1, WANG Lei2
(1.DepartmentofMagneticResonance,CentralHospitalofDevelopmentDistrict,Yingkou,Liaoning, 115007; 2.HebeiMedicalUniversity,Shijiazhuang,Hebei, 050017)
Objective To explore the predictive value of diffusion weighted magnetic resonance imaging (DWI) and apparent diffusion coefficients (ADC) in chemotherapy for patients with metastatic tumor of liver. Methods Eighty patients (with 148 lesions) with gastrointestinal hepatic metastases were enrolled. The maximum diameters of the metastases tumor were compared before and after the treatment, and patients were divided into sensitive group and ineffective group according to the tumor diameter. Correlation between the ADC value and the diameter was analyzed, and the ROC curve was drawn to predict the sensitivity and specificity of the therapy. Results The maximum diameter of the tumor was similar in the two groups, and the ADC value of the sensitive group was significantly less than the ineffective group before treatment (P=0.000). In the aspect of ADC, the ADC value increased significantly in the sensitive group after 2 weeks or 12 weeks of treatment. The ADC value before treatment had negative correlation with the change of the diameter of the tumor(r=-0.662,P=0.000), and the change of ADC value after two weeks of treatment had negative correlation with the change of the diameter of the tumor as well(r=-0.846,P=0.000). The AUC value for ADC before treatment was 0.914. The AUC value for the changing rate of ADC after two weeks of treatment was 0.893. In combination of the ADC value before and after two weeks of treatment, the AUC increased significantly. Conclusion The ADC value before treatment, the change of ADC value after two weeks of treatment and collaborative assessment has favorable effective functions for the forecast of the chemotherapy effect on patients with colorectal and gastric cancer.
ADC; chemotherapy; liver metastasis; magnetic resonance
2016-11-18
国家自然科学基金(81202401)
R 735.7
A
1672-2353(2017)03-118-05
10.7619/jcmp.201703036
