溶解性有机碳影响铜对背角无齿蚌稚蚌的急性毒性研究
2017-03-14刘洪波陈修报苏彦平姜涛杨健
刘洪波, 陈修报, 苏彦平, 姜涛, 杨健
中国水产科学研究院淡水渔业研究中心,中国水产科学研究院长江中下游渔业生态环境评价与资源养护重点实验室,无锡 214081
铜是生物体必需元素之一,大量存在于陆地和水生态系统中。铜在淡水中的背景水平一般低于5 μg·L-1,超过一定浓度后就会产生生物毒性。然而起源于人类活动的铜却仍在不断地进入自然生态系统,进而导致污染甚至环境问题。比如硫酸铜经常在控制藻类、细菌和真菌的生长方面被过度使用[1]。由于水环境的铜污染,加拿大某些区域饮用水的铜浓度高至750 μg·L-1[2]。我国亦常利用硫酸铜清塘灭藻,导致一些养殖池塘水的铜浓度可高达2 000 μg·L-1[3]。因此,对水生生物而言,铜目前已被列入需要高度关注的重金属污染物[4]。
在水生生态系统中,铜的生物毒性取决于自由离子活度,自由金属离子的活度和环境水化学性质如DOC、pH、Ca2+、Mg2+、CO32-等的络合和竞争有关。传统的金属基准值推导通常不考虑pH、DOC等的影响,仅用金属总量来评估重金属污染物的毒性。但欧洲[5]和美国[6]的研究表明,金属总量中只有很小一部分是“生物可利用”并对有机体产生潜在毒性的,因此用金属总量不能准确评估重金属污染物实际的生态风险,对水环境来说有可能是过保护。鉴于此,欧美等国在制定本地的水、沉积物或土壤环境质量标准(基准)时,都普遍采用模型或其他验证工具,如自由离子活度模型(free-ion activity models,FIAM)、生物配体模型(biotic ligand model,BLM)[7]或用梯度扩散薄膜(DGT)法原位测量水体中重金属并计算金属解离动力学及有效态组分[8]等,以便能够更准确地预测铜及其他重金属的生物可利用性。
美国淡水铜BLM模型数据输入最低需要pH、硬度(主要指Ca2+和Mg2+)、DOC等指标,其中DOC是影响不同形态金属尤其是自由金属离子浓度的最重要因素[9-10],已取代硬度被美国环保署作为制定关于重金属元素国家水质标准首要考虑的水化学因子[11-12]。对不同环境下DOC与自由金属离子相互作用的研究是现代毒理学研究的一个新热点,其意义在于能更加合理地预测环境中重金属的生物毒性。美国学者利用对铜较为敏感的淡水沟贝(fatmucket, Lampsilis siliquoidea)的稚蚌开展实验,已证实DOC与水体铜形成有机络合物可以消减铜的毒性[11]。然而,据笔者所知国内针对淡水贝类尚缺乏相关研究。
淡水贝类作为独特的指示生物,曾被广泛用于重金属污染的监测和环境中重金属的生物有效性的预测中,特别是其生长的稚蚌阶段,对环境中重金属的变化尤其敏感[13]。然而,淡水贝类亦是世界上最濒危的动物类群之一。如在美国的813种淡水贝类中就有约400种被列入2002国际自然保护联盟红皮书[14]。分析原因发现流域的生态和水质退化对于淡水贝类的影响最为关键。Cataldo等[15]研究了阿根廷三角洲地区河蚬(Corbicula fluminea)种群发现,在水体污染较重的地区水体污染导致的幼体高死亡率对于淡水贝类种群数目的影响最大。这充分证明了淡水贝类幼体阶段在整个生活史阶段是最脆弱的,为此进行早期生活史蚌与水质条件关系的研究,对于淡水贝类种群保护既具深刻的意义,又非常必要。
广布于世界各地的背角无齿蚌属典型的珠蚌类。其生长具有非常复杂的生活史,需经历配子的发生、胚胎发育、寄生、稚蚌、幼蚌以及成蚌的生长等多个发育阶段[16]。2003年以来,背角无齿蚌被我们研究室做为“淡水贝类观察”的特殊指示生物加以研究。目前在掌握其生活史状况的基础上,我们建立了“标准化”背角无齿蚌从钩介幼虫、稚蚌以及成蚌等全生活史各阶段的实验动物种群,并可利用该种群的各阶段个体,对其进行相关重金属毒性的敏感性和耐受情况等毒理学的深入研究[17]。
迄今,Cu已成为水生态系统最受关注的一种重金属[4]。其也是我国渔业水域主要污染物之一[18],并被列入了国家重点防控对象的名单中。由于贝类稚蚌阶段个体自身的环境脆弱性,故基于其来研究生境中重金属及其络合情况对生物毒性的影响将更具研究价值。本研究拟利用自主繁育的背角无齿蚌稚蚌来评价Cu对其的急性毒性以及不同DOC浓度对相关毒性可能的影响,以期为进一步深入探讨环境水化学因子的作用以及保护淡水贝类幼体资源等方面提供理论依据。
1 材料与方法(Materials and methods)
参照美国ASTM E2455-06 “Standard Guide for Conducting Laboratory Toxicity Tests with Freshwater Mussels”[19]和Wang等[20]的研究方法,本研究对实验方法加以改进和完善。
1.1 实验溶液
所有实验用水采用在去离子水里添加人工海水盐的方式配制,水中盐度的终浓度为0.1‰;分析纯CuCl2·2H2O购自上海国药集团,所配母液浓度是5 mg·L-1; 在计算重金属和DOC反应时通常假设DOC由一定比例的腐殖酸(FA)或仅由FA组成[9],实验用腐殖酸钠盐购自Sigma-Aldrich公司,碳含量为39%,原液浓度16 mg·L-1,折算成DOC名义浓度为6 mg C·L-1。原液用搅拌器搅拌至少12 h后方能添加Cu。
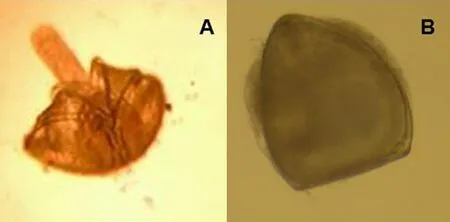
图1 背角无齿蚌稚蚌注:A,活体;B,非活体。Fig. 1 Newly-transformed juveniles of Anodonta woodianaNote: A, alive individual; B, nonviable individual.
1.2 实验材料
将直接取自中国水产科学研究院淡水渔业研究中心南泉实验基地人工繁养获得的3只母蚌的成熟钩介幼虫放入盛有曝气自来水的塑料盆中,并用玻璃棒搅拌均匀,然后将寄生鱼黄颡鱼放入盆中。20 min后,将黄颡鱼取出,放入已准备好的盛有曝气自来水的塑料水槽中暂养。根据背角无齿蚌钩介幼虫寄生发育的生物学零度和有效积温,取脱落高峰期当天的稚蚌于实验条件下暂养>24 h,在此期间,用含有0.01%浓度盐水的标准试验用水更换3次养殖水,每次的更换量为50%,之后选取活体稚蚌(日龄1~2 d)用于毒性实验。在5 min之内,斧足伸出运动的稚蚌定义为活蚌 (图1A),反之,则认为是死亡个体(图1B)。
1.3 急性毒性实验
在采用国家标准GB/T 27861—2011所述的半静态试验方式并48 h换水条件下[21],96 h铜和添加不同浓度DOC对铜急性毒性影响的实验在防酸材质的塑料培养皿中进行,每个培养皿有5个蚌,内有100 mL暴露溶液,每个浓度组有3个平行,培养皿放在25 ℃、亮暗比为16 h:8 h、光强为200 lux冷光源的恒温培养箱中,48 h换水时检查对照组成活,96 h结束时检查所有蚌的存活。Cu暴露的浓度梯度为0、10、23、45、90和180 μg·L-1,添加腐殖酸钠盐的浓度梯度为2、4、8、16 mg·L-1,折合成DOC浓度梯度为0.8、1.5、3.0和6.0 mg C·L-1。
1.4 水质指标的测定
实验开始前取配好的50 mL各浓度组实验用水,用于金属阳离子、DOC、pH等水化学指标的测定。金属阳离子用电感耦合等离子质谱仪(Agilent 7500ce ICP-MS, Agilent, USA)测定,利用元素标准添加回收法确认了测定精度,得到各元素的回收率均在97%~102%范围内。DOC用总有机碳分析仪(TOC-VCPN,岛津,日本)测定。pH用美国EUTECH的pH 510台式酸度计测定。
实际测得的Cu浓度梯度为4.3、10.9、19.5、47.5、91.1和177.2 μg·L-1;DOC浓度梯度为0.3、1.5、1.9、3.1和5.3 mg C·L-1,0.8 和1.5 mg C·L-1组所测浓度比名义浓度明显偏大(>20%),可能是过滤不充分造成的。其余所测浓度与名义浓度的偏差均小于20%。我们仅对名义浓度的Cu和DOC值(除对照组用实测值0.3 mg C·L-1外)进行分析和讨论。pH值的范围为6.7~7.2。各水化学指标的测量结果见表1。
1.5 统计分析
运用SPSS 16.0中的probit模型对所得数据进行处理,计算出96 h半数效应浓度EC50(median effective concentration) 和95%置信区间值。用SPSS 16.0中的线性回归分析来描述EC50值和DOC添加浓度之间的关系。
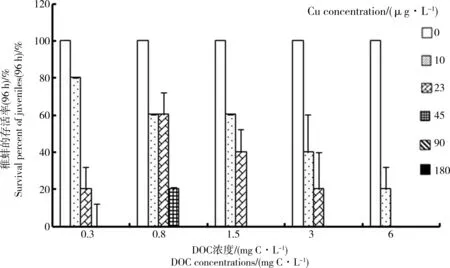
图2 背角无齿蚌稚蚌在不同铜暴露浓度时添加0.3, 0.8, 1.5, 3和6 mg C·L-1浓度DOC后的存活率(96 h)Fig. 2 Survival percent of newly-transformed juveniles (96 h) of Anodonta woodiana in Cu treatments with varying DOC concentrations of 0, 0.8, 1.5, 3, and 6 mg C·L-1
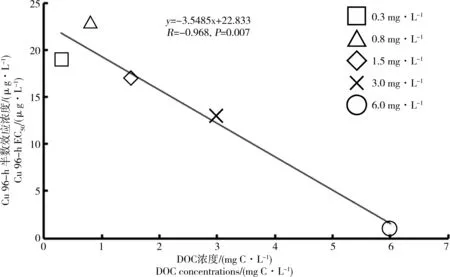
图3 背角无齿蚌稚蚌96 h Cu EC50值与不同DOC浓度间的线性相关性Fig. 3 A linear relationship between the Cu 96 h EC50s of juvenile Anodonta woodiana and DOC concentrations
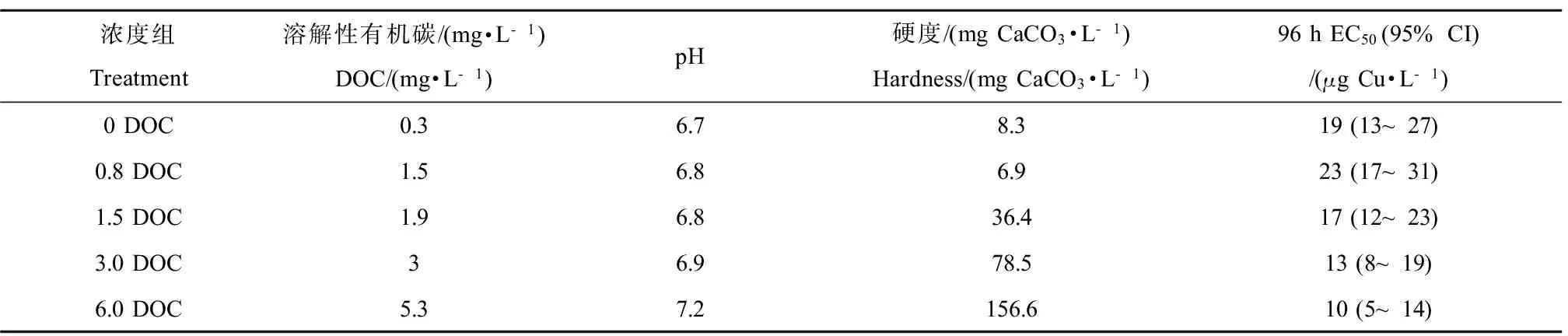
浓度组Treatment溶解性有机碳/(mg·L-1)DOC/(mg·L-1)pH硬度/(mgCaCO3·L-1)Hardness/(mgCaCO3·L-1)96hEC50(95%CI)/(μgCu·L-1)0DOC0.36.78.319(13~27)0.8DOC1.56.86.923(17~31)1.5DOC1.96.836.417(12~23)3.0DOC36.978.513(8~19)6.0DOC5.37.2156.610(5~14)
2 结果(Results)
DOC对Cu急性毒性的影响反应在稚蚌的存活率上见图2,随着Cu浓度的升高,未添加DOC及各DOC添加组的稚蚌均反应出明显的浓度-剂量效应,即Cu浓度越高,死亡率越大,并在10 μg·L-1Cu浓度时即有死亡的蚌出现。
对应0.3、0.8、1.5、3.0 和6.0 mg C·L-1DOC浓度组96 h Cu EC50值分别为19 (13~27),23 (17~31),17 (12~23),13 (8~19) 和10 (5~14) μg·L-1(表1),调整DOC浓度与稚蚌的96 h Cu EC50值呈负相关关系(R = -0.968, P=0.007, 图3)。
3 讨论(Discussion)
稚蚌96 h Cu EC50值为19 μg·L-1,低于美国环境保护署报道的淡水贝类Actinonaias sp. 和Utterbackia imbecillis稚蚌的Cu LC50或EC50值(27~199 μg·L-1)[6],亦低于Wang等[20]研究所报道的稚蚌Neosho mucket (23~43 μg·L-1),Scaleshell (29 μg·L-1,濒危种)和Wavy-rayed lampmussel (21~25 μg·L-1)的EC50值,并且十分接近于渔业水质标准GB11607—89中有关Cu的限量标准(10 μg·L-1)。一方面,说明背角无齿蚌稚蚌对环境中Cu浓度的变化十分敏感,可以作为濒危蚌种的替代指示物,用以较为有效地监测水环境中铜污染的状况;另一方面,在类似本研究中硬度和pH值低于前人报道的水环境里,稚蚌对重金属离子浓度的变化可能更加敏感,更易引起活动减少甚至死亡的应激反应。Wang等[20]的研究实验用水的硬度为177 mg·L-1,而本实验对照组Ca2+([Ca]) 和 Mg2+([Mg]) 的浓度分别为1 和 1.4 mg·L-1,其实验用水的硬度仅为8.3 mg·L-1(用CaCO3计算硬度,所用公式为2.47[Ca] + 4.11[Mg])[22];此外,Wang等[20]实验用水的pH为8.5,亦高于本实验用水(pH=6.7~7.2),二者水的硬度和pH的差异也许是导致背角无齿蚌稚蚌对铜较为敏感的重要原因。具体的机制尚待今后进一步的研究来确定。
金属自由阳离子主要随DOC浓度的变化而变化,对毒性金属而言,通常认为DOC是影响其生物利用度最重要的水化学因子,因为DOC可与铜络合成不具有毒性的溶解性铜Cu-DOC[11-12],可以有效缓解Cu的毒性;因此,美国环保署将其作为制定关于重金属元素新的国家水质标准首要考虑的水化学因子。值得注意的是,从本研究的结果来看,仅调整DOC浓度,而不调整硬度和pH,对降低铜毒性、减少稚蚌的死亡以及提高96-h Cu EC50值等方面效果并不明显,甚至有负相关关系(R= -0.968, P=0.007)。
在以往对镉毒性的研究中也出现过类似情况,如有研究发现有机配体(苹果酸、柠檬酸)的存在对小麦根的Cd毒性影响不大[7],推测植物对Cd的吸收是受溶液相中扩散过程控制,有机配体的加入可以帮助Cd2+从溶液中运输到生物膜表面,促进植物根系吸收,造成毒性不变或增加。但背角无齿蚌稚蚌对Cu的吸收是否与植物类似,需要进行更多的研究来加以证实。
我们曾经研究了调节暴露溶液硬度(CaCO3)即钙(Ca)或镁(Mg)离子的浓度后对降低铜毒性的影响,发现虽然Ca离子在某个特定的浓度下对降低铜毒性有作用,但与Ca浓度组之间不呈线性相关[23],这与本研究的结果相似。在0.8 mg C·L-1DOC浓度调节下,尽管铜毒性有暂时性的降低,但在更高浓度的DOC溶液中,稚蚌的死亡并没有随之有效降低;显示竞争和络合在降低重金属毒性机理上的复杂性。
在与阴离子的络合作用中,铜可与生物体内调节钠(Na)和氯(Cl)离子的特定酶相互作用, 与生物体(主要指腮)表面某些特定的活性位点(如氯细胞)结合,使钠离子吸收受阻,破坏生物体的离子平衡,导致生物体死亡[9];同时由于水溶性铜的形态还有CuCO3、Cu(OH)+等形式,pH值的高低有可能影响上述结合形态的存在状况;同时,DOC作为金属配体的形式也是多样的,甚至一些有机络合形态[24]也可以被生物直接吸收而产生毒性。此外,金属硫蛋白也有可能对腮、消化腺中Cu等的储存、运输和代谢产生影响[25];因此仅靠调整DOC达到减弱金属毒性的目的是很难实现的[11]。在下一步研究中要考虑取用富含DOC、硬度适中及pH偏碱的天然水作为实验用水,以验证最佳的水化学指标组合对减轻重金属毒性的有效性。
致谢:感谢中国科学院南京地理与湖泊研究所李宽意研究员和黄建明工程师在DOC分析中给予的帮助。
[1] Flemming C A, Trevors J T. Copper toxicity and chemistry in the environment: A review [J]. Water, Air, and Soil Pollution, 1989, 44: 143-158
[2] Tran D, Fournier E, Durrieu G, et al. Copper detection in the Asiatic clam Corbicula fluminea: Optimum valve closure response [J]. Aquatic Toxicology, 2004, 66: 333-343
[3] Li N, Zhao Y L, Yang J. Impact of waterborne copper on the structure of gills and hepatopancreas and its impact on the content of metallothionein in juvenile giant freshwater prawn Macrobrachium rosenbergii (Crustacea: Decapoda) [J]. Archives of Environmental Contamination and Toxicology, 2007, 52(1): 73-79
[4] Donnachie R L, Johnson A C, Moeckel C, et al. Using risk-ranking of metals to identify which poses the greatest threat to freshwater organisms in the UK [J]. Environmental Pollution, 2014, 194: 17-23
[5] European Copper Institute (ECI). European Union Risk Assessment Report: Voluntary risk assessment of copper, copper II sulphate pentahydrate, copper(I)oxide, copper(II)oxide, dicopper chloride trihydroxide [R]. Brussels, Belgium: ECI, 2008
[6] U.S. Environmental Protection Agency. Aquatic Life Ambient Freshwater Quality Criteria-Copper (CAS Registry Number 7440-50-8) [S]. Washington, DC: Office of Water, 2007
[7] 郑琰, 顾雪元, 姜洋, 等. 3 种毒性预测模型在镉对小麦根毒性预测中的应用及比较[J]. 生态毒理学报, 2017, 12(1): 173-183
Zheng Y, Gu X Y, Jiang Y, et al. The application and comparison of three toxicity models for predicting the cadmium toxicity to wheat (Triticum aestivum) [J]. Asian Journal of Ecotoxicology, 2017, 12(1): 173-183 (in Chinese)
[8] 田娜娜, 赵玉杰, 周其文, 等. DGT法原位测量水体中金属有效态组分及动力学研究[J]. 农业环境科学学报, 2017, 36(6): 1210-1217
Tian N N, Zhao Y J, Zhou Q W, et al. In situ measurements of available composition and dissociation kinetics of metals in water using DGT [J]. Journal of Agro-Environment Science, 2017, 36(6): 1210-1217 (in Chinese)
[9] Niyogi S, Wod C M. Biotic ligand model, a flexible toolfor developing site-specific water quality guidelines for metals [J]. Environmental Science and Technology, 2004, 38: 6177-6192
[10] 王学东, 马义兵, 华珞, 等. 环境中金属生物有效性的预测模型——生物配体模型研究进展[J]. 生态毒理学报, 2006, 1(3): 193-202
Wang X D, Ma Y B, Hua L, et al. Advances in Biotic-Ligand Model to predict the bioavailability of metals in environments [J]. Asian Journal of Ecotoxicology, 2006, 1(3): 193-202 (in Chinese)
[11] Wang N, Mebane C A, Kunz J L, et al. Evaluation of acute copper toxicity to juvenile freshwater mussels (fatmucket, Lampsilis siliquoidea) in natural and reconstituted waters [J]. Environmental Toxicology and Chemistry, 2009, 28(11): 2367-2377
[12] Wang N, Mebane C A, Kunz J L, et al. Influence of dissolved organic carbon on toxicity of copper to an unionid mussel (Villosa iris) and a cladoceran ( Ceriodaphnia dubia) in acute and chronic water exposures [J]. Environmental Toxicology and Chemistry, 2011, 30(9): 2115-2125
[13] Naimo T J. A review of the effects of heavy metals on freshwater mussels [J]. Ecotoxicology, 1995, 4: 341-362
[14] Farris J L, van Hassel J H. Freshwater Bivalve Ecotoxicology [M]. Boca 296 Raton, FL: CRC Press, and Pensacola: SETAC Press, 2007
[15] Cataldo D, Colombo J C, Boltovskoy D, et al. Environmental toxicity assessment in the Paraná River Delta (Argentina): Simultaneous evaluation of selected pollutants and mortality rates of Corbicula uminea (Bivalvia) early juveniles [J]. Environmental Pollution, 2001, 6(2): 379- 389
[16] Chen X B, Yang J, Liu H B, et al. Element concentrations in a unionid mussel Anodonta woodiana at different stages [J]. Journal-Faculty of Agriculture Kyushu University, 2012, 57(1): 139-144
[17] Chen X B, Liu H B, Su Y P, et al. Morphological development and growth of the freshwater mussel Anodonta woodiana from early juvenile to adult [J]. Invertebrate Reproduction and Development, 2015, 59(3): 131-140
[18] 沈新强, 杨健. 渔业生态环境领域研究进展[M]// 中国水产科学发展报告(2011-2015). 北京: 中国农业出版社, 2016: 100-121
[19] ASTM. Standard guide for conducting laboratory toxicity tests with freshwater mussels (E2455-06) [R]. West Conshohocken, Philadelphia: American Society for Testing and Materials International, 2006
[20] Wang N, Ingersoll C G, Hardesty D K, et al. Acute toxicity of copper, ammonia, and chlorine to glochidia and juveniles of freshwater mussels (unionidae) [J]. Environmental Toxicology and Chemistry, 2007, 26(10): 2036-2047
[21] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T27861—2011, 化学品鱼类急性毒性试验[S]. 北京: 中国标准出版社, 2011
[22] Markich S J. Water hardness reduces the accumulation and toxicity of uranium in a freshwater macrophyte (Ceratophyllum demersum) [J]. Science of the Total Environment, 2013, 443: 582-589
[23] Liu H B, Chen X B, Su Y P, et al. Effects of calcium and magnesium ion on acute copper toxicity to the glochidia and early juveniles of Chinese pond mussel Anodonta woodiana Lea, 1834 [J]. Bulletin of Environmental Contamination and Toxicology, 2016, 97(4): 504-509
[24] Poldoski J E. Cadmium bio-accumulation assays their relationship to various ionic equilibria in lake superior water [J]. Environmental Science and Technology, 1979, 13(6): 701-706
[25] 霍礼辉, 林志华, 包永波. 重金属诱导贝类金属硫蛋白研究进展[J]. 水生态学杂志, 2011, 32(1): 7-13
Huo L H, Lin Z H, Bao Y B. The research advances of mollusca metallothionein induced by heavy metals [J]. Journal of Hydroecology, 2011, 32(1): 7-13 (in Chinese)
