赤灵芝多糖分离纯化及体外抗氧化性研究
2017-03-14徐雪峰李桂娟张敬畅
徐雪峰 李桂娟 闫 浩 张 玉 张敬畅
(1. 海南科技职业学院生物与化学工程学院,海南 海口 571126;2. 长春工业大学化学工程学院,吉林 长春 130012;3. 北京化工大学理学院,北京 100029)
赤灵芝多糖分离纯化及体外抗氧化性研究
徐雪峰1李桂娟2闫 浩1张 玉1张敬畅3
(1. 海南科技职业学院生物与化学工程学院,海南 海口 571126;2. 长春工业大学化学工程学院,吉林 长春 130012;3. 北京化工大学理学院,北京 100029)
对赤灵芝多糖进行分离、纯化和体外抗氧化性研究。从赤灵芝中提取粗多糖,通过离子交换色谱、葡聚糖凝胶色谱对粗多糖进行分离纯化,采用凝胶渗透色谱、气相色谱进行分子量和单糖组成测试,对GLPa-2、GLPb-1、GLPc 3个级分进行了体外抗氧化性研究。结果表明,3个多糖级分主要由葡萄糖、阿拉伯糖、木糖、甘露糖组成,但单糖的摩尔比不同;GLPa-2、GLPb-1、GLPc的重均分子量分别为3.65×105,3.87×104,1.38×104Da;各样品对自由基的清除率随浓度升高而增大,呈量效关系,分子量最大的GLPa-2抗氧化活性最佳,表明赤芝多糖的抗氧化活性与其组成相关。
赤芝多糖;分离;分子量;单糖组成;抗氧化
赤灵芝(简称赤芝),广义上称之为灵芝[Ganodermalucidum(Curtis:Fr.)Karst],为层菌纲非褶菌目灵芝菌科灵芝属真菌,是一种广泛应用的药食两用真菌,具有促进睡眠、缓解机体疲劳、抗氧化、抗肿瘤、调节免疫、保肝等药理活性[1-3],赤芝中的多糖是其主要活性成分之一[4-5]。王海燕等[6]对灵芝菌丝体多糖分离纯化得到3个多糖级分,多角度光散射仪联用装置测得其重均分子量各不相同;杨慧等[7]从赤芝子实体分离得到2个多糖组分,经PMP柱前衍生化反相色谱分析表明其单糖组成存在显著差异;郝杰等[8]研究得出不同分子量石斛多糖的抗氧化活性不同;倪力军等[9]研究了8种多糖的组成与活性,得出其间存在相关性;还有研究[10-11]表明,多糖的抗氧化能力与多糖的单糖组成、分子量有较大关系。张志军等[12]研究了灵芝多糖在体外对超氧阴离子自由基和羟自由基的清除能力,发现灵芝多糖具有抗氧化作用和清除自由基的能力。刘钧发等[13]比较了超声法和水提法灵芝多糖的抗氧化活性,表明超声法提取的灵芝多糖的DPPH自由基清除率、还原能力和氧自由基清除能力高于水提法。叶颖霞等[14]通过化学修饰改变灵芝多糖的结构并研究其抗氧化活性,结果指出乙酰化修饰可显著提高灵芝多糖的抗氧化活性。另有文献[15-16]报道灵芝多糖的分子量、单糖组成对灵芝多糖的药理活性具有一定影响。灵芝多糖已被证实具有抗氧化活性,且已有研究人员从不同提取工艺和化学修饰等方面研究灵芝多糖的抗氧化活性,但对灵芝多糖不同级分的抗氧化性进行比较分析的研究鲜见报道。尤其是当前有关灵芝多糖提取分离方法和相关活性的研究已进入一个瓶颈期,而对灵芝多糖分离后所得级分的分子量、单糖组成进行分析,并比较不同级分的药理活性,探索灵芝多糖活性与前两者之间关系的研究仍处于空白阶段。本研究拟提取赤芝粗多糖,通过离子交换色谱、葡萄糖凝胶色谱对粗多糖进行分离纯化,利用凝胶渗透色谱法(GPC)分析各级分的分子量,衍生化处理后运用气相色谱(GC)分析各级分的单糖组成。通过羟自由基和超氧阴离子清除试验对各级分进行体外抗氧化活性测试,比较其抗氧化能力强弱,并对赤芝多糖级分的抗氧化活性、分子量、单糖组成进行比较分析,以期为赤芝多糖在天然抗氧化剂方面的开发利用提供参考依据。
1 材料与方法
1.1 材料与仪器
赤芝:海南本地赤芝子实体,切片干燥后粉碎过60目筛;
D-葡萄糖(Glc)、D-木糖(Xyl)、D-阿拉伯糖(Ara)、D-半乳糖(Gal)、D-鼠李糖(Rha)、D-岩藻糖(Fuc)、D-甘露糖(Man)标准品:含量>98%,上海源叶生物科技有限公司;
DEAESepharose CL-6B凝胶、Sephacryl S-300HR凝胶:美国Pharmacia公司。
其他试剂均为分析纯;
凝胶色谱仪:ELEOS System型,配Waters515泵,DAWN HELEOSⅡ18角度激光光散射检测器,Optilab rEx示差检测器,美国Wyatt公司;
气相色谱仪:Agilent 6890型,美国Agilent Technologies公司。
1.2 方法
1.2.1 赤芝粗多糖的提取 参考文献[17]采用超声波辅助法提取,95%乙醇进行沉淀,得赤芝粗多糖GLP。
1.2.2 赤芝粗多糖的分离纯化 赤芝粗多糖GLP用洗脱缓冲液溶解后上DEAE Sepharose CL-6B层析柱,依次用Tris—HCl缓冲液(0.05 mol/L,pH 7.6)和含0.0,0.2,0.5,0.8 mol/L NaCl的Tris—HCI缓冲液(0.05 mol/L,pH 7.6)梯度洗脱,洗脱速度为2 mL/min,6 mL每管分部收集,隔管检测多糖含量(苯酚硫酸法A490)。按多糖含量检测值分别合并收集单一峰组分,去离子水透析,冻干。得到4个主要赤芝多糖组分GLPa、GLPb、GLPc、GLPd。上步收集的各个组分通过Sephacryl S-300HR层析柱在同浓度NaCl的缓冲液洗脱下进一步分级纯化,隔管检测多糖含量。按多糖含量检测值分别合并收集单一峰级分,去离子水透析,冻干。得GLPa-2、GLPb-1、GLPc 3个赤芝多糖级分。
1.2.3 分子量测定 采用凝胶渗透色谱法测定分子量,使用激光检测器和示差光检测器联用技术,色谱柱:Shodex OHpak SB-804 HQ、SB-806 HQ(8 mm×300 mm);流动相:0.12 mol/L 醋酸铵溶液(含0.02% 叠氮化钠);流速:1 mL/min;柱温:25℃。
1.2.4 单糖组成分析 取GLPa-2、GLPb-1、GLPc各10 mg,置10 mL具塞试管中,加4 mL 2 mol/L TFA溶液,封闭,120℃烘箱中水解反应1.5~2.0 h,取出,放冷至室温后,将水解液转入25 mL梨形烧瓶,60℃水浴减压蒸干。单糖乙酰化参考文献[18]的方法进行。GC条件:进样量1 μL,色谱柱:Agilent HP-INNOWax 19091N-133(30 m×250 μm×0.25 μm),检测器:FID,载气:N2,流速1.0 mL/min,进样口200℃,汽化室320℃,检测室250℃,分流比为20∶l,程序升温,初温60℃,6℃/min升至180℃。
1.2.5 羟自由基(·OH)清除率测定 参考文献[19]的方法进行。清除率按式(1)计算:
(1)
式中:
S——羟自由基(·OH)清除率,%;
Ax——加入H2O2和样品液组的吸光度;
A空——加入H2O2不加样品液组的吸光度;
A0——加入样品液不加H2O2组的吸光度。
1.2.6 超氧阴离子(O2-·)清除率测定 参考文献[20]的方法进行。清除率按式(2)计算:
(2)
式中:
S——超氧阴离子(O2-·)清除率,%;
As——样品组的吸光度;
A0——用等量水代替样品组的吸光度。
1.2.7 数据分析 1.2.5和1.2.6中,每种样品均制成0.05,0.10,0.20,0.40,0.80 mg/mL共5个浓度进行试验,每个浓度下分别进行5次试验,利用数据处理软件对结果进行处理并进行误差分析,分别比较同种样品不同浓度及同浓度不同样品的·OH清除率和O2-·清除率。
2 结果与分析
2.1 多糖的分离纯化
赤芝粗多糖GLP经DEAE Sepharose CL-6B层析柱洗脱,洗脱曲线见图1。GLP分离得到4个主要多糖组分GLPa、GLPb、GLPc、GLPd,得率分别为29.6%,21.1%,13.7%,4.8%。由于GLPd组分得率较低,只将GLPa、GLPb、GLPc 3个组分进一步通过Sephacryl S-300HR层析柱分级纯化,洗脱曲线见图2。GLPa经分离得到GLPa-1、GLPa-2、GLPa-3 3个级分,其中以GLPa-2为主要成分,得率62.5%,洗脱峰较对称。GLPb经分离得到GLPb-1、GLPb-2 2个级分,GLPb-1为主要成分,得率66.1%,峰形较对称。GLPc再次柱层析后洗脱曲线峰形较对称,组成相对单一,得率69.2%。因此将对GLPa-2、GLPb-1、GLPc 3个得率较高级分样品的分子量、单糖组成和体外抗氧化活性进行研究。
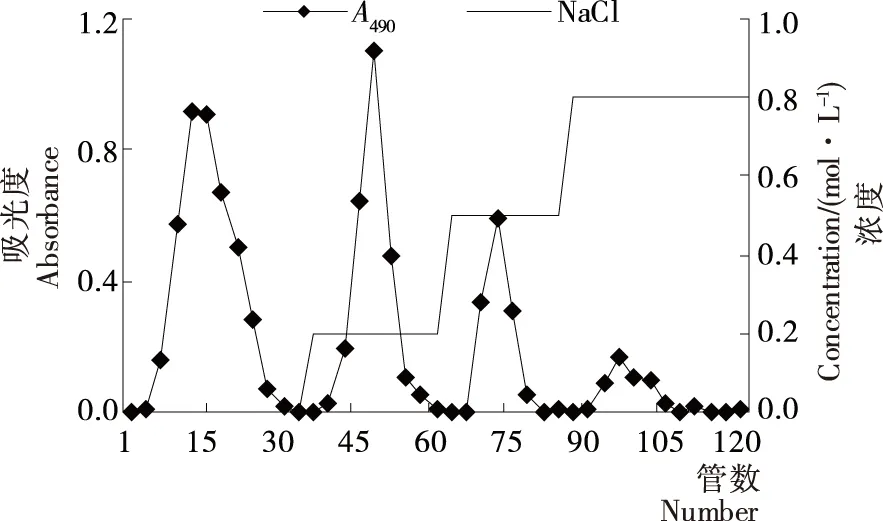
图1 GLP经DEAE Sepharose CL-6B柱洗脱曲线Figure 1 Elution curve of GLP on DEAE Sepharose CL-6B
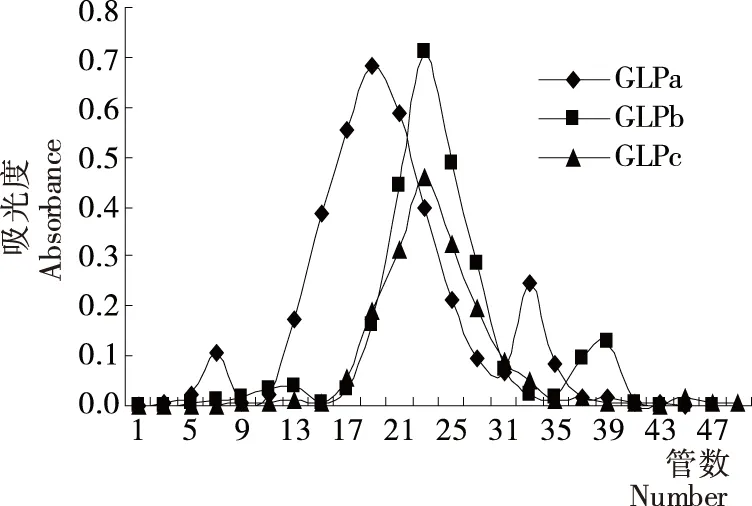
图2 GLPa、GLPb和GLPc经Sephacryl S-300HR柱洗脱曲线Figure 2 Elution curve of GLPa,GLPb and GLPc on Sephacryl S-300HR
2.2 分子量测定
图3为GLPa-2、GLPb-1、GLPc的GPC样品的示差光检测峰。经ASTRA 5.3.4数据处理软件分析得出GLPa-2的重均分子量(Mw)为3.65×105Da,数均分子量(Mn)为3.01×105Da;GLPb-1的重均分子量为3.87×104Da,数均分子量(Mn)为2.65×104Da;GLPc的重均分子量为1.38×104Da,数均分子量(Mn)为8.15×103Da。何晋浙等[21]研究灵芝多糖分子量分布得出,灵芝多糖分子量分布主要在8×104~2×105Da,以高分子量多糖为主。本研究对灵芝粗多糖初次分离得到的高分子量组分GLPa、GLPb得率达50.7%,与文献研究结果相似;而分离到的GLPa-2和GLPc的分子量为3.65×105Da和1.38×104Da,进一步说明通过多次凝胶层析可从赤芝多糖分离出分子量更大或更小的均一组分。一般认为,分散指数Mw/Mn越大,表明分子量分步越宽,反之越窄。GLPa-2、GLPb-1、GLPc的Mw/Mn分别为1.22,1.46,1.40,说明3个赤芝多糖级分的分子量分步较集中,纯度较好。另有研究[22-24]报道,具有活性的灵芝多糖的分子量一般大于1.0×104Da,分子量低于此值的多糖一般没有活性或活性很低,QI等[10]提出水溶性多糖抗氧化能力与分子量分布有很大关系。
2.3 单糖组成分析
单糖混合标准品的色谱图见图4,通过与各单糖乙酰酯的保留时间对比,各单糖乙酰化后出峰顺序依次为鼠李糖(7.267 min)、阿拉伯糖(8.253 min)、岩藻糖(8.634 min)、木糖(9.887 min)、甘露糖(13.019 min)、半乳糖(13.398 min)和葡萄糖(13.782 min),肌醇的保留时间为15.031 min。
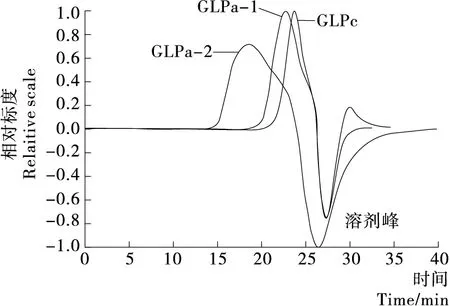
图3 GLPa-2、GLPb-1和GLPc的GPC图Figure 3 Gel permeation chromatography spectrogram of GLPa-2, GLPb-1 and GLPc

图4 单糖混合标准品乙酰酯气相色谱图Figure 4 Gas chromatogram of alditol acetates of monosaccharide standard
GLPa-2、GLPb-1、GLPc水解乙酰化后的GC分析结果见图5~7,结合图4,说明GLPa-2主要由阿拉伯糖、木糖、甘露糖和葡萄糖4种单糖组成,算得其摩尔比为1.18∶1.99∶2.04∶3.68;GLPb-1、GLPc主要由阿拉伯糖、木糖、甘露糖、半乳糖和葡萄糖5种单糖组成,摩尔比分别为1.54∶0.87∶2.65∶0.33∶4.01和1.24∶1.44∶1.43∶0.39∶4.39。何晋浙等[21]通过GC分析了灵芝多糖的组成,得出灵芝多糖由葡萄糖、阿拉伯糖、木糖、甘露糖和半乳糖组成,其中葡萄糖为主要成分,含量为89%。与其研究结果相比,灵芝多糖的总体组成一致,但各级分所含单糖比例不同,且GLPa-2不含半乳糖。以上表明分子量不同的赤芝多糖级分,其单糖组成和含量不同,多糖结构存在差异;葡萄糖含量低于文献[21]报道的89%,原因可能是灵芝品种不同,以及在分离纯化过程中损失的其他级分主要组成为葡萄糖。
2.4 ·OH和O2-·清除率试验结果
对羟自由基的清除率试验结果见图8,在试验范围内,所有样品对羟自由基均有清除作用,且清除率随浓度升高而增大,清除率与浓度呈量效关系。当浓度达到0.80 mg/mL时,GLPa-2、GLPb-1、GLPc、GLP和VC对羟自由基的清除率分别为71.44%,30.87%,37.64%,43.68%,88.45%,GLPa-2对羟自由基的清除率与VC最为接近,相当于VC的80.77%,分别为GLP、GLPb-1、GLPc的1.64,2.31,1.90倍。表明GLPa-2具有较好的羟自由基清除能力,且优于纯化前的赤芝粗多糖GLP,其他级分对羟自由基清除能力一般。
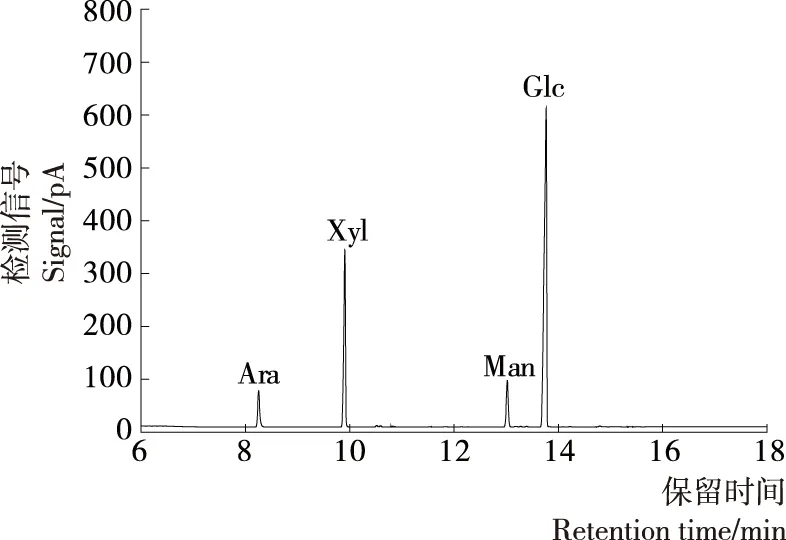
图5 GLPa-2水解产物乙酰酯气相色谱图Figure 5 Gas chromatogram of alditol acetates of GLPa-2
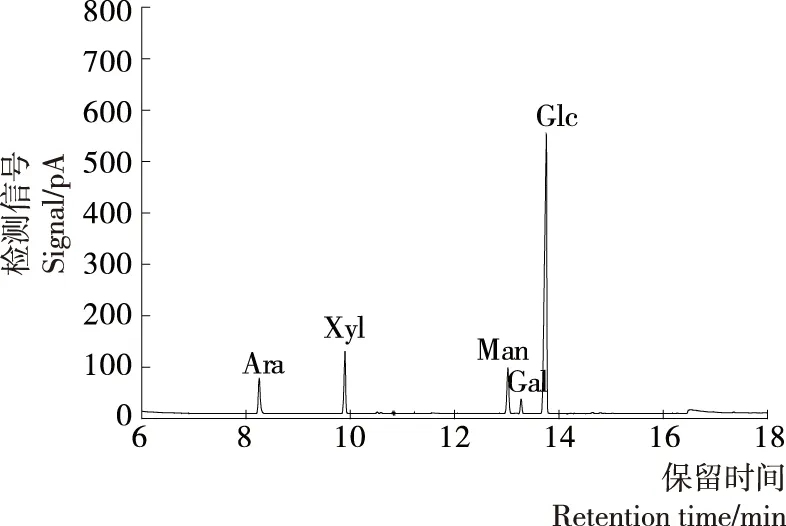
图6 GLPb-1水解产物乙酰酯气相色谱图Figure 6 Gas chromatogram of alditol acetates of GLPb-1
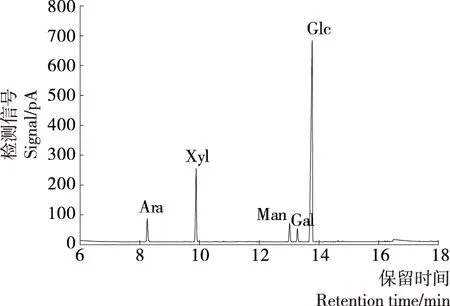
图7 GLPc水解产物乙酰酯气相色谱图Figure 7 Gas chromatogram of alditol acetates of GLPc
对超氧阴离子的清除率试验结果见图9,与对羟自由基的清除率试验相似,各样品清除率与浓度呈量效关系。由图9 可知,与VC比较,GLP、GLPb-1、GLPc对超氧阴离子的清除能力一般,当浓度增至0.80 mg/mL时,GLPa-2的清除率增加到86.27%,为VC的94.54%,分别是GLP、GLPb-1、GLPc的1.62,2.66,2.48倍。
综上分析,赤芝多糖级分GLPa-2、GLPb-1、GLPc的分子量和单糖组成类型及比例各不一致,其在不同体系中的抗氧化活性也存在明显差异,说明赤芝多糖的抗氧化活性和其分子量、单糖组成相关,与鲍素华等[25]对铁皮石斛多糖的研究结果相似。赤芝多糖级分分子量大小为GLPa-2>GLPb-1>GLPc,但其抗氧化性大小为GLPa-2>GLPc>GLPb-1,表明赤芝多糖的抗氧化性与其分子量并非正相关。倪力军等[9]指出各单糖对多糖体外抗氧化活性具有影响,从赤芝单糖组成分析结果可知,GLPa-2中木糖的组成比例高于其他2个级分,且不含半乳糖,推测可能是GLPa-2优于GLPc和GLPb-1抗氧化活性的原因。表明赤芝多糖的体外抗氧化活性除与其分子量相关外,还受各级分单糖组成的影响,各单糖对其影响程度还有待进行大量的试验和数据分析得出。
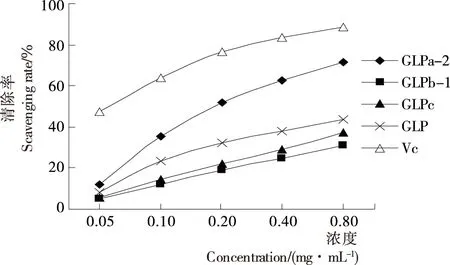
图8 样品对羟自由基的清除率Figure 8 Scavenging rate of hydroxyl radical of samples
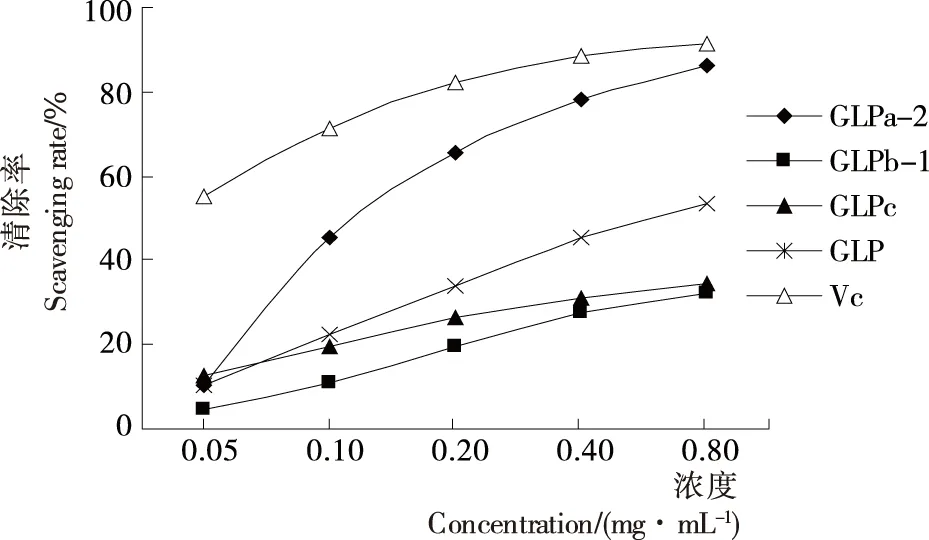
图9 样品对超氧阴离子的清除率Figure 9 Scavenging rate of superoxide anion radical of samples
3 结论
之前,赤芝多糖的抗氧化活性已有研究报道[12,26-28],本研究进一步对赤芝粗多糖进行分离纯化,得到3个主要级分GLPa-2、GLPb-1和GLPc,并研究了各级分的体外抗氧化活性。结果表明,赤芝多糖级分的分子量大小、单糖组成不同,其抗氧化性也存在差异。赤芝多糖纯化级分GLPa-2对羟自由基和超氧阴离子的清除率明显高于赤芝粗多糖和其他级分,与VC相近,具有良好的抗氧化活性,其重均分子量大小为3.65×105Da,由阿拉伯糖、木糖、甘露糖和葡萄糖4种单糖组成。研究从赤灵芝粗多糖中分离并筛选出了一个最佳抗氧化活性级分——GLPa-2,这对赤芝多糖的综合开发和有效利用具有重要指导意义。
[1] SHIAO M S. Natural products of the medicinal fungus ganoderma lucidum.biological activities and pharmacological functions[J]. The Chemical Record, 2003, 3: 172.
[2] 侯晓梅, 张敏, 杨海龙, 等. 灵芝多糖深层发酵生产研究进展[J]. 食品研究与开发, 2014(15): 126-130.
[3] ISABEL C F R Ferreira, SANDRINA A Heleno, FILIPA S Reis, et al. Chemical features of Ganoderma polysac-charides with ant-ioxidant, antitumor and antimicrobial activities[J]. Phytochemistry, 2015, 114: 38-55.
[4] CHEN Ti-qiang, WU Yan-bin, WU Jian-guo, et al. Efficient extraction technology of antioxidant crude polysaccharides from Ganoderm-a lucidum (Lingzhi), ultrasonic-circulating extraction integrating with superfine-pulverization[J]. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(1): 57-62.
[5] PAN Ke, JIANG Qun-guang, LIU Guo-qing, et al. Optimization extraction of Ganoderma lucidum polysaccharides and its immunity and antioxidant activities[J]. International Journal of Biological Macromolecules, 2013, 55: 301-306.
[6] 王海燕, 戴军, 陈尚卫. 灵芝菌丝体多糖的分离纯化及其单糖组成分析与分子量测定[J]. 食品与机械, 2015, 31(5): 201-205.
[7] 杨慧, 戴军, 陈尚卫, 等. 灵芝子实体多糖的分离纯化、组成及其免疫活性研究[J]. 食品与机械, 2015, 31(1): 132-136.
[8] 郝杰, 查学强, 鲍素华, 等. 霍山石斛不同分子量多糖体外抗氧化研究[J]. 食品科学, 2009, 30(15): 94-98.
[9] 倪力军, 王媛媛, 何婉瑛, 等. 8种多糖的单糖组成、活性及其相关性分析[J]. 天津大学学报, 2014, 47(4): 326-330.
[10] QI Hui-min, ZHAO Ting-ting, ZHANG Quan-bin, et al. Antioxidant activity of different molecular weight sulfated polysaccharides from Ulva pertusa Kjellm(Chlorophyta)[J]. Joumat of Applied Phycology, 2005, 17: 527- 534.
[11] 金红英, 施松善, 王顺春, 等. 野菊花中性多糖CIP-C的分离纯化及结构解析[J]. 高等学校化学学报, 2012, 33(4): 755-760.
[12] 张志军, 李淑芳, 魏雪生, 等. 灵芝多糖体外抗氧化活性的研究[J]. 化学与生物工程, 2011, 28(3): 63-65.
[13] 刘钧发, 冯梦莹, 游丽君, 等. 超声和水提法提取灵芝多糖的结构和抗氧化性的比较研究[J]. 食品工业科技, 2013, 34(24): 88-92.
[14] 叶颖霞, 赵菊香, 陈盛强, 等. 灵芝多糖乙酰化及其抗氧化活性研究[J]. 安徽中医药大学学报, 2016, 35(2): 75-79.
[15] 毛健, 马海乐. 灵芝多糖的研究进展[J]. 食品科学, 2010, 31(1): 295-299.
[16] MA Chung-wah, FENG Meng-ying, ZHAI Xu-feng, et al. Optimization for the extraction of polysaccharides from Ganod-erma lucidum and their antioxidant and antiproliferativeac-tivities[J]. Journal of the Taiwan Institute of Che-mical Engineers, 2013, 44(6): 886-894.
[17] 徐雪峰, 闫浩, 张绪元, 等. 海南不同来源赤芝多糖和三萜含量分析[J]. 中国农学通报, 2015, 31(31): 280-284.
[18] 黄伟, 王丽娟, 卢孟柱, 等. 杜仲叶酸性多糖EOP-1的分离纯化、结构解析[J]. 功能材料, 2014(3): 3 047-3 050.
[19] 王宏勋, 张雯, 颜克亮, 等. 复合枸杞灵芝菌丝体多糖体外抗氧化作用初步研究[J]. 中国食用菌, 2007, 26(3): 38-40.
[20] 许申鸿, 杭瑚, 郝晓丽, 等. 葡萄籽化学成分分析及其抗氧化性质的研究[J]. 食品工业科技, 2000(2): 18-20.
[21] 何晋浙, 邵平, 倪慧东, 等. 灵芝多糖结构及其组成研究[J]. 光谱学与光谱分析, 2010, 30(1): 123-127.
[22] HIROFUMI Maruyana. Antitumor activity Sarcodon aspratus Ganoderma Lucidum.karst[J]. pharmacobio-dyn, 1989, 12: 118-123.
[23] SASAKI T, ARAI Y, IKEKAWA T, et al. Antitumer polysaccharides from some polyporaceae, Ganoderma aplanatum and Phellinus linteus[J]. Aoshima Chem Pharm Bull(Tokyo), 1971, 19: 821-826.
[24] USUI T, IWASAKI Y, MIZUNO T, et al. Isolation and characterization of antitumor active B-D-glucans from the fruit bodies of Ganoderma applanatum[J]. Carbohydrate Res, 1983, 115: 273-278.
[25] 鲍素华, 查学强, 郝杰, 等. 不同分子量铁皮石斛多糖体外抗氧化活性研究[J]. 食品科学, 2009, 30(21): 123-127.
[26] 张志军, 李淑芳, 魏雪生, 等. 灵芝多糖清除自由基活性的研究[J]. 食品研究与开发, 2012, 33(3): 167-170.
[27] 杨德, 周明, 程薇, 等. 灵芝多糖提取纯化及抗氧化研究[J]. 湖北农业科学, 2010, 49(11): 2 883-2 886.
[28] 李响, 梁杰. 灵芝多糖抗氧化、抗皮肤衰老[J]. 中国组织工程研究, 2013(41): 7 272-7 277.
Study on isolation and antioxidant activity of the polysaccharide fromGanodermalucidum
XU Xue-feng1LIGui-juan2YANHao1ZHANGYu1ZHANGJing-chang3
(1.CollegeofBiologicalandChemicalEngineeringofHainanInstituteofScienceandTechnology,Haikou,Hainan571126,China; 2.InstituteofChemicalEngineeringofChangchunUniversityofTechnology,Changchun,Jilin130012,China; 3.FacultyofScienceofBeijingUniversityofChemicalTechnology,Beijing100029,China)
Isolation, purification and antioxidant activity in vitro of polysaccharide fromGanodermalucidumwere studied. Polysac-charide was extracted fromG.lucidum, and three fractions were isolated through ion exchange chromatography and allyl dextran gel chromatography from them, including GLPa-2, GLPb-1, and GLPc. The weight-average molecular weight was detected by gel permeation chromatographic, and then monosaccharide composition was detected by gas chromatography. The results were described as follows. The component parts of polysaccharides were composed of glucose, arabinose, xylose and mannose, with different containing rates, and the average molecular weight of GLPa-2, GLPb-1, GLPc was detected to be 3.65×105Da, 3.87×104Da, 1.38×104Da, respectively. Moreover, a dose-effect relation between the concentration of polysaccharides fraction and the eliminating ratio was also found, and GLPa-2, composed of glucose, arabinose, xylose, and mannose, the largest molecular among the three ones, showed the highest antioxidant activity. Thus it turned out that the antioxidant activity of polysaccharides fromG.lucidumwas related to their composition.
Ganodermalucidumpolysaccharides; isolate; molecular weigh; monosaccharide composition; antioxidant activity
海南省自然科学基金项目资助(编号:214034)
徐雪峰,男,海南科技职业学院讲师,江西理工大学在读硕士研究生。
李桂娟(1957-),女,长春工业大学教授,博士。 E-mail: 332175870@qq.com
2016—10—12
10.13652/j.issn.1003-5788.2017.01.033
