产β-苯丙氨酸变位酶基因工程菌的构建及其发酵条件优化
2017-03-14朱龙宝李艺雯段振超马琪森陶玉贵
葛 飞 唐 尧 朱龙宝 李艺雯 段振超 马琪森 陶玉贵
(安徽工程大学生物与化学工程学院,安徽 芜湖 241000)
产β-苯丙氨酸变位酶基因工程菌的构建及其发酵条件优化
葛 飞 唐 尧 朱龙宝 李艺雯 段振超 马琪森 陶玉贵
(安徽工程大学生物与化学工程学院,安徽 芜湖 241000)
构建β-苯丙氨酸变位酶基因表达重组质粒pET-28a-pam,并转化大肠杆菌BL21,获得β-苯丙氨酸变位酶基因重组菌。考察培养基初始pH、摇床转速、种龄、发酵时间以及装液量5个因素对β-苯丙氨酸变位酶基因工程菌产酶活性的影响,确定较佳发酵条件为:培养基初始pH 7.0、摇床转速200 r/min、发酵时间24 h、装液量50 mL/500 mL、种龄10 h。采用Box-Behnken试验设计,选择了种龄、初始pH、发酵时间3个对β-苯丙氨酸变位酶活力影响较大的因素进行响应面优化。优化结果为:在种龄12.8 h、初始pH 6.7、发酵时间25.2 h条件下,PAM活力达到11.15 U/mL,比优化前酶活4.87 U/mL提高了128.9%。
重组大肠杆菌;产酶条件;β-苯丙氨酸变位酶;发酵
β-苯丙氨酸氨基变位酶(β-Phenylalanine aminomutase,PAM)属于MIO-依赖氨基变位酶(MIO-dependent aminomutase),由于其特殊的催化特性可以在没有辅酶因子的情况下催化α-苯丙氨酸转化为β-苯丙氨酸[1-2]。β-苯丙氨酸可以作为食品添加剂改善食品香味,脱氢降解以后还可作为蜜饯的食品添加剂,改善蜜饯的口感风味,也可作为食品的无公害环保防腐剂。另外,β-苯丙氨酸还是目前最有效的抗癌药物紫杉醇(Taxol)合成中的重要前体物质之一,自然界中仅在植物红豆杉(Taxus L.)中发现含有PAM[3-4]。目前生产β-氨基酸的主要方法是化学拆分法和手性辅助剂合成法等[5-6]。这些方法合成过程复杂,生产成本高昂,产品需要多次结晶才能使用,且在生产过程中还会产生有毒有害的副产物,不能满足实际需求,利用分子生物学方法构建工程菌是未来高效、快速、安全生产的趋势[7-8]。目前中国对PAM的报道鲜有提及,国外研究主要集中在β-苯丙氨酸变位酶(PAM)生产β-苯丙氨酸的方法方面,Szymanski W等[9]利用PAM催化得到了α-苯丙氨酸与β-苯丙氨酸的1∶1的混合产物。Wu等[10]使用PAM的几种突变型酶进行比较,选择出了其中较高催化率的酶并研究探讨了其催化机制。虽然有利用PAM催化生产β-苯丙氨酸的验证以及机制原理研究,但未见利用重组大肠杆菌生产PAM并优化其发酵条件。因此构建PAM基因重组菌,并利用重组大肠杆菌生产PAM,优化其产酶条件具有一定的理论和实践意义。本研究拟构建PAM重组大肠杆菌,研究不同发酵条件对β-苯丙氨酸重组菌产酶的影响,并采用响应面法对发酵条件进行优化,以提高PAM重组菌的产量,利用分子生物学手段和优化发酵条件得到一种新型、环保、高效的β-苯丙氨酸的生产方式。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherichiacoli)BL21、质粒pET28a:本实验室保藏;
DH5α-pam:苏州金唯智生物科技有限公司;
限制性内切酶EcoRI、NdeI、Prime STAR DNA聚合酶:2.0×104units/mL,NEB公司;
SanPrep柱式质粒DNA小量抽提试剂盒、磁珠法DNA胶回收试剂盒、dNTP Mixture(每种8 μmol):生工生物工程(上海)技术有限公司;
T4 DNA连接酶:4.0×105units/mL,生工生物工程(上海)技术有限公司;
胰蛋白胨、酵母提取物:生物试剂,国药集团化学试剂有限公司;
葡氯化钴、氯化铜、氯化锰、乙二胺四乙酸、硼酸、乙酸锌、双氨基甲烷、十六烷基三甲基溴华胺:分析纯,国药集团化学试剂有限公司;
卡那霉素、α-苯丙氨酸、β-苯丙氨酸:生物试剂,生工生物工程(上海)技术有限公司。
1.2 主要仪器设备
组合式全温度震荡培养箱:QHZ-123B型,太仓市华美生化仪器厂;
数显恒温水浴锅:HH-6型,金坛市杰瑞尔电器有限公司;
无菌操作台:YJ-1450型,苏州工业园区三兴净化技术有限公司;
紫外可见分光光度计:JH-723型,上海菁华科技仪器有限公司;
台式低速离心机:L550型,湖南湘仪实验室仪器开发有限公司;
电子天平:YP-1002型,上海佑科仪器仪表有限公司;
数显pH计:PHSJ-3F型,上海精密科学仪器有限公司;
立式压力蒸汽灭菌锅:LDZX-50KBS型,上海申安医疗器械厂;
医用数控超声波清洗器:JK-2200型,合肥金尼克机械制造有限公司。
1.3 重组菌的构建
1.3.1 重组质粒pET-28a-pam的构建 依据NCBI所公布(https:// www.ncbi.nlm.nih.gov/nuccore/AY724735.1; GenBank编号:AY724735.1)的paPAM基因序列以及Lei等[11]的研究成果设计上下游引物,上游引物p1:5-GGAATTCCATATGATGGGGTTTGCCGTGGAATCGCGTTCTCACG-3';下游引物p2:5-CGGAATTCCTAGACGCCGTTGGCGCACCCA-TTTGGTTGG-3'。在LB培养基中隔夜培养DH5α-pam,利用SanPrep柱式质粒DNA小量抽提试剂盒提取其中质粒。使用50 μL体系在94℃预变性4 min、94℃变性1 min、58℃退火30 s、72℃延伸2 min条件下对其进行25个循环的PCR扩增,50 μL体系为:模板2 μL、Primerup 1 μL、Primerdown 1 μL、5×PSBuffer 10 μL、Prime STAR 0.5 μL、dNTPMixture 4 μL,利用无菌水补充到50 μL。PCR产物回收后使用EcoRI/NdeI在37℃恒温水浴锅中进行双酶切4 h,双酶切体系为:回收产物40 μL、EcoRI 0.5 μL、NdeI 0.5 μL、100×H Buffer 5 μL,利用无菌水补充到50 μL。电泳后使用磁珠法DNA胶回收试剂盒回收纯化含有目的基因的片段,将纯化产物与pET28载体在-16℃条件下进行连接,体系为:纯化产物7 μL、pET-28 1.5 μL、10×Buffer 1 μL、T4 DNA Ligase 0.5 μL。1.3.2 PAM重组菌的构建 使用氯化钙法制作BL21感受态细胞,利用构建出的表达载体pET-28a-pam和BL21感受态细胞进行KCM法转化,得到重组大肠杆菌。
1.4 培养基配制
种子培养基:酵母提取物5 g/L、胰蛋白胨10 g/L、氯化钠10 g/L、葡萄糖1 g/L、卡那霉素0.5 g/L,pH 7.0;发酵培养基:磷酸二氢钾13 g/L、葡萄糖20 g/L、硫酸镁1.3 g/L、柠檬酸1.7 g/L、氯化锰1.5 g/L、氯化铜1.5 g/L、硼酸3 g/L、高猛酸钠2.5 g/L、乙酸锌13 g/L、乙二胺四乙酸8.4 mg/L、氯化钴2.5 mg/L,pH 7.0。
1.5 培养方法
将菌种过夜活化后取1 mL放入50 mL种子培养基中,使用500 mL三角烧瓶进行摇床振荡培养12 h,培养条件为200 r/min、30℃。以10%的接种量将种子培养基接入到100 mL的发酵培养基中,使用500 mL的三角烧瓶在200 r/min、30℃的条件下进行培养。16 h后于42℃诱导表达4 h,30℃继续培养,直到可以检测出酶活。
1.6 酶活测定
1.6.1β-苯丙氨酸标准曲线的绘制 详细绘制方法见文献[12~13]。分别取浓度为480 μg/mL和620 μg/mL的β-苯丙氨酸标准液5 mL加入到10 mL比色皿中,再分别加入1 mL的茚三酮试剂使其充分混合均匀。使用数显恒温水浴锅在90℃下水浴25 min,冷却至室温。利用723型紫外可见分光光度计测量其在570 nm下的光吸光度,以标准液的吸光度和浓度作标准曲线。
1.6.2 测定方法 取5 mL菌种培养液4 000 r/min离心10 min,生理盐水清洗,再次离心,用10 mL的25 mmol/L Tris—HCl溶液彻底悬浮细胞。取1 mL的悬浮液,用0.5 g/L 的十六烷基三甲基溴化胺(CTAB)于30℃水浴10 min,3 000 r/min离心10 min。冲洗沉淀,并加入50 mmol/Lα-苯丙氨酸溶液2.5 mL和25 mmol/L Tris—HCl 2 mL,40℃条件下反应10 min,以0.2 mL 6 mol/L HCl溶液终止反应。离心后使用723紫外可见分光光度计测定其在570 nm下的吸光度。利用式(1)计算酶活:
(1)
式中:
U——酶活单位,U/mL;
V——反应体积,mL;
Mw——β-苯丙氨酸的分子质量;
C——β-苯丙氨酸的浓度,mg/L;
T——反应时间,min。
1.7 单因素试验设计
1.7.1 初始pH的确定 以1.4中发酵培养基配方,在30℃、接种量10%、种龄12 h、摇床转速200 r/min条件下,分别以初始pH值6.0,6.5,7.0,7.5,8.0振荡培养16 h。按1.6 的方法检测PAM酶活,考察初始pH对PAM酶活的影响。
1.7.2 种龄的确定 以1.4中发酵培养基配方,在30℃、接种量10%、初始pH 7.0、摇床转速200 r/min条件下,分别接种种龄为8,10,12,14,16 h的种子培养液于100 mL发酵培养基中振荡培养16 h。按1.6的方法检测PAM酶活,考察不同种龄培养液对PAM酶活的影响。
1.7.3 发酵时间的确定 以1.4中发酵培养基配方,在30℃、接种量10%、种龄12 h、摇床转速200 r/min、初始pH 7.0 条件下,分别于100 mL发酵培养基中培养20,22,24,26,28 h。按1.6的方法检测PAM酶活,考察发酵时间对PAM酶活的影响。
1.7.4 装液量的确定 以1.4中发酵培养基配方,在30℃、接种量10%、初始pH 7.0、摇床转速200 r/min、初始pH 7.0条件下,分别于25,50,75,100,125 mL培养基中培养16 h。按1.6的方法检测PAM酶活,考察装液量对PAM酶活的影响。
1.7.5 摇床转速的确定 以1.4中发酵培养基配方,在30℃、接种量10%、初始pH 7.0条件下,分别于100 mL发酵培养基中在160,180,200,220,240 r/min摇床速度下培养16 h。按1.6的方法检测PAM酶活,考察摇床转速对PAM酶活的影响。
根据单因素试验结果,分析各个因素对产PAM的较佳条件。选择对PAM产酶影响较大的3个因素,利用Design Expert软件设计三因素三水平的Box-Behnken试验,对种龄、初始pH、发酵时间3个发酵条件进行进一步优化。
2 结果与分析
2.1 PAM重组菌的构建
将构建菌株在37℃条件下培养1 h,然后涂布于抗性平板筛选阳性重组子。利用PCR进一步验证重组子,提取重组菌的质粒(结构示意图见图1),PCR扩增后使用EcoRI/NdeI进行双酶切。得到目的条带大小约为2 100 bp(见图2),与预期相符合,测序与NCBI所公布的paPAM基因序列相符。证明成功构建了含有目的基因的重组大肠杆菌。
2.2 单因素对重组菌产酶活的影响
2.2.1 初始pH对PAM酶活性的影响 由图3可知,初始pH低于6.5时,PAM的活性明显较低,可能与低pH值会影响菌株寿命和PAM酶活有关。在pH为6.5~7.0时,PAM酶活较高,pH为7.0时酶活最高达到5.77 U/mL;当pH超过7.0后,酶活呈下降趋势,说明过高pH也会抑制PAM酶活。

图1 pET-28a-pam结构示意图Figure 1 pET-28a-pam Structure diagram

M. DL10000 marker 1. pET-28a-pam 2. pET-28a-pam digested with EcoR I/Mde I

图3 初始pH值对PAM酶活性的影响Figure 3 Effects of initial pH value of fermentation medium on PAM activity
2.2.2 种龄对PAM酶活性的影响 由图4可知,接种种龄小于10 h时的种子液,PAM酶活性呈递增趋势。种龄10 h的发酵液PAM酶活达到最大值(5.36 U/mL),种龄超过10 h后,酶活呈现下降趋势。小于10 h的种子活力不够,生长速度较慢。10 h之后的种子开始老化,活力受到代谢副产物的影响进而导致酶活下降。
2.2.3 发酵时间对PAM活性的影响 由图5可知,发酵时间在20~24 h时,PAM酶活逐步增大,在发酵时间为24 h时,PAM酶活达到最大值(5.47 U/mL)。发酵时间超过24 h后,PAM酶活快速下降,可能与菌株培养时间过长,菌体老化,发酵后期大量生成其它发酵产物有关。
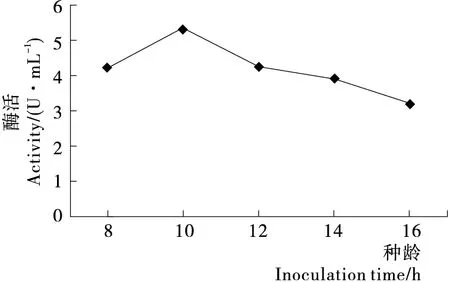
图4 种龄对PAM酶活性的影响Figure 4 Effects of inoculation time on PAM activity

图5 发酵时间对PAM酶活性的影响Figure 5 Effects of fermentation time on PAM activity
2.2.4 装液量对PAM活性的影响 由图6可知,在500 mL三角瓶中装入50 mL培养基进行培养时,发酵液中PAM酶活最高,为5.62 U/mL,装液量在50~100 mL时,PAM酶活缓慢递减,然后趋于稳定。这是由于装液量逐步增大时摇瓶内的溶解氧含量下降,较低的氧浓度影响了菌体生长和代谢产物积累,致使PAM酶活下降。
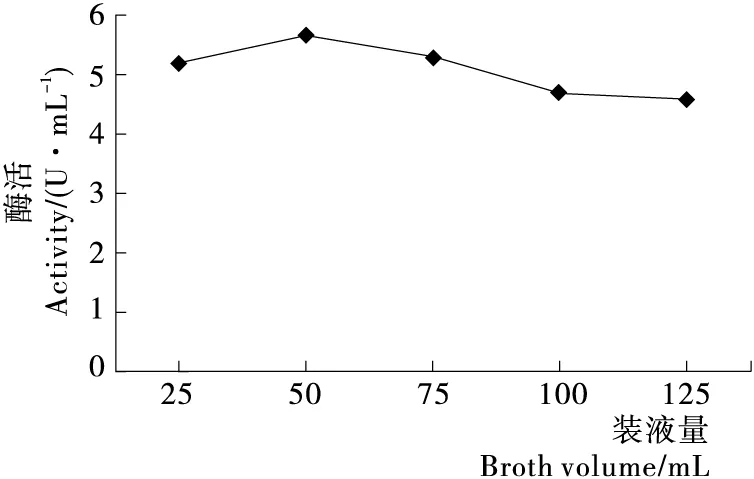
图6 装液量对PAM酶活性的影响Figure 6 Effects of broth volume on PAM activity
2.2.5 摇床转速对PAM活性的影响 由图7可知,摇床转速为200 r/min时,PAM酶活最大,为5.56 U/mL,大于或小于200 r/min时都会导致酶活下降。这是由于转速过低会导致溶解氧不足,菌株生长、代谢受到抑制;而转速过高会使菌株过快消耗培养基中的营养成分,初级代谢产物积累过快,影响PAM酶活性。
2.3 Box-behnken试验分析
根据单因素的试验结果,选取对PAM酶活影响较大的种龄、初始pH以及发酵时间作为优化对象。利用Design Expert软件设计出三因素三水平的方案,设计的试验因素和水平见表1。
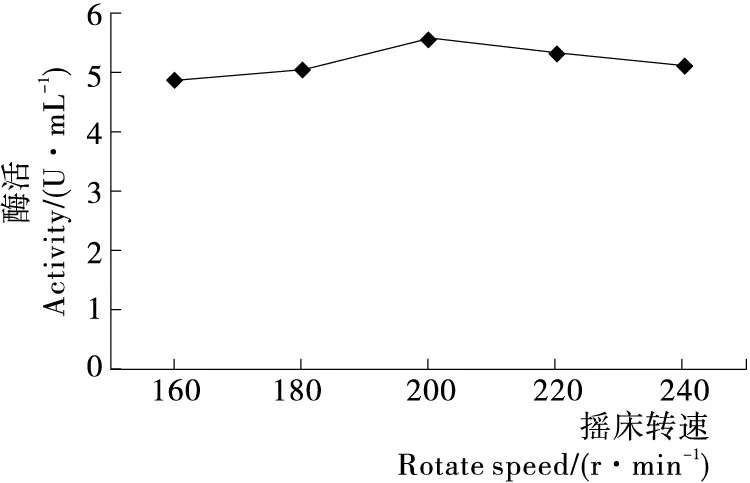
图7 摇床转速对PAM酶活性的影响Figure 7 Effects of rotate speed on PAM activity
以Y(PAM活性)为响应值,利用Design Expert软件分析表2中的试验结果,可以得到X1、X2、X3的三元二次回归方程:
(2)
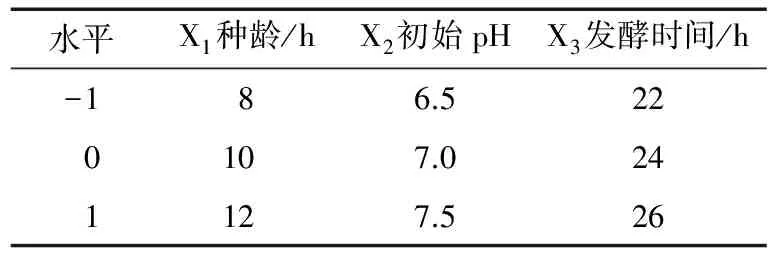
表1 中心组合试验三因素三水平表Table 1 Three main fermentation conditions and their three levels of optimization test based on central composition design principle
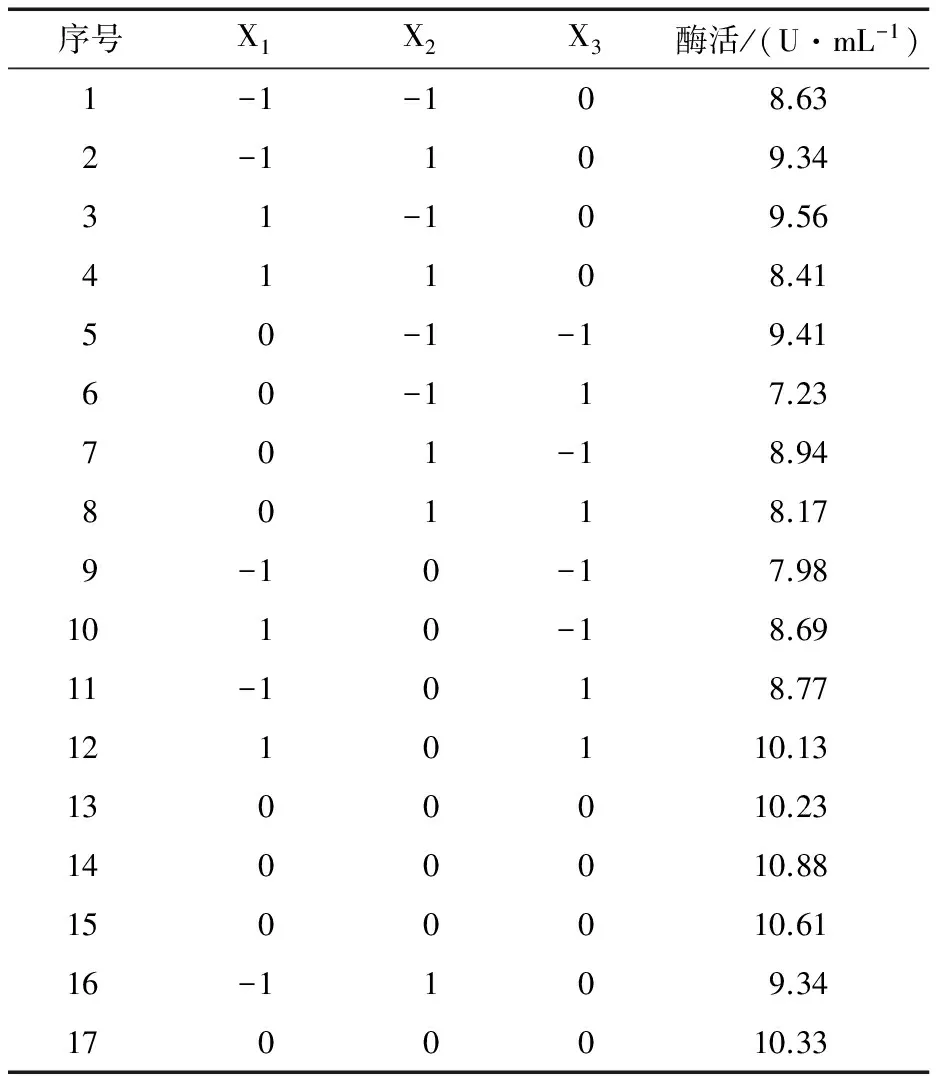
表2 Box-Behnken试验设计及结果表Table 2 Design and results of Box-Behnken

2.4 响应面分析
使用Design Expert软件进行响应面分析,可以得到种龄、初始pH、发酵时间3个因素两两之间影响的关系。由图8~10可知,每一个响应面都存在极值,即每一个影响因子对于PAM重组菌均存在一个最优条件;且等高线接近圆形,证明3个因素之间的交互作用不显著。
经软件计算,所选3个影响PAM产酶活性因素的最优组合为种龄12.8 h、初始pH 6.7、发酵时间25.2 h。上述3个数值均可以在实际操作中进行验证。
2.5 实验验证结果
在所得的最优组合条件种龄12.8 h、初始pH 6.7、发酵时间25.2 h条件下,重复进行3次实验,PAM酶活平均值为11.15 U/mL,与预测值误差为6.4%,误差值在10%以内,证明了利用响应面法优化重组菌产酶条件的准确性。在优化后发酵条件下,进行工程菌培养PAM酶活可达11.15 U/mL,比优化前提高了128.9%。

表3 参数估计及方差分析表†Table 3 Parameter estimates and analysis of regression equation obtained
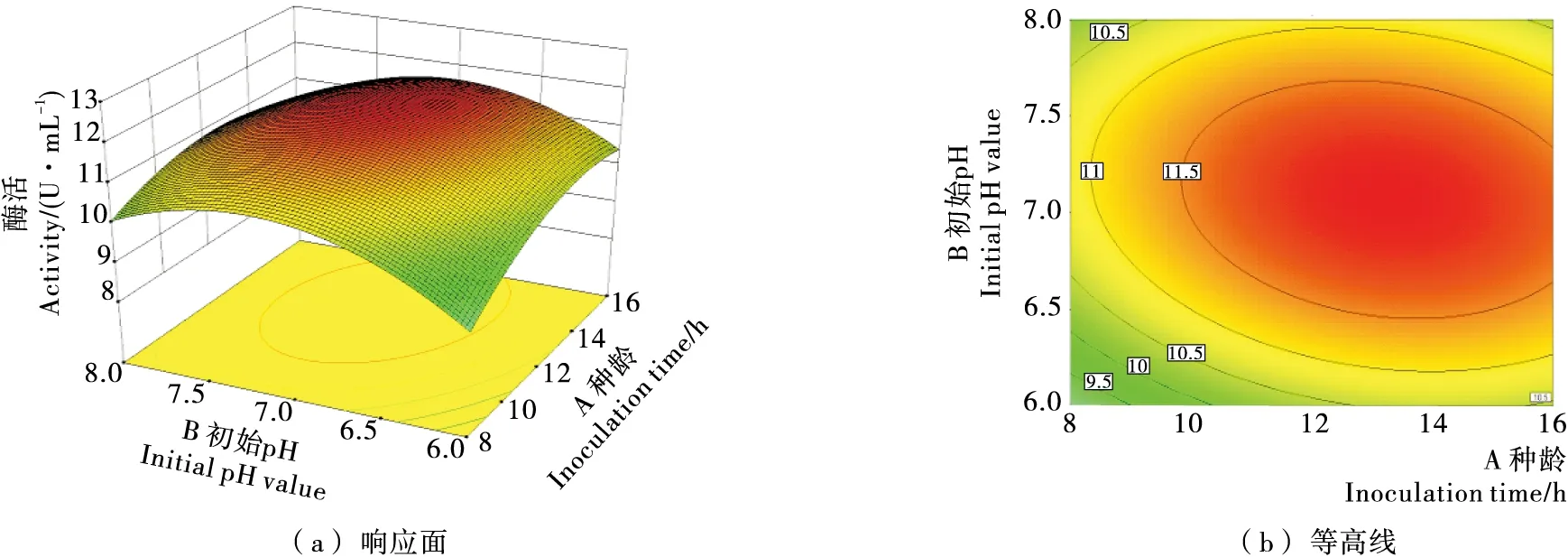
图8 种龄(A)和初始pH(B)交互影响PAM酶活性的响应面图Figure 8 RSD figure of inoculation time (A) and initial pH value(B) interacting on PAM activity
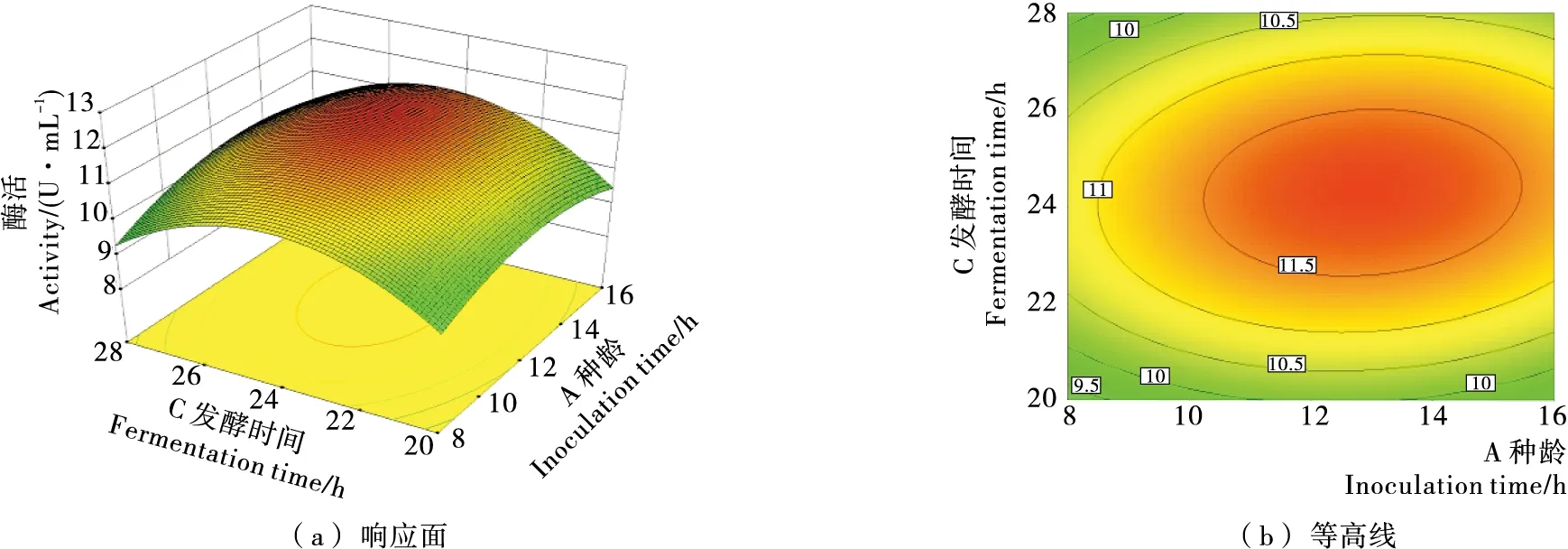
图9 种龄(A)和发酵时间(C)交互影响PAM酶活性的响应面图Figure 9 RSD figure of inoculation time(A) and fermentation time(C) interacting on PAM activity

图10 初始pH(B)和发酵时间(C)交互影响PAM酶活性的响应面图Figure 10 RSD figure of initial pH value(B) and fermentation time(C) interacting on PAM activity
3 结论
目前β-苯丙氨酸的主要生产方法为化学合成法,其技术也相对成熟,但是生物酶法具有安全、清洁、高效的特点有着巨大的优势,利用生物酶法制备β-氨基酸也被越来越多地关注。一些学者[11,14]在研究变位酶催化的机制,得到了关于PAM的催化机理以及催化特点,但仍然缺乏在生产、生活中利用PAM进行实际应用的研究,对β-苯丙氨酸日益增长的需求也未得到较好解决。
本试验利用分子生物学手段构建出产PAM重组大肠杆菌,并对PAM重组菌的产酶条件优化,确定了重组菌较佳单因素试验条件,即初始pH 7.0、种龄10 h、发酵时间24 h、装液量50 mL、摇床转速200 r/min。在此基础上,利用响应面法得到了3个较主要影响因素的最佳组合为种龄12.8 h、初始pH 6.7、发酵时间25.2 h,进一步促进菌株发酵液中PAM酶活提高,为PAM在实际生产中的应用提供了试验数据。然而,利用重组菌获得PAM还存在着产量低,菌株稳定性不高等问题,各种条件的优化也还在进一步探索之中,利用工程菌产酶优化的方法、PAM的催化条件都尚需深入研究。
[1] WANG Kang, HOU Qin-qin, LIU Yong-jun. Insight into the mechanism of aminomutase reaction: A case study of phenylalanine aminomutase by computational approach[J]. Journal of Molecular Graphics & Modelling, 2013, 46(46C): 65-73.
[2] CALABRESE J C, JORDAN D B, BOODHOO A, et al. Crystal structure of phenylalanine ammonia lyase: multiple helix dipoles implicated in catalysis.[J]. Biochemistry, 2004, 43(43): 11 403-11 416.
[3] WALKER K D, KLETTKE K, AKIYAMA T, et al. Cloning, heterologous expression, and characterization of a phenylalanine aminomutase involved in Taxol biosynthesis[J]. Journal of Biological Chemistry, 2004, 279(52): 53 947-53 954.
[4] 周华, 朱祺, 杨艳芳, 等. 红豆杉分子生物学研究进展[J]. 植物生理学报, 2014(4): 373-381.
[5] DUURSMA A, MINNAARD A,FERINGA J, et al. Conversion of 1,4 adducts into versatile chiral building blocks[J] J. Am. Chem. Soc., 2003, 125: 3 700-3 701.
[6] HOOK D F, GESSIER F, NOTI C, et al. Probing the proteolytic stability of beta-peptides containing alpha-fluoro- and alpha-hydroxy-beta-amino acids[J]. Chembiochem, 2004, 5(5): 691-706.
[7] 曾伟川, 许瑞安, 曾庆友.β-氨基酸合成研究进展[J]. 合成化学, 2013, 21(5): 634-644.
[8] 李秀娟, 尹玲, 李秀珍, 等. 植酸酶毕赤酵母基因工程菌发酵条件的优化[J]. 食品与机械, 2010, 26(3): 11-13, 27.
[9] SZYMANSKI W, WU Bian, WEINER B, et al. Phenylalanine Aminomutase-Catalyzed Addition of Ammonia to Substituted Cinnamic Acids: a Route to Enantiopureα- andβ-Amino Acids[J]. Journal of Organic Chemistry, 2009, 74(23): 9 152-9 157.
[10] WU Bian, SZYMANSKI W, WYBENGA G G, et al. Mechanism-inspired engineering of phenylalanine aminomutase for enhancedβ-regioselective asymmetric amination of cinnamates.[J]. Angewandte Chemie International Edition, 2012, 51(2): 482-486.
[11] LEI Feng, WANNINAYAKE U, STROM S, et al. Mechanistic, mutational, and structural evaluation of a Taxus phenylalanine aminomutase[J]. Biochemistry, 2011, 50(14): 2 919-2 930.
[12] 韩秋敏. 比色法测定β-苯丙氨酸含量的研究[J]. 安徽农业科学, 2008, 36(35): 15 294-15 296.
[13] 牛广财, 闫公昕, 朱丹, 等. Folin-Ciocalteu比色法测定沙棘酒中总多酚含量的工艺优化[J]. 食品与机械, 2016, 32(4): 80-83, 142.
[14] RATNAYAKE N D,WANNINAYAKE U,GEIGE H, et al. Stcreochemistry and mechanism of a microbial phcnylalanine aminomutase[J]. J. Am. Chem. Soc., 2011, 133: 8 531-8 533.
Construction of recombinant E coli. of producingβ-phenylalanine aminomutase and optimization of fermentation conditions
GE FeiTANGYaoZHULong-baoLIYi-wenDUANZhen-chaoMAQi-senTAOYu-gui
(CollegeofBiologyandChemicalEngineering,AnhuiPolytechnicUniversity,Wuhu,Anhui241000,China)
The genetic engineering strain with recombinant plasmid pET-28a-pam was expressed inE.coliBL21. The fermentation conditions of initial pH, shaking speed, inoculation time and fermentation time were optimized with the PAM activity by using single factor. The results showed that the optimal fermentation conditions were initial pH 7.0, 200 r/min, the tenth hour broth and liquid volume 50 mL/500 mL, fermented for 24 h. Furthermore, the three factors were optimized by Box-Behnken design, and the results showed that inoculation time, initial pH and fermentation time are main affecting factors and their optimal levels are 12.8 h, 6.7 and 25.2 h. Under the optimal conditions, th activity of PAM reached 11.15 U/mL, improved by 128.9% compared with that under initial culture conditions.
RecombinantEcoli.; Enzyme production conditions;β-phenylalanine aminomutase; fermentation
国家自然科学基金面上项目(编号:31671797);安徽省高等学校省级自然科学研究重点项目(编号:KJ2016A801);国家级大学生创新创业训练计划项目(编号:201510363072)
葛飞(1978—),男,安徽工程大学副教授,博士。 E-mail: gerrylin@126.com
2016-12-17
10.13652/j.issn.1003-5788.2017.01.004
