常压室温等离子体快速诱变选育高产单宁酶菌株
2017-03-14吴鑫颖邱树毅周罗娜任佳明
熊 进,吴鑫颖,邱树毅,*,简 辉,周罗娜,任佳明
(1.广州市微生物研究所,广东广州 510663;2.贵州大学酿酒与食品工程学院,贵州贵阳 550025)
常压室温等离子体快速诱变选育高产单宁酶菌株
熊 进1,2,吴鑫颖2,邱树毅2,*,简 辉2,周罗娜2,任佳明2
(1.广州市微生物研究所,广东广州 510663;2.贵州大学酿酒与食品工程学院,贵州贵阳 550025)
采用常压室温等离子体诱变技术处理黑曲霉B0201,选育高产单宁酶突变株,为单宁酶的发酵生产提供优良菌株。确定等离子体处理条件,采用稀释平板培养法挑选突变株,利用变色圈法和分光光度法测定产酶量,获得最佳诱变时间为180 s,正突变率高达19%。通过2%的高浓度单宁酸显色平板初筛850株菌,液态摇瓶发酵复筛90株菌,得到高产单宁酶的菌株B1401。诱变后单宁酶酶活为17.61 U/g,是原始菌株酶活8.94 U/g的2倍左右,且传代菌种产单宁酶稳定性良好。
单宁酶,黑曲霉,常压室温等离子体,诱变选育
单宁酶(Tannase,EC 3.1.1.20),能够水解单宁中的酯键和缩酚酸键,被广泛应用于精细化工、皮革、饲料、制药、食品饮料等领域。美国食品与药物管理局已经确定单宁酶为安全食品,其在日本也被批准可以用于食品工业。单宁酶是一种诱导酶,可由某些微生物在单宁酸等诱导物存在的条件下诱导合成[1]。目前仅有少数公司实现商业化生产单宁酶,主要有印度百康公司、日本龟甲万公司、德国ASA特别酶有限公司[2],能够实现工业化生产单宁酶,具有重要的经济价值和实际意义。
国内暂时没有实现商业化生产单宁酶,其主要与菌株产单宁酶活性不高、产酶不稳定及分离纯化困难有关[3-5]。利用现代生物技术选育高产、高活力、能稳定遗传的菌株成为研究热点。常用于提高菌株产单宁酶的诱变方法有紫外线、N+离子注入、3-硝基-5-甲胍、硫酸二乙酯等,但其诱变方法对操作人员有一定的危险性,且诱变方法普遍对酶活提高不大,菌种遗传稳定差等特点。
常压室温等离子体育种机(ARTP)作用于微生物,能产生温度低、均匀、种类丰富的等离子射流,具有突变高效、操作简单、人员安全等特点,已有研究表明该诱变技术易获得遗传稳定性良好的突变株[6],对多种菌株具有较好的诱变效果[7-8]。本文采用常压室温等离子体快速诱变系统对黑曲霉的孢子悬浮液进行诱变,通过建立改良平板初筛培养基以及菌种保藏培养基的方法,并采用摇瓶发酵测酶活复筛,以期筛选出传代菌种产单宁酶稳定性良好的高产突变株。
1 材料与方法
1.1 材料与仪器
蔗糖、葡萄糖、硝酸钠、磷酸氢二钾、七水硫酸镁、氯化钾、硫酸亚铁、琼脂、柠檬酸、柠檬酸三钠、溴酚蓝等试剂 分析纯,国药集团;单宁酸 分析纯,天津光复精细化工研究所;黑曲霉B0201(AspergillusnigerB0201) 由贵州省发酵工程与生物制药重点实验室紫外诱变原始黑曲霉菌株筛选出来,菌种在4 ℃条件下保存在察氏斜面培养基上。
常压室温等离子体(ARTP)诱变系统Ⅱ 无锡思清源生物科技有限公司;UV-2550紫外可见分光光度计 苏州仪器有限责任公司;XW-80旋涡混合仪 海门市其林贝尔仪器制造有限公司。
1.2 实验方法
1.2.1 培养基配制 察氏液态培养基:按常规配方配制。
1.2.1.1改良后的平板初筛培养基 蔗糖10 g/L、硝酸钠3 g/L、磷酸氢二钾1 g/L、七水硫酸镁0.5 g/L、氯化钾0.5 g/L、硫酸亚铁0.01 g/L、琼脂40 g/L、单宁酸20 g/L、溴酚蓝0.04 g/L,调节pH=5.5左右。
1.2.1.2 改良后的菌种保藏斜面培养基 蔗糖20 g/L、硝酸钠3 g/L磷酸氢二钾1 g/L、七水硫酸镁0.5 g/L、氯化钾0.5 g/L、硫酸亚铁0.01 g/L、琼脂30 g/L、单宁酸10 g/L,调节pH=5.5左右。
1.2.1.3 基础发酵液态培养基 单宁酸40 g/L、葡萄糖25 g/L、(NH4)2SO410 g/L、MgSO4·7H2O 1 g/L、NaCl 1 g/L,pH5.0。
1.2.2 孢子悬浮液的制备 实验室保存的黑曲霉B0201(AspergillusnigerB0201)菌种,转接入菌种斜面保藏培养基中30 ℃培养4 d,获得出发菌株。将斜面培养基活化好的菌种,加入10 mL的生理盐水洗脱孢子,经无菌脱脂棉,放入含有察氏液态培养基的三角瓶中,用玻璃珠将孢子充分打散,30 ℃、150 r/min充分培养使孢子萌发,等待孢子处于刚刚萌发状态,取此状态的孢子作为诱变对象。并将孢子浓度调整到107个孢子/mL,取0.5 mL菌悬液于1.5 mL灭菌的EP管中,并充分振荡混匀,作为原液。
1.2.3 ARTP系统诱变方法 利用清华大学化工系自主开发的常压室温等离子体育种机(ARTP)对黑曲霉的孢子悬浮液进行诱变。该装置操作简单,在一定的电源功率、工作气流量、等离子体发射源与样品之间距离的条件下,诱变主要的可变操作参数是处理时间[9]。本装置主要以氦气为工作气体,在下文的ARTP操作条件下,要获得致死率曲线,寻找最佳的诱变条件。因此,取孢子悬浮原液10 μL均匀涂布于ARTP系统无菌金属片上,将金属片移至处理仓内,调节金属片的位置,设定仪器输入电压(100 W)、处理距离(2 mm)、气体流入速率(12 L/min)、处理时间(30、60、90、120、150、180、210、240、270、300 s)等参数。一次处理时间从30 s开始依次增加直到300 s,取在金属片上各不同照射时间的样品用无菌水稀释一定倍数,利用旋涡混合仪使稀释液混合均匀并取100 μL涂布初筛平板,每个稀释度做三个平行,以未经ARTP处理的孢子悬浮原液(处理0 s)涂布的平板做对比,利用CFU方法来计算致死率和正突变率。具体计算公式如下:
致死率(%)=(诱变前形成的菌落数-诱变后形成的菌落数)/诱变前形成的菌落数×100
加强县乡人大工作和建设是坚持和完善人民代表大会制度、加强基层国家政权建设的可靠保证。在中国特色社会主义进入新时代这一新的历史条件下,县乡人大只有与时俱进、创新发展,才能为社会主义民主法治建设作出新的更大贡献。
正突变率(%)=正突变的菌株数/诱变后的活菌落数×100
1.2.4 筛选方法
1.2.4.1 平板初筛 将经过ARTP育种机一次诱变后的孢子悬浮液,稀释一定倍数并振荡均匀后涂布于改良后的平板初筛固体培养基上。在30 ℃条件下培养,每天定时观察,待平板上出现明显菌落后,将单一菌落转移入一个灭菌后的初筛固体培养皿正中央继续培养3 d左右,测定菌落周围由紫色变为黄色变色圈直径(H)与菌落直径(D)的大小,以H/D比值初步衡量菌株产单宁酶的能力大小。然后挑选出H/D比值较大的菌落进行纯化并保存于斜面试管中[10]。
1.2.4.2 复筛 将初筛所得菌株接种于基础发酵液态培养基中,接种量1 mL(108个孢子/mL)、装液量50 mL,四层无菌纱布封口,30 ℃、140 r/min的摇床培养,每瓶加入适量的玻璃珠,发酵3 d,测定胞内酶酶活。
1.2.5 胞内粗酶液的制备方法 将发酵物进行过滤,收集发酵菌丝,先用蒸馏水冲洗三遍,然后再用pH5.0的柠檬酸缓冲溶液(0.05 mol/L柠檬酸和0.05 mol/L柠檬酸三钠混合配制)冲洗三次,尽量排除水分,保存菌丝。将菌丝均分为两部分,一部分在70 ℃烘干4 h,便于测定菌体干重;另一部分用于测定酶活,首先将收集到的菌丝体冷冻2 h左右,再将菌丝、石英砂、柠檬酸缓冲液按质量比1∶1∶5在冰浴的条件下充分研磨破碎细胞,在4 ℃低温6000 r/min离心机下离心20 min,最后收集离心上清液定容到25 mL作为待测胞内酶粗酶液。
1.2.6 酶活的测定 酶活的测定参考Shweta Sharma[11]和保玉心[12]的检测方法,并做相关改进。取三支洁净的试管分别标记为空白管、测试管、对照管。40 ℃水浴预热底物10 mmol/L没食子酸丙酯以及粗酶液5 min。在三支试管中都加入0.25 mL没食子酸丙酯溶液,将0.25 mL、0.05 mol/L、pH=5.0的柠檬酸缓冲液加入到空白管中,将0.25 mL粗酶液加入到测试管中,后将三支试管都放入40 ℃水浴中准确计时10 min,期间要摇晃混合均匀。然后在所有试管中都准确加入0.3 mL甲醇绕丹宁(0.05 mol/L)溶液,40 ℃水浴中保温5 min,再取浓度为0.5 mol/L的KOH的溶液0.2 mL加入所有试管中,在40 ℃水浴中保温5 min,立即仅在对照管的反应混合物中加入0.25 mL粗酶液。最后每支试管都用4 mL蒸馏水稀释,在40 ℃下保温5~10 min后,在520 nm波长下用蒸馏水做空白,测定反应混合物的吸光值。所有测试都做3个平行实验,取算术平均值。
酶单位活力(U)定义为:在40 ℃、pH5.0的条件下,每分钟产生1 μmol没食子酸所需的酶量定义为一个酶活单位。
相对酶活(U/g)定义为:每克菌体干重(70 ℃烘干4 h)具有的酶活力。
2 结果与分析
2.1 ARTP诱变时间对黑曲霉B0201孢子致死率、正突变率的影响
通过菌落计数以及测定酶活,统计出正突变株数目。以致死率(%)和正突变率(%)为纵坐标,时间(s)为横坐标可作出这株菌进行常压室温等离子体诱变的情况,见图1。
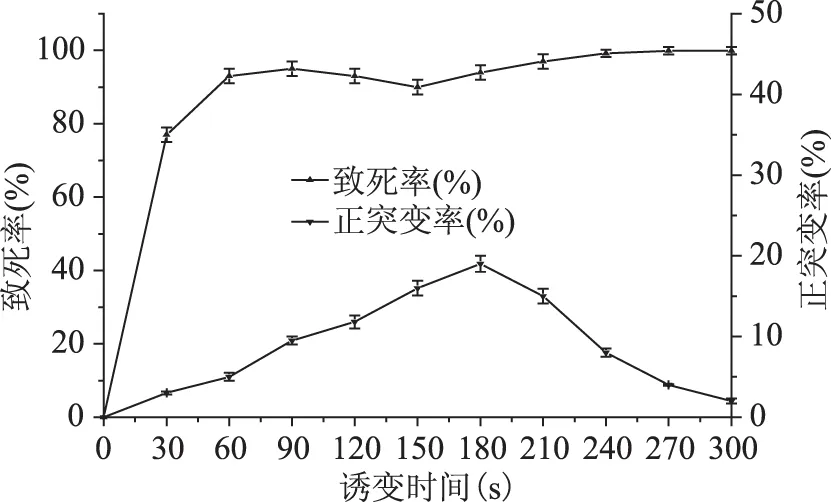
图1 ARTP诱变时间对黑曲霉孢子致死率、正突变率的影响Fig.1 Influence of ARTP radiation time on mortality and mutation rate on Aspergillus niger
图1所示,对黑曲霉的孢子ARTP诱变处理,随着时间的递增,菌体的致死率在前90 s急剧上升,处理90 s时致死率接近95%,说明黑曲霉孢子对诱变很敏感;处理150 s时,致死率出现了下降达到90%,这可能是因为微生物自我修复功能起作用;处理210 s以后致死率达到97%左右;处理300 s致死率接近100%,致死率曲线与刘燕等[13]采用ARTP诱变黑曲霉致死率曲线图形趋势相吻合。常压室温等离子体诱变系统产生均匀而温和的等离子体射流,引发种类丰富的DNA损伤并且获得大容量突变库[14],然而突变的发生具有随机性,致死率和正突变之间的关系没有直接的线性关系,正突变的发生可能与其诱变参数和菌株特性相关。
实验通过筛选得出正突变菌株数与存活菌株数的比值得到正突变曲线,与肖建成等[15]采用ARTP诱变黑曲霉菌株正突变株最高达28%的正突变率曲线图形趋势相吻合。由图1随诱变处理时间在180 s时,正突变率有最大值达到19%,与致死率下降时处理时间为150 s稍微延后,可能是微生物内部一个修复并调整的过程。本实验为了便于挑选最有可能的单菌落,在180 s时修复机制产生正突变最佳时,选择此时的条件参数进行筛选,正突变率相对较多。
2.2 黑曲霉突变体的初筛
在S Bradoo和郭鲁宏等人的研究基础上,诱变前后采用2%的单宁酸和1%的蔗糖为平板初筛唯一碳源来源,并且加入了少量溴酚蓝,培养基3 d,颜色开始由紫色变为黄色,在菌落周围形成明显的变色圈,变色圈直径和菌落直径大小同该菌之产酶水平呈相关性,根据计算出来的比值作为出发菌株进行复筛。在相同生长时间和条件下,诱变前后结果见图2和图3。

图 2诱变前Fig.2 Before radiation

图3 诱变后Fig.3 After radiation
通过图2与图3诱变前后的比较,诱变后有明显的变色圈,并且菌株在相同浓度单宁酸的培养基中生长能力较强,菌落直径与诱变前相比变大。说明黑曲霉通过诱变后产酶能力提高。
根据观察,初步挑选变色圈较大的菌株,测定变色圈直径(H)和菌落直径(D),以H/D比值来衡量菌株产单宁酶的能力大小,从850株菌株中挑选H/D比值比较大或者形态较为特殊的90株,透明圈直径和菌落直径大小及H/D比值见表1。其中原菌株为出发菌株B0201,其他编号分别代表不同的菌株。
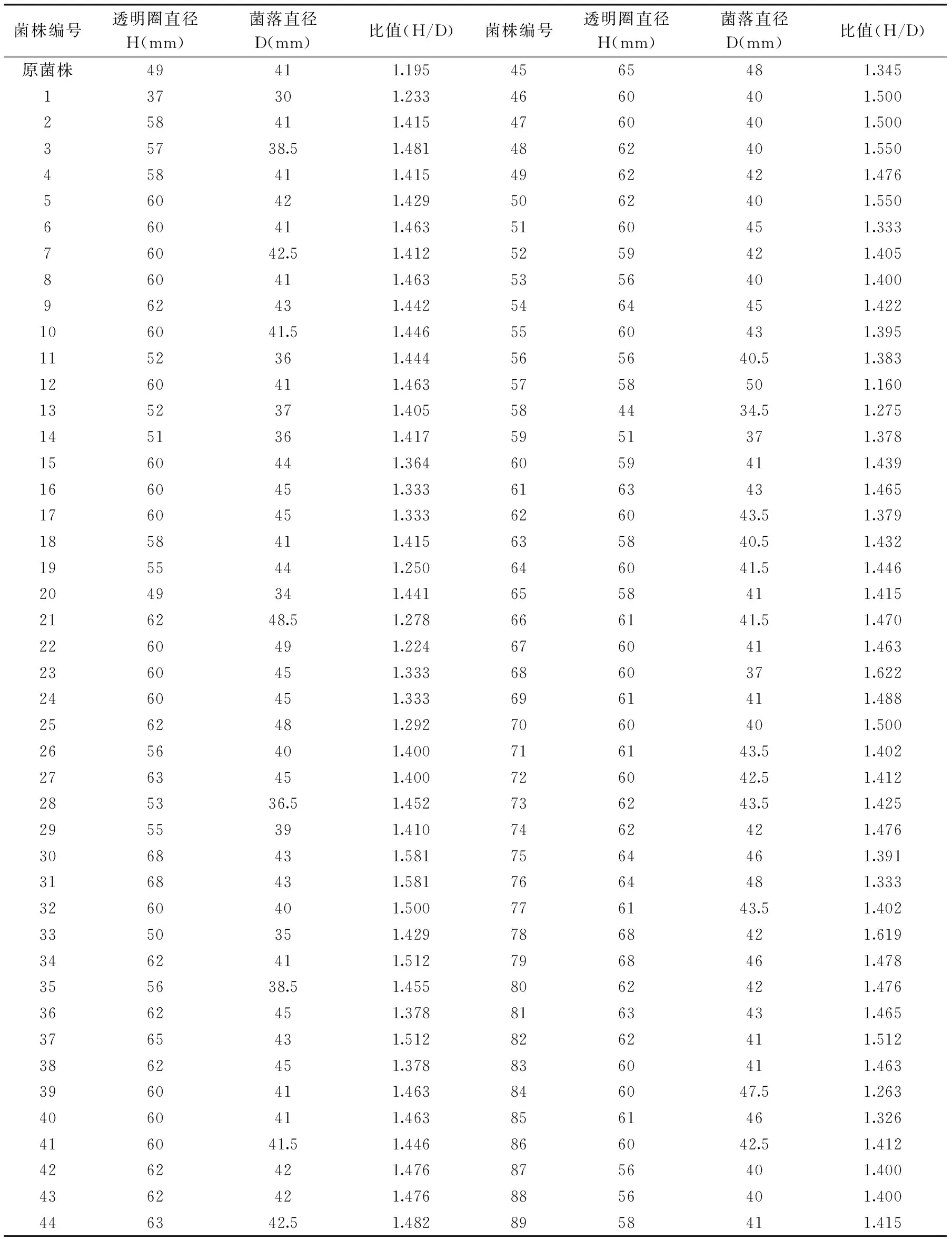
表1 初筛结果Table 1 Screening results
注:测量直径误差为±1 mm。。
由表1可知,挑选的850株菌株在筛选平板上筛选,通过观察变色圈大小、挑选测量透明圈和菌落直径较佳的菌落,计算出H/D比值。透明圈直径和菌落直径都有不同程度上的变化,初步根据形态大小和H/D比值大小作为标准。由表1可知,H/D比值小于1.2的只有2菌株,H/D比值在1.2至1.3之间的有7株,H/D比值在1.3至1.4之间的有16株,H/D比值在1.4至1.5之间的有52株,H/D比值在1.5至1.6之间的有11株,H/D比值在1.6以上的有2株;筛选的菌株H/D比值大多数落在1.4值1.5之间,其中H/D比值最大的为1.622,最小为1.16。由于在平板初筛的过程中,平皿中培养基的厚薄、直径测量误差、单菌落转移时占区域存在的误差,导致H/D比值只能作为反应酶活的重要参数。因此将筛选得到90株菌株进行复筛实验。

表2 复筛结果Table 2 Rescreening results

表3 产酶稳定性Table 3 Enzyme production stability
2.3 黑曲霉突变体的复筛
发酵完成后,对胞内粗酶液进行酶活测定,其测定结果详见表2。
由表2可知,初步挑选出90株菌株,然后摇瓶发酵,共筛选出11株产酶较高的菌株,菌株编号分别是8、23、40、42、44、60、64、71、79、80、87,其中91%的菌株来自H/D比值为1.4至1.5之间,说明H/D比值较高或较低都不利于得到高产单宁酶菌株,对多次诱变筛选具有指导意义。复筛得到最大酶活为菌株编号40(初步命名为B1401)达到17.61 U/g,是原始出发菌株酶活8.94 U/g的2倍左右。
2.4 菌株的遗传稳定性
B1401经过10次连续传代培养,结果见表3。
采用ARTP诱变一次的菌株,筛选获得的菌株经过改良后的菌种保藏斜面培养基保藏菌种,经10次连续传代酶活基本保持稳定,说明通过ARTP诱变技术处理获得的菌株B1401性能稳定,改良的菌种保藏培养基良好。
3 结论
由于通过紫外线获得的单宁酶产生菌B0201经过几年研究多次传代,产单宁酶酶活力下降较大,故将常压室温等离子体诱变技术应用于单宁酶产生菌B0201的诱变选育,突破了传统的理化诱变方法,为黑曲霉菌株诱变提供了新的思路和技术手段,诱变后表现出良好效果。实验利用黑曲霉孢子刚刚萌发的状态进行诱变,黑曲霉孢子对诱变处理比较敏感,在90 s致死率达到95%以上;诱变处理时间180 s时,正突变率达到最大值19%。实验通过改良的平板筛选培养基以及菌种保藏斜面培养基,筛选获得850株菌,根据H/D比值较大的或形态较为特殊的菌株挑选出90株菌,对其液态摇瓶发酵复筛,得到产单宁酶菌株B1401,其中产酶较高的菌株中有91%的菌株来自H/D比值为1.4至1.5之间。单宁酶产酶菌株B1401,液态摇瓶发酵产单宁酶酶活为17.61 U/g,是原始菌株酶活8.94 U/g的2倍左右。经过10次传代培养,菌株产单宁酶酶活力表现出较高的稳定性。为了更好的获得优良菌株,可以分批次的继续采用常压室温等离子体诱变技术进行再次诱导。
[1]Roopali N Bhoite,Navya P N,Pushpa S Murthy.Purification and Characterisation of a Coffee Pulp Tannase Produced byPenicilliumverrucosum[J].Journal of Food Science and Engineering,2013(3):323-331.
[2]Mónica Chávez-González,Luis V Rodríguez-Durán,Nagamani Balagurusamy,et al. Biotechnological advances and challenges of tannase an overview[J]. Food and Bioprocess Technology,2012,5(2):445-459.
[3]Raghavendra P Gaikaiwari,Shilpa A Wagh,Bhaskar D Kulkarni. Extraction and purification of tannase by reverse micelle system[J].Separation and Purification Technology,2012,89:288-296.
[4]Luis V Rodríguez Durán,Darío Spelzini,Valeria Boeris,et al.Interaction of tannase from Aspergillus niger with polycations applied to its primary recovery[J].Colloids and Surfaces B:Biointerfaces,2013,110:480-484.
[5]Arijit Jana,Chiranjit Maity,Suman Kumar Halder,et al. Enhanced tannase production by Bacillus subtilis PAB2 with concomitant antioxidant production[J].Biocatalysis and Agricultural Biotechnology,2013,2(4):363-371.
[6]Li G,Li H P,Wang L Y,et al.Genetic effects of radio-frequency,atmospheric-pressure glow discharges with helium[J]. Appl Phys Lett,2008,92(22):221504-221507.
[7]薛刚,陈利娟,吴斌,等. ARTP诱变选育高温蛋白酶高产菌株及其酶学性质研究[J].食品工业科技,2015,36(1):177-180,206.
[8]杨颖,玉王宁,金一,等.常压室温等离子体快速诱变绿色糖单孢菌筛选木聚糖酶高产菌株及其酶学性质研究[J].微生物学通报,2013,40(5):905-915.
[9]金丽华,方明月,张翀,等.常压室温等离子体快速诱变产油酵母的条件及其突变株的特性[J].生物工程学报,2011,27(3):461-467.
[10]张秋卓,蔡伟民.纤维素酶高产菌株的复合交替诱变选育[J]. 工业微生物,2008,38(6):32-37.
[11]Shweta Sharma,T K Bhat,R K Dawra. A Spectrophotometric Method for Assay of Tannase Using Rhodanine[J].Analytical Biochemistry,2000,279;85-89.
[12]保玉心,邱树毅,李秧针,等.一种胞外单宁酶的活力检测方法[J]. 精细化工,2008(6):621-624.
[13]刘燕,杨建松,王露,等.等离子诱变选育柠檬酸高产菌[J].天津科技大学学报,2014,29(1):16-19.
[14]张秀敏.食品微生物育种新技术--常压室温等离子体微生物基因组快速突变技术的开发难点和育种优势--清华大学化工系副主任、生物化工研究所所长邢新会教授专访[J].乳业科学与技术,2013(1):1-2.
[15]肖建成,陈楠,江慰,等.ARTP诱变及高效筛选高产葡萄糖氧化酶菌株[J].食品与生物技术学报,2016,35(5):525-530.
中科院建立工业产油微藻基因敲低技术
微藻通过光合作用将二氧化碳、光和水转化为油脂,因此,作为一种潜在的清洁能源生产和二氧化碳高值化方案,工业产油微藻受到了广泛关注。然而,藻类高效遗传工具的匮乏,一直是工业产油微藻分子育种和光驱固碳合成生物技术的重要瓶颈之一。中科院青岛生物能源与过程研究所(以下简称青岛能源所)与中科院水生生物研究所合作,以微拟球藻为模式,率先建立了工业产油微藻基因敲低技术。这里的微拟球藻是一种可利用海水或淡水在室外大规模培养的工业微藻,具有生长速度快、二氧化碳耐受能力强、强劲积累油脂和高值不饱和脂肪酸等优点,因此已经成为能源与经济微藻领域的研究模式藻种之一,也成为国内外许多微藻固碳示范工程的优先选择。
青岛能源所单细胞中心博士后学者魏力告诉《中国科学报》记者:“然而反向遗传工程技术的匮乏,从根本上阻碍了针对二氧化碳固定能力和产油效率等诸多工业性状的遗传改造。”为此,魏力带领的研究小组在海洋微拟球藻中,基于RNA干扰技术,通过设计靶基因的反向重复序列,形成特异茎环结构,实现了碳酸酐酶和碳酸氢盐转运蛋白等碳代谢相关基因的高效、特异性敲低,基因沉默株构建的成功率达到40%以上。在水生生物研究所研究员胡晗华的指导下,魏力通过重亚硫酸测序方法,发现在基因沉默株中,靶基因的特定区域展示出独特的甲基化规律,从而揭示了靶基因沉默的分子机制。研究人员还证明该技术对于另一海洋微拟球藻藻株CCMP1779也同样高效,表明该技术具有通用性。早在今年8月19日,《植物学杂志》(The Plant Journal)就报道了青岛能源所单细胞中心以微拟球藻为模式,率先建立了基于Cas9/gRNA的工业产油微藻基因组编辑技术,打开了其反向遗传工程的大门。日前,The Plant Journal再次以技术进展(Technical Advance)的形式,刊登该研究团队在微拟球藻遗传工程方法学平台的突破。青岛能源所单细胞中心主任徐健告诉记者:“靶向基因敲低技术和基因组编辑技术各有特色、优势互补,因此两个技术平台的建立、联用和业界共享将推动工业固碳微藻合成生物学的发展,也将对能源微藻分子育种技术产生积极而深远的影响。”
摘自:中国科学报
The rapid mutant strains of high tannase yield obtained by atmospheric and room temperature plasmas
XIONG Jin1,2,WU Xin-ying2,QIU Shu-yi2,*,JIAN Hui2,ZHOU Luo-na2,REN Jia-ming2
(1.Guangzhou Institute of Microbiology,Guangzhou 510663,China;2.College of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China)
Atmospheric and room temperature plasmas(ARTP)was used to induceAspergillusnigerB0201,in order to obtain mutant strains with enhanced ability to produce tannase. The optimal treatment condition were determined,and dilution pate culture method was used to screen mutant strains. The color changing circle method and spectrophotometry was used to analyze tannase production,and the best mutation time was 180 s,and the positive mutation rate was 19%. The high concentration of 2% tannic acid was utilized for color plate screening 850 strains. 90 strains of bacteria were screened by liquid shake flask fermentation,and the strain of extraordinary yield of B1401 was achieved. After the mutation,the enzyme activity was 17.61 U/g,which was about double as much as that of the original strain 8.94 U/g,and the stability of the enzyme production was good.
tannase;Aspergillusniger;atmospheric and room temperature plasma;mutation breeding
2016-06-08
熊进(1989-),男,硕士,助理工程师,研究方向:制药与发酵工艺,E-mail:591538059@qq.com。
*通讯作者:邱树毅(1963-),男,博士,教授,研究方向:应用生物技术,E-mail:syqiu@gzu.edu.cn。
国家高技术研究发展计划(863 计划)项目(2014AA021802)。
TS201.3
A
:1002-0306(2017)04-0225-06
10.13386/j.issn1002-0306.2017.04.034
