香辛料提取物对副溶血弧菌生物膜的抑制作用
2017-03-14魏宇清刘羽霏钟青萍
魏宇清,谢 婷,刘 欢,刘羽霏,钟青萍,*
(1.华南农业大学食品学院,广东广州 510642;2.广东省微生物研究所,广东广州 510070;3.省部共建华南应用微生物国家重点实验室,广东广州 510075)
香辛料提取物对副溶血弧菌生物膜的抑制作用
魏宇清1,2,3,谢 婷1,刘 欢1,刘羽霏1,钟青萍1,*
(1.华南农业大学食品学院,广东广州 510642;2.广东省微生物研究所,广东广州 510070;3.省部共建华南应用微生物国家重点实验室,广东广州 510075)
对大蒜、肉桂等6种天然的香辛料分别采用水和80%乙醇进行提取并筛选出对副溶血弧菌抑菌能力较强的提取物,探究这些香辛料提取物对副溶血弧菌生物膜的抑制作用。研究结果表明大蒜、肉桂、丁香具有较强的抗菌作用,而花椒、小茴香、迷迭香则相对较弱。肉桂和大蒜的乙醇提取物对副溶血弧菌的最低抑菌浓度(Minimum inhibitory concentration,MIC)皆为6.25 mg/mL。亚抑菌浓度的提取物除了能够抑制副溶血弧菌生物膜的形成,还能抑制生物膜内细菌的代谢活性,减少细菌胞外多糖的分泌。激光共聚焦扫描显微镜(Confocal Laser Scanning Microscope,CLSM)观察发现,处理后死细胞的数量明显增多,且生物膜内多糖的含量明显变少。
香辛料,副溶血弧菌,生物膜,抑制
副溶血弧菌(Vibrioparahaemolyticus,VP)是常见的食源性致病菌,为革兰氏阴性嗜盐弧菌,广泛存在于浅海海水及虾、蟹、蛤、牡蛎等海产品中,人们食用了被其污染的食物后,可能会引起以发热、腹泻、恶心、呕吐等为主要症状的急性胃肠炎,严重者可出现脱水、休克,甚至死亡[1]。
生物膜(biofilm)是微生物镶嵌并生长在自身产生的胞外多聚物(主要是胞外多糖、蛋白质和胞外DNA)中的微生物群体,其多附着在物体的表面[2]。生物膜是微生物对环境的一种适应,是与游离态相对应的一种生长状态[3]。细菌在食品加工设备表面形成生物膜后,不仅能够降低设备的热交换率,增加能耗,还能够腐蚀设备表面,而且其持续不断地释放出致病菌,对食品造成持续性的污染[4]。然而,生物膜对杀菌剂、消毒剂等的耐受性是浮游菌的1000倍[5],因此传统的抗菌物质对生物膜的作用效果较差,而化学合成药物[6]、酶解[7]等方法成本较高、工艺复杂,甚至对人体有副作用,从而造成二次污染。因此开发新型、高效、安全的天然抗生物膜物质具有重要的理论和现实意义。
香辛料一般是指植物的种子、果实、根、树皮、浆果、芽或叶子等[8],主要用于食品的调味、着色和保藏。大多数香辛料还具有抑菌、抗氧化等功能[9-11],但是其对生物膜是否有抑制及清除作用鲜有报道。因此本文选用大蒜、肉桂、迷迭香、丁香、花椒和小茴香等常见的香辛料,分别以水和80%乙醇提取抗菌物质,并根据抑菌圈的大小从中选取两种抑菌活性强的香辛料,测定其对VP的最低抑菌浓度(Minimum Inhibitory Concentration,MIC)后,进一步研究其对VP生物膜的作用,为后续的新型抗生物膜制剂的开发奠定一定的理论基础。
1 材料与方法
1.1 材料与仪器
大蒜、迷迭香、肉桂、花椒、小茴香及丁香 均购于广州市农贸市场;副溶血弧菌(ATCC17802)由本实验室保藏;三氯乙酸(TCA) 分析纯,天津市福晨化学试剂厂;重蒸酚 北京索莱宝科技有限公司;XTT、甲萘醌、异硫氰酸荧光素-刀豆球蛋白A(FITC-conA)、碘化丙啶(Propidium Iodide,PI)、链霉蛋白酶E(Pronase E) 均购自美国Sigma公司;氨苄西林(Ampicillin,AM)、卡那霉素(kanamycin,KA) 天根生化科技(北京)有限公司。
电热鼓风干燥箱 上海锦屏仪器仪表有限公司;高速中药粉碎机 瑞安市永历制药机械有限公司;九阳多功能榨汁机 中国九阳股份有限公司;KQ-500E型超声波清洗器 昆山市超声仪器有限公司;循环水式多用真空泵、R1001-VN型旋转蒸发仪 郑州长城科工贸有限公司;Multiskan FC酶标仪 美国Thermo公司;7 DU0(780&7Live)激光共聚焦扫描显微镜 德国蔡司公司。
1.2 实验方法
1.2.1 培养基的配制 含3% NaCl的胰蛋白胨大豆肉汤培养基(TSB):胰蛋白胨15 g、大豆蛋白胨5 g、NaCl 30 g、去离子水1 L。用1 mol/L NaOH溶液调节pH为7.0~7.4;121 ℃,0.15 MPa下高压灭菌15 min。
含3% NaCl的胰蛋白胨大豆肉汤琼脂培养基(TSA):在上述TSB配方的基础上加入2%的琼脂,加热融化后灭菌。
水解酪蛋白胨肉汤(MH肉汤):称取MH肉汤培养基21 g,加入去离子水1 L,搅拌加热煮沸至完全溶解,分装三角瓶,121 ℃,0.15 MPa下高压灭菌15 min。
1.2.2 香辛料中抗菌物质的提取 迷迭香、肉桂、花椒、小茴香及丁香于45 ℃烘干后用中药粉碎机粉碎,大蒜用榨汁机绞碎,各取25 g样品,装入500 mL三角瓶中,加入250 mL 80% 乙醇(v/v)或去离子水,用超声波辅助提取,功率为180 W,温度为55 ℃,提取时间为1 h。减压抽滤后用旋转蒸发仪进行浓缩,旋转蒸发条件为55 ℃,60 r/min,转入25 mL具塞试管,定容后使质量浓度为1 g/mL(即1 g香辛料提取物定容为1 mL),密封后保存于4 ℃冰箱中备用[12]。
1.2.3 香辛料抑菌能力的测定 采用牛津杯法,在含3% NaCl的TSA固体培养基上加入200 μL浓度约为108CFU/mL的菌液,涂布均匀后,用无菌镊子将灭菌并冷却至常温的牛津杯呈三角形放置于平板上,在牛津杯中加入100 μL提取液,置于30 ℃恒温培养箱中培养24 h后观察并测量抑菌圈直径。同时以无菌水作阴性对照,浓度为0.2 mg/mL的氨苄西林(AM)和卡那霉素(KA)为阳性对照。
1.2.4 提取物对副溶血弧菌MIC的测定 在96孔细胞培养板中先加入100 μL灭菌后的MH肉汤培养基,然后在第一列加入用MH肉汤培养基稀释后的提取物100 μL,混合均匀后从中吸取100 μL至下一列中,依次至六个浓度梯度,然后再在每孔中加入100 μL浓度为106CFU/mL的菌液。每列三个重复,第七行为不加提取物和菌液的空白对照,第八行为不加提取物的阴性对照。30 ℃培养24 h后首先肉眼观察浑浊度,提取物浓度最低但孔内却澄清的浓度即为最低抑菌浓度,然后在595 nm波长下测定吸光值,只有相邻两孔的吸光值差异较大且极显著(p<0.01)时,确定为该提取物的MIC。
1.2.5 生物膜形成量的测定 按1.2.4的方法在96孔板中加入含不同浓度提取物的含菌培养基,同时设不加提取物的阴性对照组。将96孔板放置于30 ℃的培养箱中培养24 h,取出孔板,弃去菌液,用250 μL无菌生理盐水清洗2次,然后60 ℃干燥固定15 min,再每孔加入0.1%的结晶紫溶液200 μL,染色5 min,用250 μL无菌生理盐水清洗3次,干燥后加入33%的冰乙酸200 μL,放置10 min,在595 nm处测OD值[13]。
1.2.6 生物膜代谢活性的测定 XTT是一种类似于MTT的甲基四氮盐,活细胞中的线粒体能够将黄色的XTT还原成橙色的可溶解的甲臜产物,其颜色的深度与细胞的活力成正比[14]。本文选用XTT作为指示剂,研究香辛料提取物对VP生物膜内的细胞活力的影响。将XTT用PBS配制成1 g/mL的溶液,储存在-20 ℃冰箱中。甲萘醌在用之前溶解在丙酮中,使其终浓度为1 mmol/L,每次实验所用XTT与甲萘醌比例为12.5∶1。按1.2.4的方法在96孔板中加入含不同浓度提取物的含菌培养基,同时设不加提取物的阴性对照组。30 ℃条件下培养24 h使其形成生物膜。然后移除浮游菌,用100 μL无菌PBS缓冲液冲洗3次,加入13.5 μL的XTT-甲萘醌混合液,轻轻震动孔板,然后放置在黑暗处30 ℃孵育4 h,在420 nm波长下测定其OD值[14]。
1.2.7 胞外多糖(Extracellular polysaccharides,EPS)含量的测定 将制备好的浓度为108CFU/mL的菌悬液按1%的接种量加入到放有盖玻片的TSB培养基试管中,并加入防腐剂溶液,同时设不加防腐剂的对照组。副溶血弧菌在30 ℃下培养24 h后形成生物膜,取出盖玻片,用生理盐水洗三次后放入10 mL生理盐水中超声震荡10 min(20 W,37 ℃)。取出玻片,将菌悬液煮沸10 min,室温冷却20 min。再加入50 μL的Pronase E,37 ℃孵育2 h,加入200 μL的质量浓度为10%的TCA溶液,冰水放置30 min,10000 r/min离心30 min。收集上清液,加入等体积的乙醇溶液,-20 ℃放置1 h,15000 r/min离心20 min,除去上清液,沉淀物用95%的苯酚和5 mL浓硫酸,沸水浴10 min,反应液呈红色,设置未加抑菌物质的阴性对照组,在420 nm波长下测定其OD值[15]。
1.2.8 激光共聚焦扫描显微镜(Confocal Laser Scanning Microscope,CLSM)观察生物膜 在培养皿中放入灭菌后的载玻片,然后加入15 mL含有2×MIC的肉桂提取物的TSB培养基,接入菌种,使最终浓度为106CFU/mL。于30 ℃恒温培养箱培养24 h后取出载玻片,用PBS洗3次,用滤纸轻轻吸去多余的水,在避光环境下于载玻片上滴加5 μL FITC-conA混合溶液,4 ℃放置30 min;在相同位置上再滴加5 μL PI溶液,4 ℃放置15 min。然后将载玻片放置于CLSM中观察生物膜的结构。
1.2.9 数据处理
1.2.9.1 抑制率计算[14,16]
抑制率(%)=阴性对照组OD值-实验组OD值/阴性对照组OD值×100
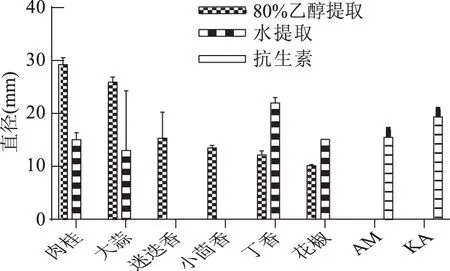
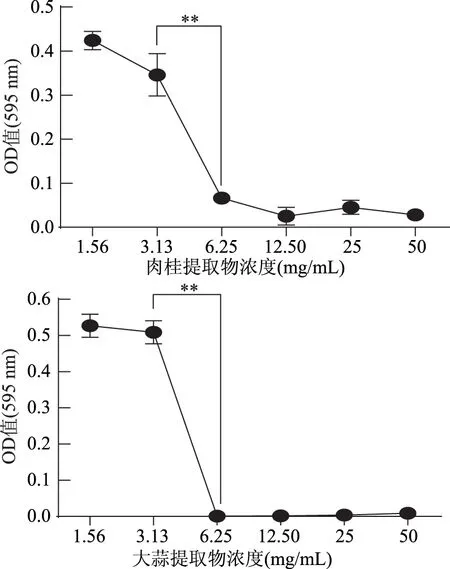
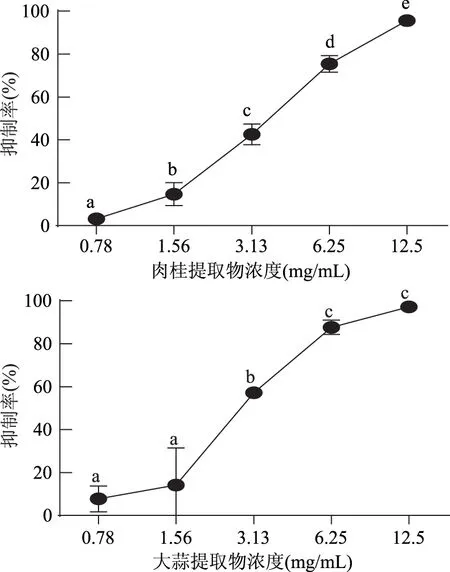
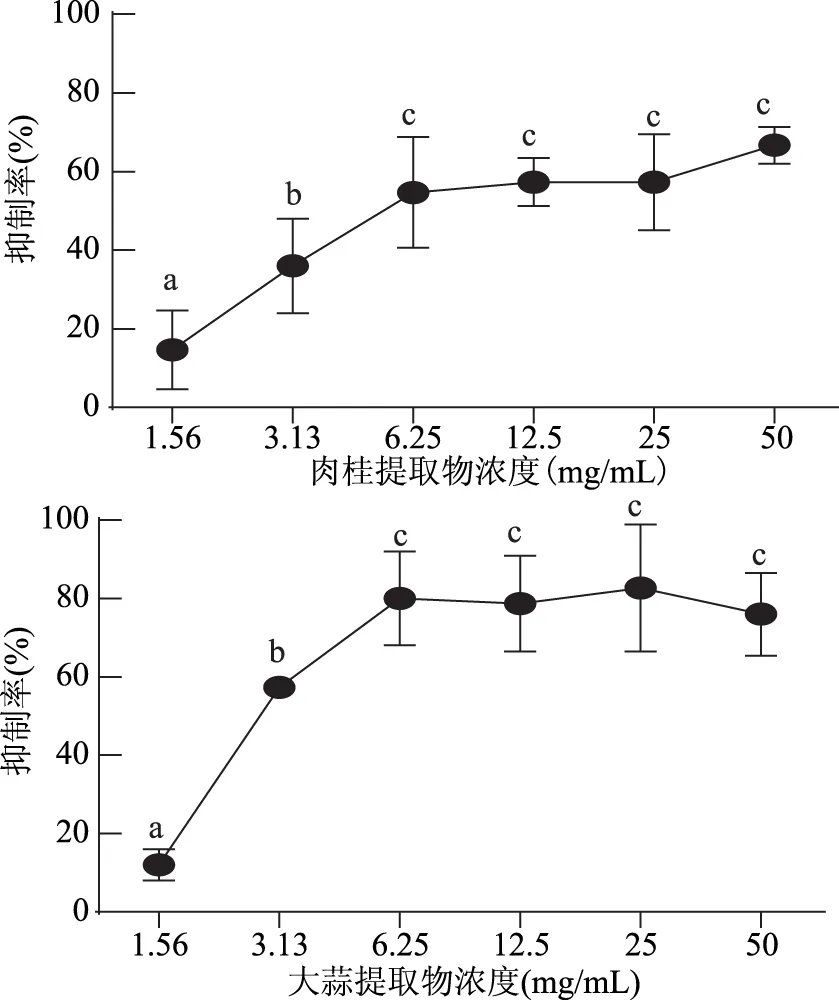
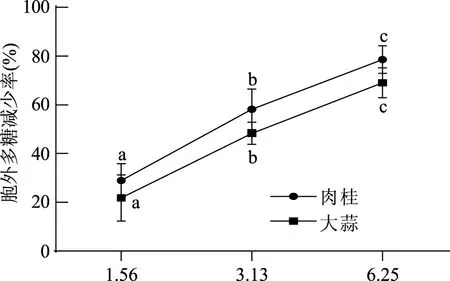
1.2.9.2 数据统计与分析 应用SPSS 22.0软件进行平均值和标准偏差的计算,并对其进行显著性分析(p<0.01为差异极显著,0.01 2.1 牛津杯法测定不同提取物的抑菌效果 通过牛津杯法测定了6种不同的香辛料的水提取物和80%乙醇提取物以及两种抗生素氨苄西林(AM)和卡那霉素(KA)对副溶血弧菌的抑菌能力,结果见图1。结果表明,肉桂、大蒜不论是水提取物还是乙醇提取物都表现出了较强的抑制效果,而迷迭香和小茴香的乙醇提取物具有较强的抑菌效果但其水提取物无抑菌效果;而丁香和花椒的乙醇提取物的抑菌能力不如其水提取物。阳性对照AM和KA的抑菌圈直径小于肉桂和大蒜的乙醇提取物。后续研究中选用肉桂和大蒜的乙醇提取物,进一步测定其对副溶血弧菌的MIC,以及对生物膜的抑制作用。 图1 不同香辛料提取物及抗生素对副溶血弧菌的抑菌作用Fig.1 Inhibition effects of different spices and antibiotics on VP 2.2 筛选后的提取物对VP的MIC 分别测定肉桂和大蒜的乙醇提取物对VP的MIC,结果如图2所示,两种提取物对VP的MIC均为6.25 mg/mL。 图2 香辛料提取物对副溶血弧菌的MICFig.2 The MIC of extracts of spices to VP 2.3 香辛料提取物对VP生物膜形成的抑制作用 肉桂和大蒜提取物对VP生物膜均有较强的抑制作用,且抑制率与浓度呈正相关(图3),肉桂提取物的抑制率与浓度之间具有明显的线性关系(R2=0.9803),在MIC时其抑制率为75.46%。大蒜提取物在MIC浓度下,抑制率达到87.68%;2×MIC浓度的大蒜提取物对VP生物膜的抑制率为97.20%,大于MIC浓度时的抑制率,但两者之间的差异并不显著,说明大蒜提取物在MIC浓度下已经基本抑制了VP形成生物膜。 图3 提取物对副溶血弧菌生物膜形成量的影响Fig.3 The inhibition effects of spices extracts on VP biofilm formation 2.4 香辛料提取物对VP生物膜代谢活性的影响 两种提取物对VP生物膜代谢活性的影响如图4所示。当肉桂提取物浓度从1.56 mg/mL(1/4×MIC)增加到6.25 mg/mL(MIC),其对生物膜代谢活性的抑制率不断增加。但高于MIC时,其对VP生物膜代谢活性的抑制率变化不大(两两之间差异不显著),说明到MIC浓度时代谢活性抑制作用已基本达到极限。大蒜提取物也有相同的趋势,但大蒜提取物的抑制作用更强,其在MIC(6.25 mg/mL)时,抑制率接近80%,而肉桂的抑制率约为60%。 图4 提取物对副溶血弧菌生物膜代谢活性的影响Fig.4 The reductions of metabolic activities of biofilms by the extracts of spices 图5 香辛料提取物对副溶血弧菌EPS的影响Fig. 5 The effects of spices extracts on EPS of VP 2.5 香辛料对VP生物膜胞外多糖的抑制作用 胞外多糖是细菌生物膜的主要成分,既是生物膜结构的基础,又是功能的主要承担者[17]。因此,抑制或减少细菌分泌胞外多糖,是抑制生物膜形成的一种重要方法。香辛料提取物对VP胞外多糖的影响如图5所示。由图5可知,不论是肉桂还是大蒜的乙醇提取物对VP胞外多糖的抑制作用都随着提取物浓度的增加而增强,且不同浓度之间的差异显著,说明香辛料提取物浓度的改变会显著影响VP胞外多糖的分泌。 2.6 激光共聚焦扫描显微镜观察香辛料提取物对生物膜的作用 激光共聚焦扫描显微镜除了能够观察细菌生物膜的平面图像,还能够对生物膜的立体结构进行三维扫描,而且在荧光染料的作用下还能够直观地观察胞外多糖及细胞的多少。本研究通过CLSM观察肉桂乙醇提取物对VP生物膜的抑制情况,结果如图6所示。通过a图与c图以及b图与d图的比较发现,经过2×MIC浓度的肉桂乙醇提取物处理之后,生物膜中死细胞的数量明显增多,而多糖含量显著减少,说明肉桂对VP具有较强的杀灭作用,且能减少胞外多糖的产生。 图6 CLSM观察肉桂提取物对副溶血弧菌生物膜的抑制作用Fig.6 The inhibition effects of cinnamon on VP biofilm observed by CLSM 以牛津杯法测定迷迭香、肉桂、丁香、花椒、小茴香、大蒜等的水提取物和80%乙醇提取物对VP的抑菌能力,结果显示,肉桂的乙醇提取物和大蒜的乙醇提取物的抑菌能力最强。以96孔板法测定此两种提取物对VP的MIC均为6.25 mg/mL。在此基础上进一步分析肉桂和大蒜的乙醇提取物对VP生物膜的抑制作用,分析其对VP生物膜形成总量、细胞代谢活性以及胞外多糖含量的影响。结果表明,在MIC时,肉桂和大蒜的乙醇提取物对VP生物膜形成的抑制率分别为75.46%和87.68%;并能降低细胞的代谢活性以及EPS的分泌,VP的代谢活性分别下降了54.67%和80.00%,EPS分别减少了78.57%和69.05%。说明这两种提取物对VP生物膜的形成具有显著的抑制作用。 抑制细菌形成生物膜可通过阻止细菌对物体表面的粘附,阻断细菌间的信号交流甚至直接杀死细菌等[18]。而Sandra S等[19]从肉桂中提取精油,并用气质联用检测其主要成分为肉桂醛、丁香酚和芳樟醇,肉桂精油在亚抑菌浓度下能够抑制不动杆菌、鞘脂单胞菌属和寡养单胞菌生物膜的形成。崔海英等[20]采用MTT染色法和菌落计数法研究丁香精油对金黄色葡萄球菌生物膜的抑制作用,结果表明,在0.1%丁香精油的作用下,生物膜的抑制率达到了99.73%,而且活菌数量也减少了99.93%。这些结果与本研究结果类似,但这些研究都没有解释香辛料等天然产物对细菌生物膜作用的具体机制,也说明仍有大量的工作需要完成。 香辛料是我们日常生活中常见的调味品,我国是生产香辛料的大国[21],但是目前大多仍是利用其芳香气味的功能,对其抗氧化及抗菌性能的利用则有待进一步开发。在未来,结合本文的研究可以利用香辛料生产控制致病菌形成有害生物膜的制剂,为食品安全问题提供新的解决方案。 [1]胡小许,张义全. 黄倩,等. 副溶血弧菌Tox R截短体蛋白的表达纯化及其DNA结合活性[J]. 微生物学报,2014,54(8):956-961. [2]Pantanella F,Valenti P,Natalizi T,et al. Analytical techniques to study microbial biofilm on abiotic surfaces:pros and cons of the main techniques currently in use[J]. Annali di igiene:medicina preventiva e di comunità,2013,25(1):31-42. [3]贾文祥. 微生物生物膜研究的新进展[J]. 微生物学免疫学进展,2012,40(5):1-9. [4]万娜. 鱼精蛋白对细菌及生物膜的抑制作用及初步应用研究[D]. 武汉:华中农业大学,2013. [5]Cerca N,Martins S,Cerca F,et al. Comparative assessment of antibiotic susceptibility of coagulase-negative staphylococci in biofilm versus planktonic culture as assessed by bacterial enumeration or rapid XTT colorimetry[J]. Journal of Antimicrobial Chemotherapy,2005,56(2):331-336. [6]Smith RS,Iglewski BH. P. aeruginosa quorum-sensing systems and virulence[J]. Current Opinion in Microbiology,2003,6(1):56-60. [7]Xavier JB. Biofilm-control strategies based on enzymic disruption of the extracellular polymeric substance matrix-a modelling study[J]. Microbiology,2005,151(12):3817-3832. [8]郭红珍,杜鹃,史振霞,等. 几种常见香辛料的抑菌作用研究[J]. 安徽农业科学,2011,39(17):10273-10274. [9]缪晓平,邓开野,谭梅唇. 三种香辛料提取物抑菌及抗氧化性能的研究[J]. 中国调味品,2010,35(10):107-109. [10]Sonia Sethi,Aparna Dutta,B Lal Gupta, et al. Antimicrobial activity of spices against isolated food borne pathogens[J]. International Journal of Pharmacy and Pharmaceutical Sciences,2013,5(1):260-262. [11]Mousumi B,Prabir KS. Inhibitory effect of garlic on bacterial pathogens from spices[J]. World Journal of Microbiology and Biotechnology,2003,19(6):565-569. [12]纪淑娟,隋时. 丁香抑菌成分超声波提取工艺研究[J]. 食品科学,2008,29(5):201-204. [13]渠宏雁,李学鹏,仪淑敏,等. 亚硝酸钠对金黄色葡萄球菌和副溶血性弧菌生物被膜形成的抑制作用[J]. 食品工业科技,2015,36(21):178-182. [14]Mejdi Snoussi A,Ameni Dehmani,Emira Noumi,et al. Chemical composition and antibiofilm activity of Petroselinum crispum and Ocimum basilicum essential oils against Vibrio spp. Strains[J]. Microbial Pathogenesis,2016,90:13-21. [15]王桂洋. 壳聚糖对希瓦氏菌生物被膜抑制和清除作用的研究[D]. 杭州:浙江工商大学,2015. [16]Mitra M B,Jens R. Antibiofilm activity of essential oils and plant extracts against Staphylococcus aureus and Escherichia coli biofilms[J]. Food Control,2016,61:156-164. [17]Sutherland IW. Biofilm exopolysaccharides:a strong and sticky framework[J]. Microbiology,2001,147(1):3-9. [18]Francolini I,Donelli G. Prevention and control of biofilm based medical-device-related infections[J]. FEMS Immunology and Medical Microbiology,2010,59(3):227-238. [19]Sandra S,André L. Essential oils show specific inhibiting effects on bacterial biofilm formation[J]. Food Control,2012,36(1):224-229. [20]崔海英,周慧,刘延涛,等. 丁香精油对金黄色葡萄球菌生物膜的抑制作用研究[J]. 中国食品添加剂,2015,12:55-59. [21]王劼,张水华. 香辛料及其应用[J]. 广州食品工业科技,2000,16(1):46-48. Inhibition effects of spices on biofilm formation ofVibrioparahaemolyticus WEI Yu-qing1,2,XIE Ting1,LIU Huan1,LIU Yu-fei1,ZHONG Qing-ping1,* (1.College of Food Science,South China Agricultural University,Guangzhou 510642,China;2.Guangdong Institute of Microbiology,Guangzhou 510070,China;3.State Key Laboratory of Applied Microbiology Southern China,Guangzhou 510075,China) In this study,antibacterial activities of 6 spice samples were extracted by water or ethanol,then 2 spices whose antibacterial activities were more efficient were selected to analyze the inhibition effects on biofilm ofVibrioparahaemolyticus(VP). The results showed that,the garlic,cinnamon and clove had the stronger antibacterial activities,but the antibacterial activities of Chinese prickly ash,fennel and rosemary were lower. MIC values of the garlic,cinnamon were 6.25 mg/mL for VP,respectively. Sub-MICs of all the extracts could not only inhibit the biofilm formation,but also reduce the metabolic activity and the secretion of extracellular polysaccharide of cells in the biofilms. With the aid of confocal laser scanning microscope(CLSM),the increase of dead cell numbers and the decrease of biofilm polysaccharides could be observed obviously. spice;Vibrioparahaemolyticus;biofilm;inhibition 2016-06-30 魏宇清(1990-),男,硕士研究生,研究方向:食品质量与安全,E-mail:824052630@qq.com。 *通讯作者:钟青萍(1967-),女,博士,副教授,研究方向:食品安全、食品微生物,E-mail:zhongqp@scau.edu.cn。 国家自然科学基金项目(31271956);2015年广东省质量工程项目-食品微生物学精品资源共享课。 TS201.3 A :1002-0306(2017)04-0101-05 10.13386/j.issn1002-0306.2017.04.0112 结果与分析

3 结论与讨论
