不同发酵条件对模拟葡萄酒中酒酒球菌柠檬酸代谢的影响
2017-03-14任晓宁陈其玲刘树文
任晓宁,张 宇,陈其玲,刘树文,2,3,*
(1.西北农林科技大学葡萄酒学院,陕西杨凌 712100;2.陕西省葡萄与葡萄酒工程技术中心,陕西杨凌 712100;3.西北农林科技大学合阳葡萄实验示范站,陕西合阳 715300)
不同发酵条件对模拟葡萄酒中酒酒球菌柠檬酸代谢的影响
任晓宁1,张 宇1,陈其玲1,刘树文1,2,3,*
(1.西北农林科技大学葡萄酒学院,陕西杨凌 712100;2.陕西省葡萄与葡萄酒工程技术中心,陕西杨凌 712100;3.西北农林科技大学合阳葡萄实验示范站,陕西合阳 715300)
以酒酒球菌31-DH进行模拟酒苹果酸-乳酸发酵,使用离子排斥色谱法测定相关代谢物质的含量,研究苹果酸-乳酸发酵期间及发酵后pH、乙醇和葡萄糖对柠檬酸代谢的影响。结果表明:该方法耗时短、前处理简单、分离度良好、回收率为87%~108%、精密度为0.77%~4.33%,满足分析要求。当发酵液处于低pH,高酒精度,低葡萄糖浓度时,柠檬酸代谢缓慢,乳酸、乙酸及2,3-丁二醇的产量较低,双乙酰含量峰值较高。当发酵液中不含有乙醇时,苹果酸、柠檬酸、葡萄糖代谢迅速,伴随菌体的大量生长,乳酸、乙酸、2,3-丁二醇含量较高,但无双乙酰的产生。当发酵液中不含有葡萄糖时,柠檬酸代谢速率加快,乳酸产量较低,2,3-丁二醇及双乙酰产量较高。pH、乙醇、葡萄糖均显著影响酒酒球菌31-DH对柠檬酸的代谢。
发酵条件,模拟葡萄酒,酒酒球菌,柠檬酸代谢
苹果酸-乳酸发酵(Malolactic Fermentation,MLF)是葡萄酒酿造过程中重要的二次发酵过程,该过程是在乳酸菌的作用下将L-苹果酸(二元酸)转化为L-乳酸(一元酸)和二氧化碳的降酸过程,同时还具有改变葡萄酒色泽,增加微生物稳定性、修饰葡萄酒风味等作用[1-2]。酒酒球菌(Oenococcusoeni)是主导MLF过程的主要乳酸菌菌种,对葡萄酒环境(低pH、高酒精度、营养物质缺乏等)有良好的适应性[3]。MLF期间除代谢苹果酸外,O.oeni还可以代谢葡萄酒中的其他有机酸,如柠檬酸等[4]。柠檬酸和乳酸的反向转运会产生跨膜电势和pH梯度,为菌体的生长提供能量,柠檬酸代谢还可以消耗质子,使细胞质碱化,有助于维持菌体在低pH环境下的胞内pH平衡,从而使菌株更好的适应葡萄酒环境[5]。此外,O.oeni柠檬酸代谢产物(双乙酰、乙偶姻、2,3-丁二醇等)还是葡萄酒中重要的风味物质,其中双乙酰可以使葡萄酒具有“黄油味”或“坚果味”,增加葡萄酒的风味和复杂性,另一代谢产物乙酸对葡萄酒的风味和质量也具有一定的影响[6-7]。目前,国内关于柠檬酸代谢的研究主要集中在柠檬酸含量较高的柑橘类水果上,且更多的集中在其合成代谢途径及调控上[8-9],关于双乙酰等风味物质的研究主要集中在乳制品及啤酒上[10],对葡萄酒中柠檬酸代谢及双乙酰产生的研究较少。基于这种情况,本实验主要探索不同发酵条件对葡萄酒中O.oeni代谢柠檬酸的影响,以期为实际生产中柠檬酸代谢及相关风味物质产生的调控提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
酒酒球菌31-DH 由西北农林科技大学葡萄酒学院提供;标准品苹果酸、乳酸、柠檬酸、乙酸、葡萄糖 HPLC级,上海源叶生物科技有限公司;2,3-丁二醇 HPLC级,德国Dr. Ehrenstorfer GmbH公司;双乙酰 高级纯,德国Ruibio公司;乙偶姻 高级纯,阿拉丁试剂有限公司;浓硫酸、蛋白胨、葡萄糖、酵母浸粉、MgSO4·7H2O、MnSO4·4H2O、盐酸半胱氨酸、NaOH、乙醇、酒石酸、L-苹果酸、柠檬酸、NaCl、(NH4)2SO4、KH2PO4等 均为分析纯。
高效液相色谱仪、TW323L型分析天平 日本岛津公司;超净工作台 苏净集团苏州安泰空气技术有限公司;Orion Star A111 pH计、台式高速离心机 美国Thermo Fisher Scientific公司;Cary60紫外可见分光光度计 美国Agilent科技有限公司。
1.2 实验方法
1.2.1 培养基配制 ATB液体培养基的配制(1 L):蛋白胨10 g;葡萄糖10 g;酵母浸粉5 g;MgSO4·7H2O 0.2 g;MnSO4·4H2O 0.05 g;盐酸半胱氨酸0.5 g;番茄汁250 mL;蒸馏水定容至1 L;用4 mol/L NaOH调pH至4.8,121 ℃灭菌20 min。
1.2.2 菌种活化 冷冻保藏的酒酒球菌31-DH按2%(v/v)接种量接至10 mL ATB液体培养基中,26 ℃下活化7 d。第一次活化的菌悬液按相同的接种量转接至10 mL ATB液体培养基中,培养3 d。第二次活化的菌悬液以2%(v/v)接种量转入100 mL ATB培养基中,培养至对数生长末期,备用。
1.2.3 模拟葡萄酒的配制 实验中使用模拟葡萄酒,进行不同发酵条件对酒酒球菌代谢柠檬酸的影响,模拟葡萄酒基本化学组成为:乙醇8%(v/v),酒石酸5.0 g/L,L-苹果酸3.5 g/L,柠檬酸4.0 g/L,D-葡萄糖4.0 g/L,NaCl 0.2 g/L,(NH4)2SO41.0 g/L,KH2PO42.0 g/L,MgSO4·7H2O 0.2 g/L,MnSO40.05 g/L,酵母浸粉4 g/L,用10 mol/L NaOH调节模拟酒pH至3.4。根据实验梯度设计调整相应组分含量,配制完成后121 ℃灭菌20 min[11]。
1.2.4 MLF发酵条件的设计
1.2.4.1 pH对酒酒球菌柠檬酸代谢的影响 培养至对数生长末期的酒酒球菌,按10%的比例接种于pH分别为3.0、3.4、3.8的400 mL模拟酒中,用10 mol/L NaOH调节模拟酒的pH,20 ℃培养。
1.2.4.2 乙醇对酒酒球菌柠檬酸代谢的影响 培养至对数生长末期的酒酒球菌,按10%的比例接种于酒精度分别为0、8%、12%(v/v)的模拟酒中,pH调至3.4,20 ℃培养。
1.2.4.3 葡萄糖对酒酒球菌柠檬酸代谢的影响 培养至对数生长末期的酒酒球菌,按10%的比例接种于葡萄糖浓度分别为0、2、4、8 g/L的模拟酒中,pH调至3.4,20 ℃培养。
以上每个处理均设置两个重复,每3 d取样测定苹果酸、乳酸、柠檬酸、乙酸、葡萄糖、双乙酰和2,3-丁二醇的含量,共取10次样,其中,当苹果酸代谢完全时,即为MLF结束,随后的发酵阶段为MLF结束后时期。
1.2.5 指标测定
1.2.5.1 生长曲线的绘制 每24 h吸取适量菌悬液,600 nm下测定吸光值,以时间为横坐标,以OD600为纵坐标,绘制MLF过程中菌体的生长曲线。
1.2.5.2 待测物质含量测定 色谱条件:色谱柱为Phenomenex Rezex ROA-Organic Acid柱(150 mm×7.8 mm),流动相为0.005 mol/L稀硫酸,流速为0.5 mL/min,柱温为60 ℃,进样量为20 μL,检测器为示差检测器。
标准曲线绘制:配制苹果酸、乳酸、柠檬酸、乙酸、葡萄糖、双乙酰、2,3-丁二醇(浓度分别为4、4、4、10、10、4、8 g/L)标准混合液母液,将母液用超纯水逐级稀释8、64、100、500、1000倍,共得到6组不同浓度的标准混合液,将标准混合液经0.45 μm微孔滤膜过滤,每个浓度重复进样2次,取平均值。以峰面积为横坐标,标准品浓度为纵坐标,绘制标准曲线。
样品制备:取不同时期发酵液2 mL在8000 r/min下离心3 min,收集上清液,将上清液与超纯水以1∶1的比例稀释后经0.45 μm微孔滤膜过滤,进样分析。
1.2.5.3 方法回收率的测定 在采集的所有样品中随机选取10个样品(各取1 mL),分别加入等体积的待测物质标准混合溶液母液(各标准品浓度如1.2.5.2所述),根据加标前和加标后的检测量计算回收率,每个物质的回收率按照所有测得样品回收率的平均值计算。
1.2.5.4 方法精密度的测定 采集样品过程中,随机选取一次样品采集过程取6次样,分别进样测定相应物质的含量,计算方法的精密度。

表1 不同物质的标准曲线特征Table 1 Standard curve characteristics of different substances
1.3 数据处理
使用Excel 2010及Origin 2016软件作图分析。
2 结果与分析
2.1 标准混合溶液的色谱图和标准曲线特征
按照1.2.5.2的色谱条件,将标准混合溶液母液进样分析,发现柠檬酸、苹果酸、乳酸、乙酸、葡萄糖、双乙酰及2,3-丁二醇分离度较好,7种待测物质在13 min前全部出峰,可以满足实验要求(图1)。
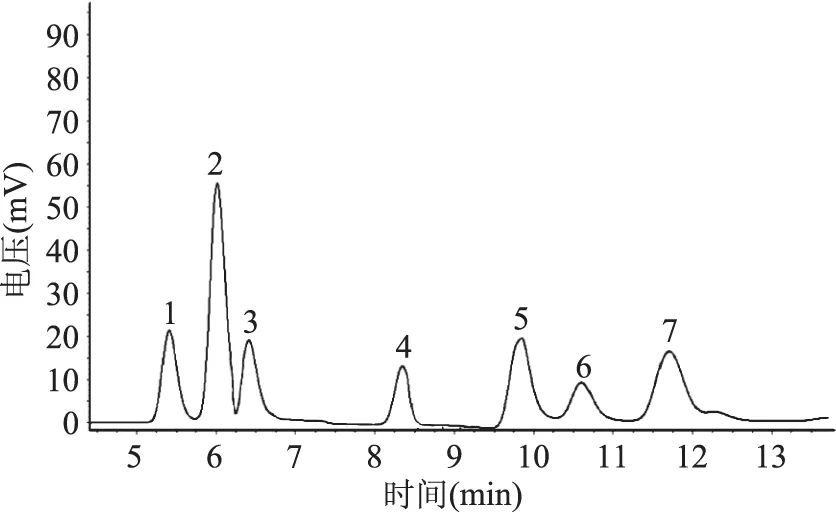
图1 7种标准物质的色谱图Fig.1 Chromatogram of seven standards
将6组不同浓度的标准混合溶液从低浓度到高浓度依次进样,根据物质的峰面积与质量浓度进行回归分析,以峰面积为横坐标,物质质量浓度为纵坐标,得到各物质的标准曲线特征(表1)。由表1可知:得出的各物质标准曲线的相关系数均大于0.999,线性关系可满足分析要求。
2.2 方法回收率的测定
由表2可知,除乙酸和双乙酰回收率较低(均为87%)外,其余代谢产物的回收率在101%~108%之间,而乙酸和双乙酰回收率较低是由于乙酸和双乙酰具有一定的挥发性,在样品处理过程中易损失。由此可得到该色谱条件所测定的实验结果较准确,用该色谱条件作为测定有机酸、葡萄糖、双乙酰及2,3-丁二醇的方法是可行的。
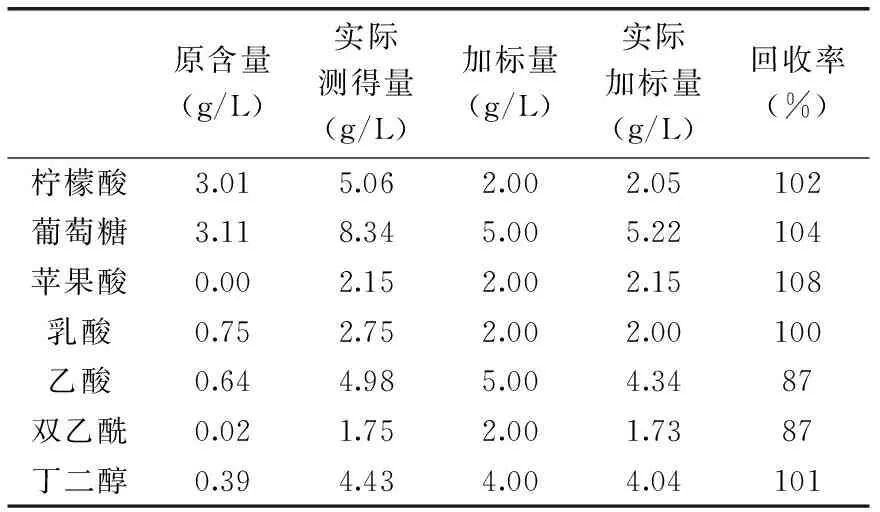
表2 方法回收率的测定Table 2 Determination of recovery
2.3 方法精密度的测定
由表3可知,样品中除了苹果酸未检出外,其余6种物质的RSD在0.77%~4.33%之间,均低于5%,该方法用于测定模拟酒中有机酸、葡萄糖、双乙酰以及2,3-丁二醇时,其精密度可以满足分析要求。
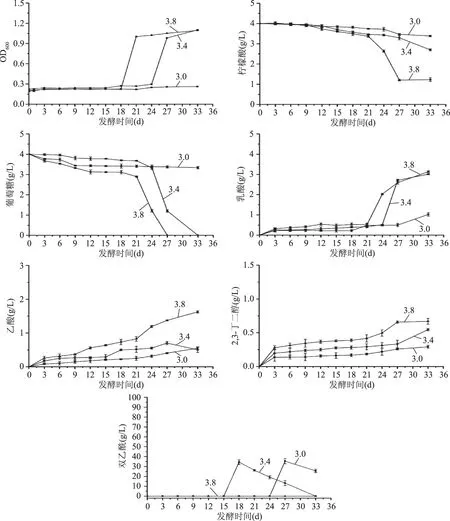
图2 不同初始pH对相关物质代谢量及产生量的影响Fig.2 Effect of initial pH on consumption and yield of related substances
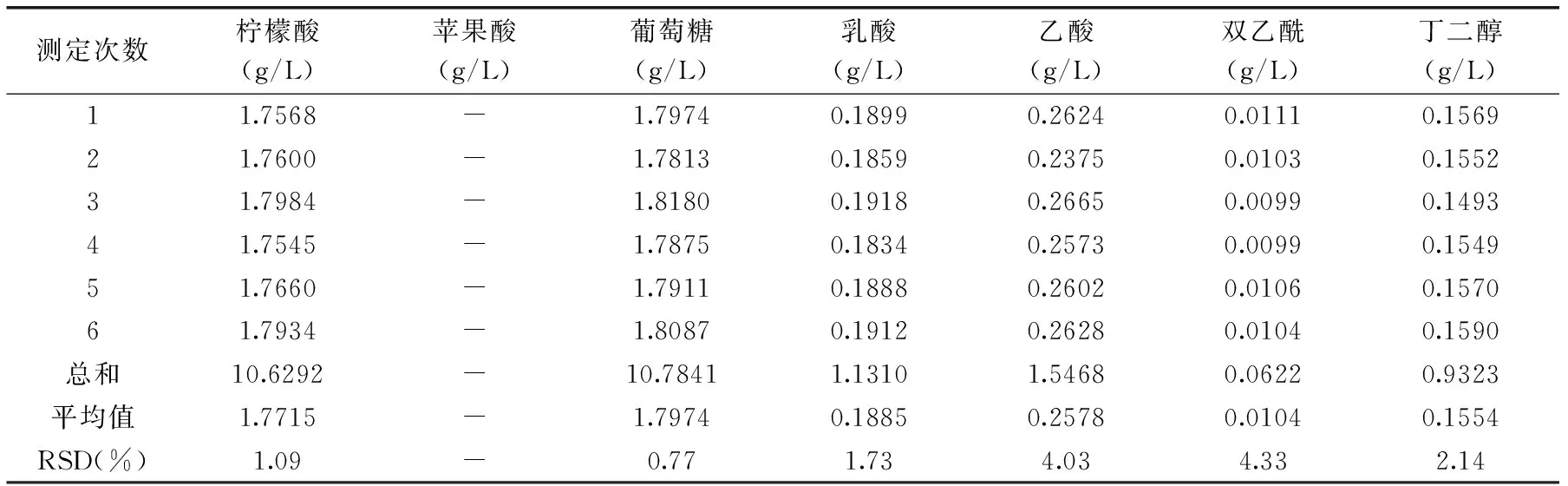
表3 方法精密度的测定Table 3 Determination of precision
注:“-”表示未检出。
2.4 pH对酒酒球菌柠檬酸代谢的影响
在该条件下,苹果酸迅速发酵,第3 d均发酵完全。由图2可知,在MLF期间,柠檬酸没有明显变化,葡萄糖缓慢代谢,MLF结束后,随着发酵时间的延长,柠檬酸缓慢代谢,葡萄糖代谢速率降低,在发酵至21~24 d后,柠檬酸与葡萄糖迅速代谢,并伴随菌体的大量生长,且随着pH升高,二者进入高速率代谢时期提前,代谢速率提高,这可能是由于pH越高,对菌体的生长越有利,在菌体适应酒环境后,代谢速率明显提高。乳酸含量在发酵至21~24 d之后迅速升高,且pH越高,乳酸进入迅速产生时期越早。乙酸和2,3-丁二醇含量都随着时间的变化缓慢升高,且pH越高,其产量越高。在pH3.8时,无双乙酰的产生。在pH为3.0和3.4时,随着发酵时间的延长,双乙酰含量先迅速升高,随后缓慢降低,这是由于低pH环境下,柠檬酸进入C4代谢途径有利于维持胞内pH平衡,增强菌体抵抗低pH环境的能力,且随着发酵时间的延长双乙酰又被还原为乙偶姻和2,3-丁二醇[5,12-13]。
2.5 乙醇对酒酒球菌柠檬酸代谢的影响
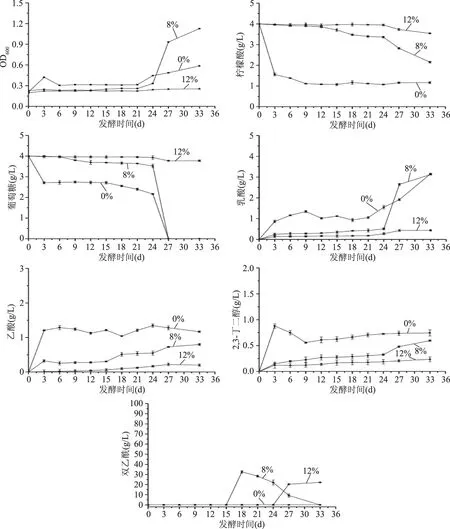
图3 不同初始酒精度对相关物质代谢量及产生量的影响Fig.3 Effect of initial ethanol concentrations on consumption and yield of related substances
在该条件下,苹果酸迅速发酵,第3 d均发酵完全。由图3可知,当酒精度为0%时,柠檬酸与葡萄糖均迅速代谢,MLF结束后,葡萄糖代谢速率降低,发酵至24 d后,迅速代谢完全。当酒精度为8%时,柠檬酸与葡萄糖前期均没有明显代谢,发酵至24 d后,柠檬酸代谢速率增加,葡萄糖迅速代谢完全。当酒精度为12%时,柠檬酸与葡萄糖均无明显代谢。乳酸、乙酸、2,3-丁二醇的含量随着发酵时间的延长逐渐升高,且酒精度越高,代谢物产量越低,且产生速率越低,这是由于乙醇对菌体具有强抑制作用,当酒精度达到8%时,会延迟菌体对柠檬酸和葡萄糖的代谢[14],当酒精度为12%时,菌体对柠檬酸和葡萄糖的代谢能力迅速降低,导致相应产物的产量较低,当发酵基质中不含有乙醇时,能量物质迅速代谢,同时伴随着菌体的大量生长[15]。酒精度为0%时,没有双乙酰的产生,酒精度为8%和12%时,随着发酵时间的延长,双乙酰含量先迅速升高,随后缓慢降低,且酒精度越低,双乙酰检出时期越早,可能是由于当酒精度为12%时,菌体受到极大抑制,各物质代谢速率均降低,导致双乙酰的产生期延长。
2.6 葡萄糖对酒酒球菌柠檬酸代谢的影响
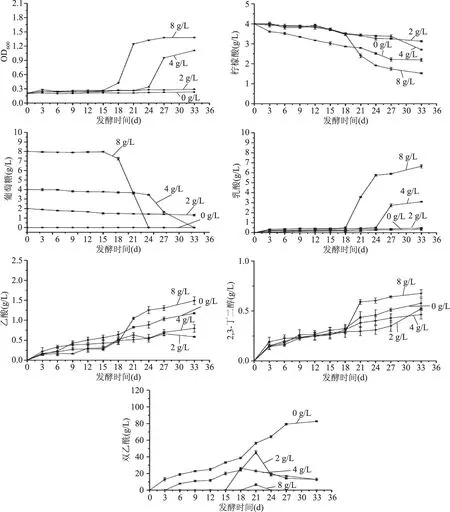
图4 不同初始葡萄糖浓度对相关物质代谢量及产生量的影响Fig.4 Effect of initial glucose concentration on consumption and yield of related substances
葡萄糖浓度为0 g/L时,苹果酸在第5 d发酵完全,其他浓度葡萄糖条件下苹果酸在第3 d发酵完全。由图4可知,柠檬酸随发酵时间的延长缓慢代谢,其中葡萄糖浓度为0 g/L及8 g/L时,柠檬酸代谢速率较快,而当葡萄糖浓度为2 g/L或4 g/L时,柠檬酸代谢速率较慢。葡萄糖前期代谢缓慢,且随浓度升高,后期代谢速率加快。当葡萄糖浓度较高时,乳酸前期含量无明显变化,后期随着糖和柠檬酸的代谢迅速升高。乙酸和2,3-丁二醇含量随着发酵时间的延长逐渐升高,且随着柠檬酸和葡萄糖的大量代谢在发酵后期含量明显升高。当发酵液中不含有葡萄糖时,双乙酰含量持续增加,当含有葡萄糖时,随糖浓度降低,双乙酰含量峰值升高,这是由于葡萄糖对酒酒球菌代谢柠檬酸有一定的抑制作用,当不含葡萄糖时,酒酒球菌会代谢柠檬酸产生大量双乙酰,当葡萄糖浓度越高,菌体会优先利用葡萄糖提供能量,随后缓慢代谢柠檬酸[16]。然而Salou等[17]研究认为糖和柠檬酸的共代谢对于双乙酰的产生是必要的,这可能是由于菌株及实验条件不同造成的。
3 结论
本研究采用离子排斥色谱法对葡萄酒中糖、有机酸、醇、酮等7种不同类别的物质同时进行了分析检测,其前处理简单、分离度良好、回收率为87%~108%、精密度为0.77%~4.33%,满足分析要求,缩短了检测的时间,可以作为同时检测葡萄酒中糖、酸、醇、酮的方法。以苹果酸、柠檬酸、葡萄糖为底物进行MLF,MLF期间及发酵后酒酒球菌31-DH的代谢表现为三个阶段。pH、乙醇、葡萄糖均显著影响酒酒球菌对柠檬酸的代谢。当环境条件不适宜酒酒球菌生长时,其双乙酰产量升高,且其含量随着时间的变化先升高后降低,因此在实际生产中适当延长MLF时间,酒精发酵时将糖发酵完全可以提高酒中双乙酰含量,提供相应的“奶油”风味,但应控制发酵时间,避免时间过长造成乙酸含量的升高,从而影响葡萄酒的质量。
[1]刘福强,赵新节.葡萄酒酿造中苹果酸-乳酸发酵的应用[J].中外葡萄与葡萄酒,2009(7):65-68.
[2]李瑞国,韩烨,周志江.葡萄酒苹果酸乳酸发酵研究进展[J]. 食品研究与开发,2010,31(8):228-233.
[3]Ruiz P,Izquierdo P M,Sesena S,et al. Malolactic Fermentation and Secondar Metabolite Production byOenoccocusoeniStrains in Low pH Wines[J]. Journal of Food Science,2012,77(10):579-585.
[4]Lonvaud-Funel A. Lactic acid bacteria in the quality improvement and depreciation of wine[J]. Antonie van Leewenhoek,1999,76:317-331.
[5]La⊇titia G,Pascal D,Yann D. The Citrate Metabolism in Homo-and Heterofermentative LAB:A Selective Means of Becoming Dominant over Other Microorganisms in Complex Ecosystems[J]. Food and Nutrition Sciences,2014,5:953-969.
[6]Quintáns G N,Repizo G,Magni C,et al. Citrate Metabolism and Aroma Compound Production in Lactic acid Bacteria[C]. In:Mayo B,López P,Pérez-Martínez G,Eds.,Molecular Aspects ofLactic acid Bacteria for Traditional and New Applications. Research Signpost,Kerala,India,2008:65-88.
[7]Bartowsky E J,Henschke P A. The ‘buttery’ attribute of wine-diacetyl-desirability,spoilage and beyond[J]. International Journal of Food Microbiology,2004,96(3):235-252.
[8]林琼. 柠檬酸代谢及转运相关基因对柑橘果实酸度的调控机制[D]. 杭州:浙江大学,2015.
[9]张规富,谢深喜. 柑橘果实柠檬酸代谢研究进展[J]. 中国园艺文摘,2012(8):1-4.
[10]韦函忠,马少敏,韦朝英. 啤酒发酵中双乙酰的产生和α-乙酰乳酸脱羧酶的应用[J]. 广西轻工业,2011(8):17-18,34.
[11]李亚辉. 酒类酒球菌SD-2a和31MBR的β-D-葡萄糖苷酶研究[D]. 杨凌:西北农林科技大学,2013.
[12]Krieger S A,Lempere E,Ernst M. Management of malolactic fermentation with regard to flavour modification. Session 3B,Flavour modification in the winery:microbiological[C]. Proceedings of 5th International Symposium on Cool Climate Viticulture and Oenology. Melbourne,Australia,2000:1-4.
[13]García-Quintáns N,Repizo G,Magni M,et al. Activation of the Diacetyl/Acetoin Pathway in Lactococcus lactis subsp. lactis bv. diacetylactis CRL264 by Acidic Growth[J]. Applied and Enviromental Microbiology,2008,74(7):1988-1996.
[14]Olguin N,Bordons A,Reguant C. Influence of ethanol and pH on the gene expression of the citrate pathway inOenococcusoeni[J]. Food Microbiology,2009,26:197-203.
[15]Da Silverira M G,Abee T. Activity of ethanol-stresssed Oenococcus oeni cells:a flow cytometric approach[J]. Journal of Applied Microbiology,2009,106:1690-1696.
[16]Lonvaud-Funel A,Zmirou C,Larue F. Le métabolisme de l’acide citrique par les bactéries lactiques de la fermentation malolactique des vins[J]. Sci Aliments,1984,4:81-85.
[17]Salou P,Loubiere P,Pareilleux A. Growth and energetics ofLeconostocoenosduring comatabolism of glucose with citrate or gructose[J]. Applied and Enviromental Microbiology,1994,60(5):1459-1466.
Effect of different conditions on citrate metabolism byOenococcusoeniin model wine
REN Xiao-ning1,ZHANG Yu1,CHEN Qi-ling1,LIU Shu-wen1,2,3,*
(1.College of Enology,Northwest Agriculture and Forestry University,Yangling 712100,China;2.Shaanxi Engineering Research Center of Viti-Viniculture,Yangling 712100,China;3.Heyang Experimental Demonstration Station,Northwest Agriculture and Forestry University,Heyang 715300,China)
WithOenococcusoeni31-DH as material for malolactic fermentation,the effects of pH,ethanol and glucose on the citrate metabolism during and after malolactic fermentation were studied. Ion exclusion chromatography was used to measure the contents of the related substances. The results showed that the experiment was time-saving with simple pretreatments,good separation degree,recovery rate between 87%~108% and RSD between 0.77%~4.33% which met the requirements of analysis. With lower pH values,higher ethanol contents and lower glucose contents of the fermentation broth,the citrate metabolism was slower,the lactic acid,acetic acid and 2,3-butanediol contents were lower,while the diacetyl content peak was higher. When the fermentation broth contained no ethanol,the malic acid,citric acid and glucose were metabolized rapidly,associated with mass growth of bacteria,higher contents of lactic acid,acetic acid and 2,3-butanediol,while no diacetyl. When the fermentation broth contained no glucose,the rate of citrate metabolism accelerated,lactic acid production was low and the production of 2,3-butanediol and diacetyl was high. pH,ethanol and glucose had significant effects on the citrate metabolism ofO.oeni.
fermentation conditions;model wine;Oenococcusoeni;citrate metabolism
2016-05-24
任晓宁(1992-),女,硕士研究生,研究方向:酿酒微生物,E-mail:renxiaoning543@163.com。
*通讯作者:刘树文(1965-),男,教授,研究方向:葡萄酿酒微生物,E-mail:liushuwen@nwsuaf.edu.cn。
现代农业产业技术体系建设专项资金资助项目(nycytx-30-ch-03)。
TS262.6
A
:1002-0306(2017)04-0180-07
10.13386/j.issn1002-0306.2017.04.026
