外源锌浸种处理对绿豆芽生长和营养品质的影响
2017-03-14熊先清胡广林
熊先清,胡广林
(热带生物资源教育部重点实验室,海南大学材料与化工学院,海南海口 570228)
外源锌浸种处理对绿豆芽生长和营养品质的影响
熊先清,胡广林*
(热带生物资源教育部重点实验室,海南大学材料与化工学院,海南海口 570228)
为开发一种富锌食品,采用不同浓度硫酸锌(0~200 mg Zn2+/L)溶液浸泡绿豆种子8 h并水培96 h后,研究外源锌浸种对绿豆芽生长指标、主要营养成分、植酸及锌积累的影响。结果显示:25~75 mg Zn2+/L锌溶液浸种可以提高绿豆芽下胚轴长、根长、生物产量和主要营养成分的含量,其中以50 mg Zn2+/L最显著,该浓度锌溶液浸种后培育的绿豆芽中游离氨基酸总量、维生素C、可溶性蛋白、可溶性糖的含量分别达到8.96 mg/g、23.76 mg/100 g、56.82 mg/g、6.62 mg/g;在实验考察的浓度范围内,绿豆芽中锌含量增加了90.9%~617.0%;萌发和外源锌浸种分别使植酸含量降低了61.5%和62.0%,但两组间无显著差异(p>0.05)。本研究表明,适当浓度的外源锌(<75 mg Zn2+/L)浸种处理对绿豆的萌发和生长是有利的,不仅能增加微量元素锌的营养价值,同时又能提高绿豆芽的营养品质。
绿豆,锌,维生素C,植酸
锌是人类必需的微量元素,它在人体中承担着许多重要的功能。锌广泛参与体内多种酶的合成,与体内300多种酶的活性有关[1],锌缺乏将影响机体的生长、免疫活性、生育能力和神经发育等众多生理功能[2-3]。人体缺锌的主要原因是食物中生物可利用锌的含量过低。植物性食物中高含量的植酸易与锌形成难溶的植酸锌螯合物,降低人体对锌的吸收[4-5]。随着人类饮食习惯逐渐发生改变,人们对肉类的消费越来越少,而对豆类、谷物等植物性食物的消费依赖性增加,这可能会增加缺锌的风险。美国2015版《美国居民膳食指南》强调了整体饮食结构的重要性,提倡素食,建议少食红肉和加工类肉制品,更加强调多吃蔬菜、粗粮、谷物、豆类等[6]。因此,提高豆类等植物性食物中锌的营养价值具有重要意义。
萌发是一种重要的食品生物加工技术,豆类萌发后的整体营养价值一般得到提高[7],萌发过程中抗营养因子的减少可能会提高锌的生物利用率,但微量元素锌的营养价值仍比较低,为满足人体需要仍需要进行进一步强化。近年来,以糙米、苜蓿等谷物、豆类为载体的富锌食品的研究,国内外有一些报道。课题组早前就大豆、糙米等为载体对锌强化进行研究;Zou等[8-9]研究发现在不影响种子萌发和芽苗生长的前提下,10 μg/mL的外源锌浸种有利于大豆芽对锌的积累,并能显著提高锌的生物可接受率;徐航丹等[10]研究指出硫酸锌浸种能够促进发芽红香糙米对锌的积累,与未发芽红香糙米相比,锌含量增加了355%~1225%。然而,这些研究多集中于评价锌总量,但锌的生物利用性不仅取决于锌的总量,植酸等抗营养因子的变化也是重要因素,然而目前关于锌强化前后植酸等抗营养因子变化的研究却鲜有报道;同时,绿豆芽中重要食物成分是否会受到外源锌浸种处理的影响,在以往的研究中也尚未阐释。本文以绿豆为载体,以硫酸锌浸种的方式,培育富锌绿豆芽,从生长指标、重要食物成分以及植酸含量的变化规律的角度探讨在绿豆萌发过程中进行锌强化的可能性,从而为富锌芽苗菜成为人体补锌的膳食来源并为其进一步在食品领域的应用提供理论基础。

表1 外源锌浸种对绿豆种子发芽率的影响Table 1 Effects of exogenous zinc soaking on germination rate of mung bean seeds
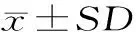
1 材料与方法
1.1 材料与仪器
绿豆(VignaradiataL. Wilczek.) 市售,原产地为山东;考马斯亮蓝G250 Sigma-Aldrich;牛血清蛋白 Fluka;植酸钠 EP,上海金穗生物科技有限公司;硫酸锌 AR,西陇化工股份有限公司;锌标准溶液 1000 μg/mL,国家标准物质研究中心;过氧化氢、硝酸、磷酸 均为GR级试剂;其余均为AR级试剂;实验用水 超纯水,电阻率18.2 MΩ·cm。
DL-5-B型离心机 上海安亭科学仪器厂;0-150型数显游标卡尺 上海恒量量具有限公司;FA1004N电子天平 上海精密仪器有限公司;722S可见分光光度计 上海菁华科技仪器有限公司;TAS-990火焰原子吸收分光光度计 北京普析通用仪器有限责任公司;THZ-82恒温振荡器 常州国华仪器有限公司;HSR025型人工气候箱 南京实验仪器厂。
1.2.1 绿豆芽的培育 称取种皮未破损、饱满的绿豆种子约13 g,并记录质量(M0),分别用3%次氯酸钠溶液消毒30 min。消毒结束后,用超纯水漂洗至无气味后,加入200 mL硫酸锌溶液,含锌量分别为0(CK)、25、50、75、100、150、200 mg Zn2+/L。然后,将其置于25 ℃人工气候箱内浸种8 h。取出后,漂洗数次并沥干,放入已预先使用次氯酸钠消毒处理且铺有一层滤纸的培养盒中,将其置于人工气候箱内于25 ℃条件下培育96 h。每隔6 h浇水一次,确保绿豆种子处于润湿状态即可。
1.2.2 生长指标测定 培育96 h后,统计已经发芽的绿豆数并称鲜重,计算各浓度下绿豆的发芽率、生物产量。芽长超过绿豆任一维长度即视为发芽。随机各选取25根豆芽,用游标卡尺测量绿豆芽的下胚轴粗、下胚轴长和根长。随机另取25根豆芽,称其鲜重(m鲜),于(105±1) ℃下烘干至恒重,计算出豆芽的含水率。
1.2.3 绿豆芽中主要营养成分测定 可溶性蛋白测定采用考马斯亮蓝比色法[11];可溶性糖测定采用苯酚法[11];维生素C测定采用2,6-二氯靛酚滴定法,参考GB/T 6195-1986;游离氨基酸总量测定采用茚三酮溶液显色法[11]。结果以鲜重计。
1.2.4 锌含量测定 培育96 h后,用超纯水漂洗绿豆芽数次后,于(60±1) ℃下烘干至恒重,玛瑙研钵研磨后,过60目筛,将样品放入样品袋中,并贮存于干燥器内备用。取0.3 g左右豆芽干粉样品经硝酸和过氧化氢混合液(体积比4∶1)消化至澄清。消化液中锌的含量用火焰原子吸收分光光度计测定(仪器参数:波长213.9 nm;等电流3.0 mA;光谱带宽0.4 nm;燃气流量1400 mL/min),结果以干重计。
1.2.5 植酸含量测定 植酸测定采用三氯化铁比色法,采用傅启高等[12]的方法。
1.2.6 数据处理 采用SPSS 22.0和Origin 9.0进行数据分析,并使用SPSS 22.0统计软件进行差异显著性分析(Duncan多重比较,p=0.05)。本实验中每个试样作3个平行样。
2 结果与分析
2.1 绿豆萌发的影响
为切实维护劳动者权益,提高劳动争议案件处理的质量和效率,诸暨市大力推动劳动争议调解组织建设。2010年,成立了诸暨市劳动争议人民调解指导会员会,并设立了市一级的劳动争议人民调解委员会。2004年至2017年,该市劳动争议人民调解委员会共调解案件1034起,成功904起。[5]该市还在各乡镇(街道)及规模较大的企业,建立了劳动争议调解组织。
表1数据显示,不同浓度外源锌浸种对发芽率影响不同。当浸种液浓度在0~75 mg Zn2+/L范围内时,绿豆的发芽率有小幅度增加,但与对照组相比无显著性差异(p>0.05)。随着浸种液中锌浓度的进一步增加,绿豆的发芽率呈现出显著降低的趋势(p<0.05),100 mg Zn2+/L组与150 mg Zn2+/L组之间发芽率差异不显著(p>0.05);外源锌浓度为200 mg Zn2+/L时,发芽率达到最低值97.5%。由此可见,高浓度外源锌溶液浸种不利于绿豆种子的萌发,Lefèvre等[13]认为这是由于过量的锌加速了活性氧的生成,并对种子中贮存的蛋白质、脂质等物质造成了氧化性损伤,进而影响了种子萌发和幼苗生长。
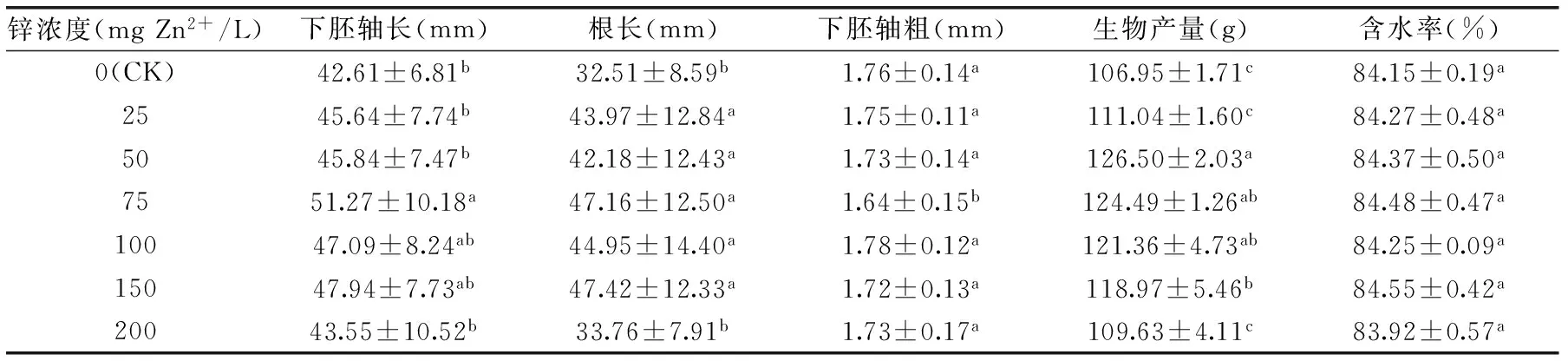
表2 外源锌浸种对绿豆芽生长的影响 Table 2 Effects of exogenous zinc soaking on the growth of mung bean sprouts
2.2 对绿豆芽生长的影响
表2结果显示了外源锌浸种对绿豆芽下胚轴长、根长、下胚轴粗、生物产率和含水率的影响。从表2结果可看出,锌浓度在50~75 mg Zn2+/L范围内各个指标总体较好。锌浓度为25~75 mg Zn2+/L时,下胚轴长呈增加的趋势,在75 mg Zn2+/L时下胚轴长达51.27 mm,显著高于对照组(p<0.05);生物产量在锌浓度为50 mg Zn2+/L时达到最大值126.50 g;而下胚轴粗(75 mg Zn2+/L除外)及含水率并无显著变化(p>0.05)。当锌浓度高于75 mg Zn2+/L时,绿豆芽受到较高浓度锌的影响导致生长受到抑制。研究发现,锌对于植物生长的作用主要是通过调节植物生长素(IAA)的代谢来实现的,适量锌能够间接促进IAA的合成,使芽苗中生长素含量增加,进而表现出对植物生长的促进作用[14]。一般认为,适当浓度的锌溶液浸种可以提高种子的萌发率和物质代谢水平并促进植物的生长,但浓度过高时则出现抑制效应[15]。
2.3 绿豆芽中可溶性蛋白的影响
由图1可知,与CK组相比,硫酸锌溶液浸种后培育的绿豆芽中蛋白质含量有不同程度的增加。在0~50 mg Zn2+/L范围内,蛋白质含量为45.76~56.82 mg/g。锌浓度为50 mg Zn2+/L时达到最大值56.82 mg/g,与CK组相比增加了24.17%;锌浓度在50~200 mg/L时,可溶性蛋白的含量经“V”型变化后出现降低趋势,在200 mg/L时达最低值42.37 mg/g。可溶性蛋白含量的增加可能与锌能够提高硝酸还原酶的活性[16]和核酸含量[17]有关。锌浓度较低时,核糖核酸酶的活性低,RNA含量较高,有利于蛋白质的合成;同时,锌浓度的增加使硝酸还原酶的活性增加,能够促进蛋白质的合成。而锌浓度过高时能对硝酸还原酶的活性产生胁迫作用[18],DNA和RNA的合成也受到抑制,导致蛋白质合成受阻[17,19]。
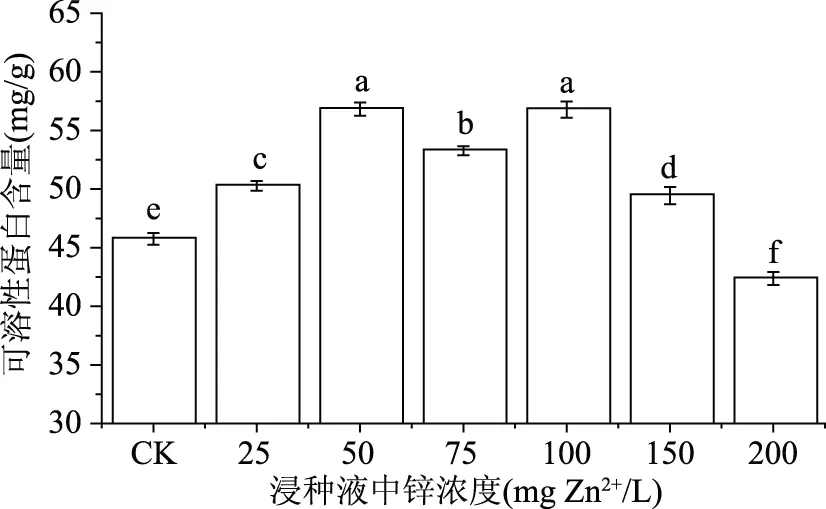
图1 外源锌浸种对绿豆芽中可溶性蛋白的影响Fig.1 Effect of exogenous zinc on solubleprotein in mung bean sprouts
2.4 绿豆芽中游离氨基酸总量的影响
图2显示了外源锌溶液浸种对游离氨基酸总量的影响。浸种液浓度为25 mg Zn2+/L时,游离氨基酸总量达到7.86 mg/g(FW),与CK组相比虽有小幅度增加,但差异不明显。浸种液浓度为50 mg Zn2+/L时,游离氨基酸的含量达到最大值8.96 mg/g(FW),游离氨基酸总量与对照相比增加了15.46%;当浓度大于75 mg Zn2+/L时游离氨基酸总量随浸种液中锌浓度的增加而降低,且浓度在150~200 mg Zn2+/L范围内均低于CK组。说明外源锌浓度处于中低水平时可促进蛋白质降解为氨基酸,当浓度过高时,蛋白质的合成受阻,蛋白质的降解也受到抑制。
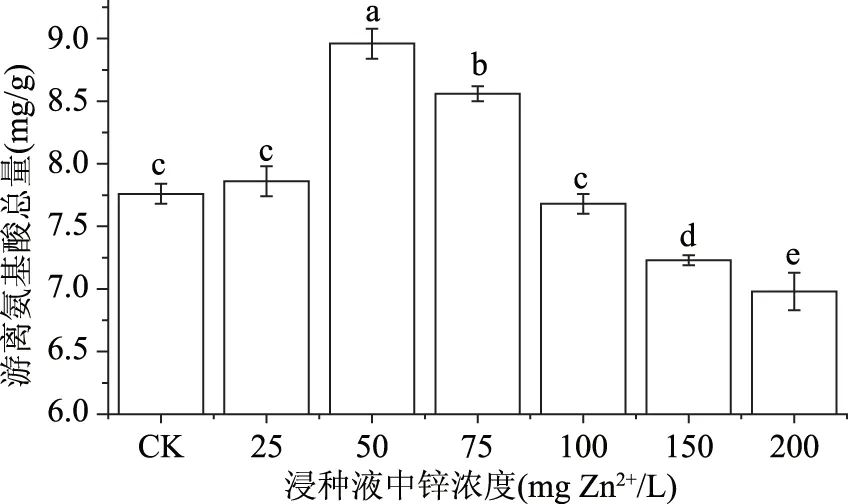
图2 外源锌浸种对绿豆芽中游离氨基酸总量的影响Fig.2 Effect of exogenous zinc on total free amino acid in mung bean sprouts
2.5 绿豆芽中可溶性糖的影响
由图3可知,外源锌浸种可提高绿豆芽可溶性糖含量达17.16%~73.00%;当锌浓度为75 mg Zn2+/L时,可溶性糖的积累量达到最大值7.56 mg/g(FW);处于高浓度(>150 mg Zn2+/L)范围时,可溶性糖的含量趋于稳定。可溶性糖是植物内重要的渗透压调节物质,随着锌浓度的增加,植物会积累一定量的可溶性糖,降低渗透势以适应环境的变化,致使植物体内的可溶性糖含量增加,而锌浓度过高时这种渗透调节作用被破坏,导致可溶性糖的含量降低[20]。
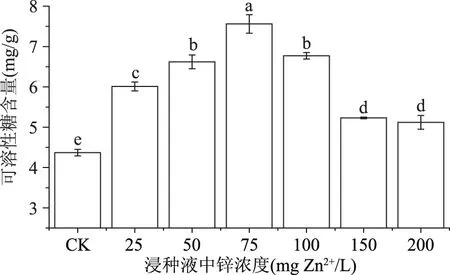
图3 外源锌浸种对绿豆芽中可溶性糖的影响Fig.3 Effect of exogenous zinc on soluble sugar in mung bean sprouts
2.6 绿豆芽中维生素C的影响
由图4可看出,锌浓度在0~50 mg Zn2+/L范围内维生素C积累的幅度较大,50 mg Zn2+/L的外源锌溶液浸种可提高绿豆芽维生素C的含量16.87%,当浸种液中锌浓度大于50 mg Zn2+/L时,维生素C的含量开始降低。研究指出,在一定范围内,锌的增加可提高细胞分裂活性[21],并促进绿豆芽的生长以及维生素C的合成。锌浓度过高时,淀粉水解酶及酸性磷酸酶等酶的活性降低[13],从而限制了淀粉水解产生葡萄糖,导致维生素C的生物合成受阻。
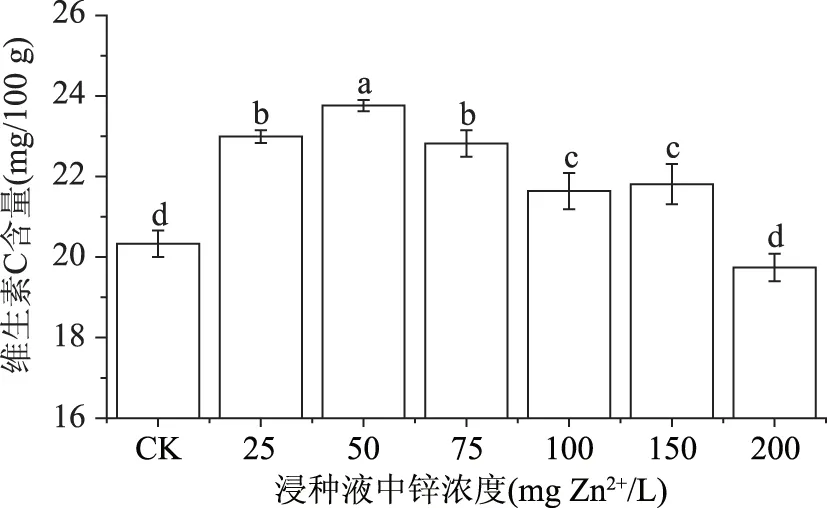
图4 外源锌浸种对绿豆芽中维生素C的影响Fig.4 Effect of exogenous zinc on vitamin C in mung bean sprouts
2.7 绿豆芽中锌积累的影响
从图5看出,硫酸锌溶液浸种能够显著增加绿豆芽中锌的含量。在本实验考察的浓度范围内(0~200 mg Zn2+/L),绿豆芽中锌含量随浸种液中锌浓度的升高而增加,增幅达90.9%~617.0%。按中国营养学会推荐的每日锌摄入量(recommended nutrient intakes,RNIs,4岁以上儿童及成年男性、女性分别为5.5、12.5、7.5 mg/d)[22],假设每日食用外源锌浓度为75 mg Zn2+/L培育的绿豆芽100 g(FW),能提供每日锌量为1.39 mg,远低于锌的可耐受最高摄入量(tolerable upper intake level,UL,4岁以上儿童和成年人分别为12、40 mg/d)[22]。此外,无机态的锌经植物的生物转化作用转化为有机态时,安全性一般是提高的[9]。因此,按正常的食用量食用这种富锌的绿豆芽引发锌中毒的可能性较小。
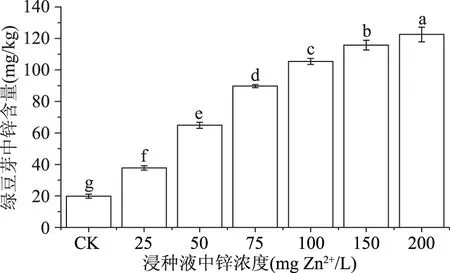
图5 硫酸锌浸种对绿豆芽中锌积累的影响Fig.5 Effect of exogenous zinc soaking on zinc accumulation in mung bean sprouts
2.8 绿豆芽中植酸、植酸/锌摩尔比的影响
由表3可知,绿豆分别经过超纯水浸种和50 mg Zn2+/L硫酸锌溶液浸种所培育的绿豆芽中植酸含量均显著降低(p<0.05),分别使植酸含量降低了61.5%和62.0%。植酸含量的降低可能是由于绿豆萌发过程中内源的植酸酶被激活,促进了植酸的分解[23]。
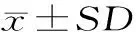
从图5看出,外源锌浸种能够显著提高绿豆芽中锌的含量,但是否会显著增加绿豆芽中锌的生物利用率,抗营养因子的变化对锌的生物利用率具有重要影响[23-24]。在植物性食品中,锌的生物利用率主要受到植酸的影响[24],植酸/锌摩尔比是评价锌生物利用率的重要指标,中国营养学会建议植酸/锌摩尔比应低于15,才能获得较高的利用率[22]。由表3可知,萌发和外源锌浸种均能显著降低绿豆中植酸/锌摩尔比值。虽然绿豆萌发后植酸/锌摩尔比显著降低,这可能有利于提高锌的生物利用率,但绿豆锌含量较低无法提供足够的锌,因此无法增加生物可利用锌的总量。Wei[25]等使用Caco-2细胞模型评价了锌强化的发芽糙米中锌的生物利用率,研究指出锌强化能够显著提高生物可利用锌的总量和锌的生物利用率。外源锌浸种后萌发的绿豆,在减少植酸含量的同时,增加了锌的总量,使绿豆芽植酸/锌摩尔比更低,推断绿豆芽中生物可利用锌的总量及锌的生物利用率是提高的,即微量元素锌的营养价值得到提高。
3 结论
本研究主要检测了不同浓度外源锌溶液浸种处理对绿豆的发芽情况和绿豆芽中营养成分的含量、锌积累及植酸含量的影响。低浓度外源锌浸种处理后,绿豆发芽率无显著影响(p>0.05),但浓度过高(≥100 mg Zn2+/L)时绿豆萌发明显受到抑制(p<0.05)。25~75 mg Zn2+/L锌溶液浸种可以提高绿豆芽下胚轴长、根长、生物产量和主要营养成分的含量,其中以50 mg Zn2+/L最显著,该浓度锌溶液浸种后培育的绿豆芽中游离氨基酸总量、维生素C、可溶性蛋白、可溶性糖的含量分别达到8.96 mg/g、23.76 mg/100 g、56.82 mg/g、6.62 mg/g。25~200 mg Zn2+/L锌溶液浸种,绿豆芽中锌积累量达90.9%~617.0%,萌发和外源锌(50 mg Zn2+/L)浸种分别使植酸含量降低了61.5%和62.0%,但两组间无显著差异(p>0.05)。
研究结果表明,绿豆在萌发过程中能够吸收、富集微量元素锌,且绿豆富集锌的作用随着外源锌浓度的增加而增强,适当浓度的外源锌(25~75 mg Zn2+/L)浸种,不仅能够促进绿豆的萌发和生长,而且萌发后的绿豆芽营养品质有所提高;但外源锌浓度过高时,从绿豆种子发芽情况及营养成分的含量来看,绿豆处于不良状态,因此高浓度的锌溶液浸种对于种子的萌发和生长是不利的。由植酸/锌摩尔比,预测外源锌浸种能够提高生物可利用锌的总量和锌的生物利用度。此外,按正常食用量食用这种富锌绿豆芽发生锌中毒的可能性极小,可考虑将其作为人体补锌的一种膳食来源,这对改善人群锌营养具有重要作用。
[1]Prasad A S. Discovery of human zinc deficiency:50 years later[J]. Journal of Trace Elements in Medicine and Biology,2012,26(2):66-69.
[2]Hotz C,Brown K H. Assessment of the risk of zinc deficiency in populations and options for its control[M]. International nutrition foundation:for UNU,2004.
[3]Nikolic M,Nikolic N,Kostic L,et al. The assessment of soil availability and wheat grain status of zinc and iron in Serbia:Implications for human nutrition[J]. Science of the Total Environment,2016,553:141-148.
[4]Wang Z,Liu Q,Pan F,et al. Effects of increasing rates of zinc fertilization on phytic acid and phytic acid/zinc molar ratio in zinc biofortified wheat[J]. Field Crops Research,2015,184:58-64.
[5]Lazarte C E,Carlsson N G,Almgren A,et al. Phytate,zinc,iron and calcium content of common Bolivian food,and implications for mineral bioavailability[J]. Journal of Food Composition and Analysis,2015,39:111-119.
[6]U.S. Department of Health and Human Services,U.S. Department of Agriculture. Dietary Guidelines for Americans 2015-2020. 8th Edition. December 2015. Accessed at http://health.gov/dietaryguidelines/2015/guidelines on 9 March 2016.
[7]Megat R M R,Azrina A,Norhaizan M E. Effect of germination on total dietary fibre and total sugar in selected legumes[J]. International Food Research Journal,2016,23(1):257-261.
[8]Zou T,Xu N,Hu G,et al. Biofortification of soybean sprouts with zinc and bioaccessibility of zinc in the sprouts[J]. Journal of the Science of Food and Agriculture,2014,94(14):3053-3060.
[9]徐娜,邹涛,庞锦伟,等. 外源锌浸种对大豆种子萌发,大豆芽生长及锌积累的影响[J]. 大豆科学,2012,31(6):932-936.
[10]徐航丹,胡广林,熊先清,等. 硫酸锌溶液浸泡对红香糙米萌发,锌积累量及其他营养成分的影响[J]. 食品工业科技,2015,36(17):146-149.
[11]李合生.植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2006.
[12]傅启高,李慧荃. 三氯化铁比色法测定植酸含量的研究[J]. 营养学报,1997,19(2):216-220.
[13]Lefèvre I,Marchal G,Corréal E,et al. Variation in response to heavy metals during vegetative growth in Dorycnium pentaphyllum Scop[J]. Plant Growth Regulation,2009,59(1):1-11.
[14]Mishra V K,Kumar A.Invitroassessment of plant growth promoting potential of Klebsiella pneumoniae,Bacillus amyloliquefaciens andBacillussp[J]. International Journal of Agricultural Science and Research(IJASR),2015,5(3):69-79.
[15]周毅,郑猛猛,卢松贺,等. 硫酸锌处理对玉米幼苗养分和锌累积的影响[J]. 农业环境科学学报,2015,34(1):29-36.
[16]Tripathi B N,Mehta S K,Gaur J P. Recovery of uptake and assimilation of nitrate inScenedesmussp. previously exposed to elevated levels of Cu2+and Zn2+[J]. Journal of Plant Physiology,2004,161(5):543-549.
[17]Kakuzo Kitagishi,Hitoshi Obata,Takashi Kondo. Effect of Zinc Deficiency on 80S Ribosome Content of Meristematic Tissues of Rice Plant[J]. Soil Science & Plant Nutrition,1987,33(3):423-429.
[18]郭大勇,谢建磊,朱仕贵,等. 叶面喷施锌肥对生菜各器官中硝酸盐含量和硝酸还原酶活性的影响[J]. 西北农业学报,2008,17(5):302-305.
[19]虞华芳,汪志君,方维明. 锌在麦芽中富集研究及对麦芽生理生化特性的影响[J]. 现代食品科技,2005,21(1):1-5.
[20]李金霞,宋志蕾,张志鹏. 重金属锌胁迫对小扁豆种子萌发和幼苗生长的影响[J]. 安徽农业科学,2015,43(26):1-3.
[21]Pavlíková D,Pavlík M,Procházková D,et al. Nitrogen metabolism and gas exchange parameters associated with zinc stress in tobacco expressing an ipt gene for cytokinin synthesis[J]. Journal of Plant Physiology,2014,171(7):559-564.
[22]中国营养学会. 中国居民膳食营养素参考摄入量(2013版)[M].北京:科学出版社,2014.
[23]Luo Y,Xie W. Effect of soaking and sprouting on iron and zinc availability in green and white faba bean(ViciafabaL.)[J]. Journal of Food Science and Technology,2014,51(12):3970-3976.
[24]Lazarte C E,Carlsson N G,Almgren A,et al. Phytate,zinc,iron and calcium content of common Bolivian food,andimplications for mineral bioavailability[J]. Journal of Food Composition and Analysis,2015,39:111-119.
[25]Wei Y,Shohag M J I,Wang Y,et al. Effect of zinc sulfate fortification in germinated brown rice on seed zinc concentration,bioavailability,and seed germination[J]. Journal of Agricultural and Food Chemistry,2012,60(7):1871-1879.
Effect of exogenous zinc soaking on the growth and nutritional quality of mung bean sprouts
XIONG Xian-qing,HU Guang-lin*
(Key Laboratory of Tropical Biological Resources of Ministry of Education,College of Materials and Chemical Engineering,Hainan University,Haikou 570228,Hainan)
In order to develop a zinc-rich food,mung bean seeds were soaked for 8 h in zinc sulfate solutionsof different concentration of zinc(0~200 mg Zn2+/L)and then cultivated for 96 h with deionized water. The influence of soaking with exogenous zinc on growth,zinc accumulation,phytic acid content and main nutrient components of mung bean sprouts was investigated. The results showed that zinc sulfate solutions in the concentration range of 25~75 mg Zn2+/L,especially 50 mg Zn2+/L,could improve hypocotyl length,root length,biology yield and main nutrient components of mung bean sprouts. Total free amino acid,vitamin C,soluble protein and soluble sugar reached 8.96 mg/g,23.76 mg/100 g,56.82 mg/g,and 6.62 mg/g in this concentration,respectively.Zinc content in mung bean sprouts increased by 90.9%~617.0% within the experimental concentration range. Germination and exogenous zinc soaking resulted in the reduction of the phytic acid content by 61.5% and 62.0%,respectively,and there was no significant difference between the two groups(p>0.05). This study showed that proper concentration of exogenous zinc(<75 mg Zn2+/L)can stimulate the germination of mung bean seeds and the growth of mung bean sprouts. In this way,the nutritional value of trace element zinc and the nutritional quality of mung bean sprouts were enhanced.
mung bean;zinc;vitamin C;phytic acid
2016-04-11
熊先清(1990-),男,在读硕士研究生,研究方向:微量元素生物强化,E-mail:arousexxq@yeah.net。
*通讯作者:胡广林(1967-),男,博士,教授,主要从事食品营养成分方面的工作,E-mail:glhu@hainu.edu.cn。
国家自然科学基金资助项目(31460390);海南省自然科学基金资助项目(212021)。
TS255.1
A
:1002-0306(2017)04-0170-06
10.13386/j.issn1002-0306.2017.04.024
