猴头菇/香菇β葡聚糖对面包品质和淀粉消化性的影响
2017-03-14庄海宁高林林邴芳玲张劲松
庄海宁,高林林,冯 涛,*,邴芳玲,桑 敏,杨 焱,张劲松
(1.上海市农业科学院食用菌研究所国家食用菌工程技术研究中心,上海 201403;2.上海应用技术大学香料香精技术与工程学院,上海 201418)
庄海宁1,高林林2,冯 涛2,*,邴芳玲2,桑 敏2,杨 焱1,张劲松1
(1.上海市农业科学院食用菌研究所国家食用菌工程技术研究中心,上海 201403;2.上海应用技术大学香料香精技术与工程学院,上海 201418)
β-葡聚糖具有影响淀粉消化性的潜力,以致可以降低血糖的生成指数。随着β-葡聚糖的粘度增加,体外的淀粉消化性可以降低,血糖生成指数亦可降低。本文主要研究在面包中添加猴头菇β-葡聚糖提取物(HEBG,添加量0.5%、1.0%)和香菇β-葡聚糖提取物(LEBG,添加量0.5%、1.0%)后,面包品质、质构特性及体外消化的变化。结果发现,添加HEBG、LEBG后,能增大面包的比容,但对面包色泽影响较小。通过对面包质构特性的测定,发现HEBG、LEBG对面包硬度、胶着性、咀嚼性等指标具有明显的改善作用,内部结构细腻,质地柔软,同时能有效地延缓面包的老化,使得面包在储藏期间硬度增加趋势变缓。面包硬度由对照组的271.25 g分别降低至134.7 g(0.5% HEBG)和184.78 g(1.0% LEBG),且与对照组具有显著性差异。此外,通过淀粉体外消化的测定,发现HEBG/LEBG能够延缓淀粉的消化,降低葡萄糖的释放速率,主要表现在快消化淀粉(RDS)的含量降低,慢消化淀粉(SDS)和抗性淀粉(RS)含量的增加,结果表明1.0% HEBG的添加对淀粉消化的影响最大,相较于对照组,1.0%HEBG白面包中慢消化淀粉增加了10.54%,抗消化淀粉增加了22.5%。
β-葡聚糖,面包,淀粉消化,质构特性
随着我国经济的快速发展、生活节奏的加快、饮食习惯和食物构成的改变,糖尿病、心血管疾病、肥胖症等慢性疾病的发生比例不断上升。高血糖生成指数食物摄入而引发的餐后高血糖是这些慢性疾病的重要风险因子,因此,淀粉类食物摄入后产生的血糖反应引起了更多食品领域和健康机构研究人员的关注[1-2]。
面包是一种非常方便、深受大众喜欢的食品。但面包是高血糖生成指数食物,摄入人体后,淀粉被迅速水解消化,以葡萄糖形式进入血液中,导致血糖迅速升高[3-4]。β-葡聚糖是一种可溶性多糖,对健康人群及糖尿病患者的餐后血糖及胰岛素应答水平均有降低的效果[5]。目前,食用菌多糖因其独特的生理、生物活性被直接应用到保健食品或药品中[6],此外,也因其具有凝胶、增稠、持水等食品加工特性被用来作为功能性食品配料,有效地改善食品的质构特性,提高食品的营养保健功效[7-8]。
已有研究报道,大麦、燕麦中的可溶性膳食纤维(β-葡聚糖)能够延缓淀粉的消化,使得葡萄糖释放缓慢,降低餐后血糖及胰岛素应答水平,保持血糖的稳定[9-12]。此外,β-葡聚糖不仅具有降血脂、降胆固醇作用和减肥功效,还可以预防心血管疾病、提高免疫能力、改善肠胃功能[6,13-14]。
因此,本实验将猴头菇/香菇β-葡聚糖提取物应用在面包中,研究猴头菇/香菇β-葡聚糖提取物对面包品质、质构特性及老化的影响。同时,通过淀粉体外消化模拟实验,考察猴头菇/香菇β-葡聚糖提取物对淀粉消化的影响,探讨β-葡聚糖在淀粉基质低血糖生成指数食品的可行性,为新型保健食品的开发提供理论依据和技术参考。
1 材料与方法
1.1 材料与仪器
猴头菇/香菇β-葡聚糖提取物 以香菇、猴头菇为原料,采用复合酶法辅助热水浸提对猴头菇/香菇β-葡聚糖进行提取[15],得到猴头菇β-葡聚糖HEBG(多糖含量为91.7%,β-葡聚糖占83.94%)和香菇β-葡聚糖LEBG(多糖含量为85.2%,β-葡聚糖占76.52%),经高效凝胶渗透色谱测定得二者分子量分别为2.120×106u和1.868×106u;面包粉 新乡市新良粮油加工有限责任公司;安佳黄油 上海爱普食品科技(集团)有限公司;酵母、面包改良剂 安琪酵母股份有限公司;鸡蛋、食盐、白砂糖 市售;胃蛋白酶P7000(酶活≥250 U/mg)、胰酶P7545(8×USP specifications)、淀粉葡糖苷酶A7095(酶活≥260 U/mL)、转化酶I4504(酶活≥300 U/mL) Sigma公司;无水乙醇、盐酸、三水合醋酸钠、冰醋酸 均为分析纯,国药集团化学试剂有限公司;葡萄糖测试盒(GOPOD) 南京建成生物工程研究所。
ML104电子天平、FE20plus实验室pH计 梅特勒-托利多仪器(上海)有限公司;立式和面机 广州市番禺力丰食品机械厂;SM-901C烤箱、SPC-40FP醒发箱、SM-302N吐司切片机 新麦机械(无锡)有限公司;WSC-S测色色差计 上海仪电物理光学仪器有限公司;快速粘度测定仪(RVA) 澳大利亚Newport Scientific公司;TA-Xtplus/30物性测定仪 英国Stable Micro 公司;QL-901漩涡混合仪 海门市其林贝尔仪器制造有限公司;79-2双单磁力搅拌器 金坛市科析仪器有限公司;DK2电热恒温振荡水槽 上海一恒科学仪器有限公司;TGL-16M台式高速冷冻离心机 湖南湘仪实验室仪器开发开发有限公司;UV2350紫外可见分光光度计 尤尼柯(上海)仪器有限公司。
1.2 实验方法
1.2.1 酶液的配制
1.2.1.1 胃蛋白酶液的配制 先量取0.312 mL的盐酸与75 mL蒸馏水混合均匀,加入0.375 g的胃蛋白酶,磁力搅拌混合均匀,最后加入0.375 g的瓜尔豆胶混合均匀,待用。
1.2.1.2 复合酶液的配制 将4 g胰淀粉酶和26.6 mL水加入到50 mL的离心管中,漩涡振荡10 min,4000 r/min离心10 min,将0.98 mL的淀粉葡糖苷酶,5.04 mL水,21.0 mg的转化酶加入到另一个离心管中,并吸取37.8 mL的胰淀粉酶上清液,混合均匀,待用。
1.2.2 糊化性质的测定 准确称取添加量分别为0,0.5% HEBG,1.0% HEBG,0.5% LEBG和1.0% LEBG的面包粉-β-葡聚糖提取物的混合物3.00 g,与25 mL蒸馏水于RVA专用铝盒内混合,手动搅拌均匀,用快速粘度测定仪(RVA)测定糊化曲线。测定程序为:50 ℃平衡1 min,以6 ℃/min的速率升温至95 ℃,保持5 min,再以6 ℃/min的速率降温至50 ℃,保持2 min。连续测定其粘度,转速设置转速960 r/min保持10 s后迅速降为160 r/min,并保持稳定,粘度单位以cP表示[16]。
通过软件得到糊化温度、峰值粘度、最终粘度等参数,分析HEBG和LEBG对面包粉糊化性质的影响。
1.2.3 面包的制备 本实验采用二次发酵法制作面包[17]。
1.2.4 面包比容和色泽的测定 面包烤好后,置于室温冷却2 h,用天平测其重量。根据 GB/T20981-2007小米填充法对面包的体积进行测定[18]。面包比容通过以下公式来计算:
式(1)
式中:v-比容,mL/g;V-面包重积,mL;m-面包质量,g。
采用测色色差计对面包芯的色泽进行测定[19]。
式(2)
式中:WI表示面包芯的白度指数,L*表示亮度;a*表示红绿;b*表示黄蓝。
1.2.5 质构特性及面包老化的测定 将烘焙好的面包置于室温条件下自然冷却2 h后,切片,每个面包选择两个10 mm厚的面包片作为测试样品,采用质构仪对面包质构进行测试。参数设定为,探头型号:P/36R圆盘探头;压缩比:50%;测试前速率:2 mm/s;测试速率:2 mm/s;测试后速率:5 mm/s;感应力:5 g;两次压缩时间间隔:5 s[20]。
将面包装入保鲜袋并密封,置于通风处于室温下储藏3 d,每间隔24 h按上述方法对面包硬度进行测定。
1.2.6 面包中淀粉体外消化性的测定
1.2.6.1 总淀粉含量的测定 总淀粉含量的测定参照AOAC996.11的方法[21]。
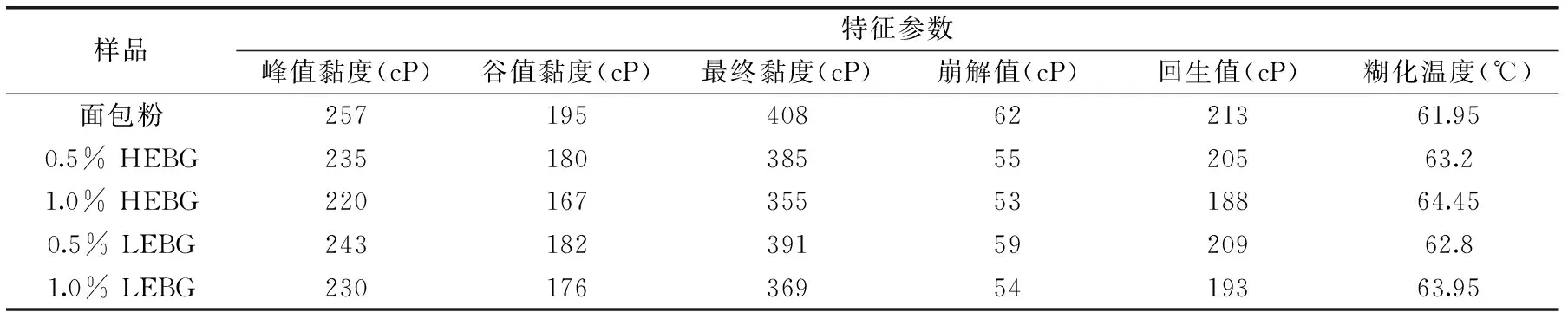
表2 HEBG和LEBG对面包粉糊化特性的影响Table 2 Effect of HEBG and LEBG on the pasting properties of bread wheat flour
1.2.6.2 体外模拟淀粉的消化 在Englyst[22-23]方法的基础上稍作改进,具体操作如下:准确称取含200 mg淀粉的面包样品于玻璃试管中,加入2 mL的去离子水和搅拌子,磁力搅拌混合均匀,将试管放入37 ℃恒温振荡水槽中平衡5 min,加入4 mL的胃蛋白酶液,漩涡混合均匀,置于恒温振荡水槽中37 ℃保温酶解30 min。再加入2 mL的0.5 mol/L pH5.2的醋酸盐缓冲溶液和5个玻璃珠,漩涡混合均匀,置于37 ℃的恒温振荡水槽中平衡25 min,加入2 mL的复合酶液,漩涡混合均匀,置于37 ℃,160 r/min的恒温振荡水槽中开始酶解并计时。在0、15、30、60、90、120、180 min处,分别取50 μL消化液于装有950 μL 90%乙醇的离心管中,振荡混合进行灭酶,10000 r/min离心5 min,取上清液,采用葡萄糖氧化酶(GOPOD)方法,在505 nm处测定葡萄糖的含量。每个样品做3次平行实验,取平均值。
将葡萄糖含量换算成淀粉含量,并计算淀粉水解率。以时间(min)为横坐标,淀粉水解率(%)为纵坐标,绘制淀粉消化曲线。
式(3)
式中:W表示淀粉的水解率,%;Gt表示取样时间点消化液中葡萄糖含量,mg;0.9表示由葡萄糖换算为淀粉的系数;TS表示总淀粉含量,mg。
1.2.6.3 快消化淀粉、慢消化淀粉、抗消化淀粉含量的计算 根据淀粉的消化速率可将淀粉分为:快消化淀粉(Rapidly digestible starch,RDS,在20 min内消化),慢消化淀粉(Slowly digestible starch,SDS,在20~120 min内消化),抗消化淀粉(Resistant starch,RS,超过120 min不消化)。根据以下公式分别计算各个面包样品中RDS、SDS和RS的含量[22]。
式(4)
式(5)
式(6)
式中:G20:水解20 min后产生的葡萄糖含量,mg;FG:未水解时淀粉中的游离葡萄糖含量,mg;G120:水解120 min后产生的葡萄糖含量,mg;0.9:由葡萄糖换算成淀粉的系数;TS指样品中总淀粉含量,mg。
1.2.7 数据分析 实验数据结果采用SAS 9.3(North carolina state university,Raleigh,USA)软件进行方差分析,Duncan多元比较测试比较,当p<0.05 认为差异有显著性。
2 结果与讨论
2.1 HEBG、LEBG对面包粉糊化性质的影响
对HEBG、LEBG质量含量分别为0.5%、1.0%的面包粉分别进行RVA测定,得到的糊化曲线如图1所示。可以发现,所有样品的糊化曲线,随着温度的变化,均呈现有规律的上升(到达峰值黏度)、下降(出现谷值黏度)、再上升(到达最终黏度)的趋势,构成了典型的RVA谱。
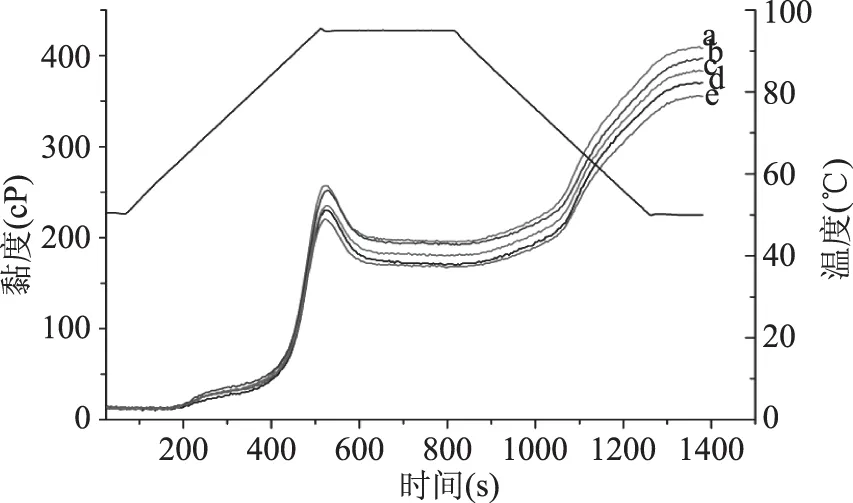
图1 添加HEBG/LEBG的面包粉糊化曲线Fig.1 The pasting curves of bread flour with HEBG and LEBG
由表2可以看出,HEBG和LEBG导致面包粉的峰值黏度、谷值黏度、最终黏度均呈现下降趋势,糊化温度升高。这主要因为β-葡聚糖吸水率高,可以抑制游离水分,从而限制了淀粉的糊化。其中,与LEBG相比较,HEBG相对分子量较大,具有较高的持水能力,能够更好地抑制游离水分,抑制淀粉的糊化[8,23]。崩解值反映淀粉热糊的稳定性;而回生值则是反映淀粉冷糊的稳定性和老化趋势的强弱[15]。随着HEBG和LEBG添加量的增加,崩解值和回生值整体呈下降的趋势,因此β-葡聚糖可以改善凝胶的稳定性并延缓淀粉的老化。

表3 HEBG和LEBG对面包比容和色泽的影响Table 3 Effects of HEBG and LEBG on specific volume and color parameters of bread
注:结果均表示为三组平行实验的平均值±标准偏差,同一列的不同字母表示存在显著性差异(p<0.05);表4、表5同。
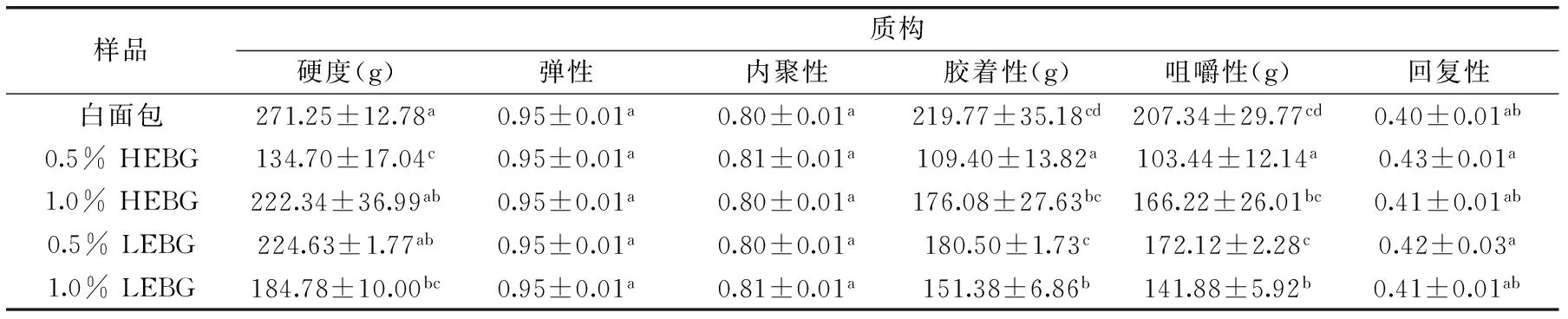
表4 HEBG和LEBG对面包质构的影响Table 4 Effects of HEBG and LEBG on texture parameters of breads
2.2 HEBG、LEBG对面包比容和色泽的影响
比容是衡量面包品质的重要指标,其反映的是面团体积膨胀程度和保持能力,直接影响面包产品的外观、内部组织结构等。面包的色泽,特别是亮度(L*)对于烘焙食品具有重要的作用,严重影响消费者对产品的接受程度。由表3可以看出,与对照组面包相比,HEBG和LEBG的添加使得面包比容增大或减小,虽然会导致面包芯亮度L*和白度指数WI显著变暗,但影响不大,不影响消费者对产品的接受程度,L*下降了2.04%~4.8%,白度WI下降了1.04%~1.5%,a*值提高了17.48%~29.26%,b*值下降了1.41%~4.82%。面包色泽变化主要是由于原料本身色泽、糖类物质和游离氨基酸发生美拉德反应及酚类物质在焙烤过程中氧化的原因[25]。葡聚糖的添加不会对上述反应构成影响,尽管会对原料色泽有轻微影响,但由于添加量很低,故面包的色泽几乎没有可识别的变化。
2.3 HEBG、LEBG对面包质构的影响
由表4可知,与对照组面包相比,0.5% HEBG和1.0% LEBG的添加会显著降低面包的硬度、胶着性与咀嚼性(分别为对照组的49.66%~82.81%、49.78%~82.13%和49.89%~83.01%),对面包的弹性、内聚性、回复性影响不大。这主要是因为β-葡聚糖具有高度亲水性以及在低浓度时可与水分子相互作用形成稳定的三维凝胶网状结构,并且在多重羟基的作用下与面筋蛋白结合成更稳固的网络结构,能够笼络部分淀粉和水分子,增强持水力,减缓淀粉回生,从而可以改善面包的品质和质构,使得面包结构松软,硬度降低[26-27]。
2.4 HEBG、LEBG对面包老化的影响
面包在储藏过程中会发生一系列的物理、化学及微生物的变化,面包水分减少,硬度变大,内部结构变得松散、粗糙,易掉渣,风味丧失等,通常称这种现象为面包老化。从物性学的角度看,面包硬度的增加则是面包老化的重要标志[27]。HEBG和LEBG添加量分别为0.5%、1.0%制作的面包,在室温条件下,分别储存1、2和3 d,测试各个面包的硬度,绘制面包硬度变化趋势图,结果如图2所示。
由图2可知,随着储藏时间的延长,所有面包的硬度均呈现增加的趋势,面包老化的程度逐渐增大,添加HEBG和LEBG的面包硬度增加的趋势比未添加HEBG和LEBG的要缓慢。在储藏过程中面包硬度逐渐增大主要是因为:面包芯中的水分向表皮迁移,导致面包内部水分的损失;淀粉重结晶化及各组分之分的相互作用,导致面包老化,硬度增大[28-29]。而添加β-葡聚糖后面包硬度小而且硬度增加趋势比较平缓的原因主要是:β-葡聚糖具有较强的持水能力,一定程度上阻碍了水分的扩散,延缓了淀粉的老化,从而导致面包硬度增加趋势比较缓慢[26]。

图2 在储藏期间HEBG和LEBG对白面包硬度的影响Fig.2 Effect of HEBG and LEBG on white bread hardness during three day storage
2.5 HEBG、LEBG对淀粉体外消化的影响
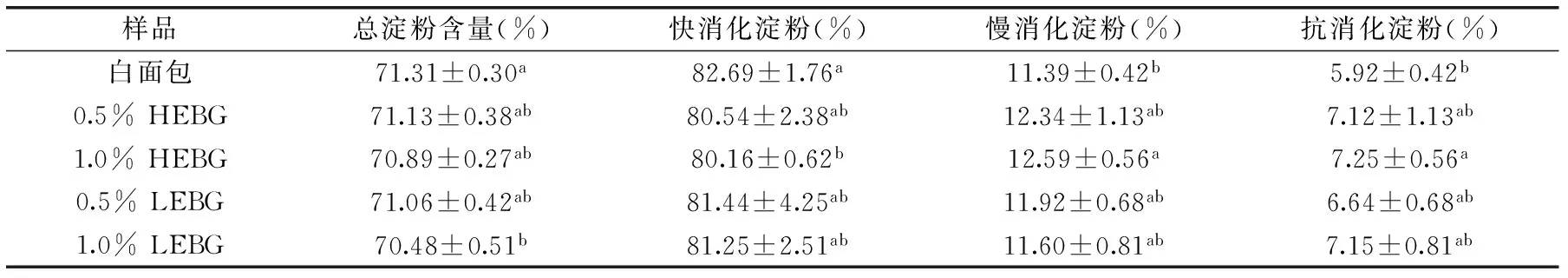
表5 面包总淀粉含量、快消化淀粉含量(RDS)、慢消化淀粉含量(SDS)及抗性淀粉含量(RS)Table 5 The content of total starch,RDS,SDS and RS in the bread
采用体外模拟法分析HEBG和LEBG对面包中淀粉消化性的影响,结果如图3所示。在整个体外消化过程中,所有面包样品在初始时(0~30 min)淀粉的水解速率均较大,在30 min后淀粉水解速率开始减慢,并慢慢趋于平衡。对照组面包淀粉水解速率最快,HEBG和LEBG的添加对面包中淀粉的消化速率均有不同程度的减缓,HEBG延缓淀粉消化的效果要比LEBG好,具体表现为淀粉消化速率大小的顺序:对照面包>0.5% LEBG面包>1.0% LEBG面包>0.5% HEBG面包>1.0% HEBG面包。这主要是因为HEBG和LEBG的添加,一方面导致整个体系粘度增大,延长胃排空的时间,使食物短时间不能到达小肠;妨碍了营养物质与胃肠中消化酶的接触,导致消化速度减慢;此外,体系黏度增大还能够降低食糜通过消化道的速度,造成肠道内细菌增多,从而影响营养成分的吸收[29];另一方面β-葡聚糖是植物性原料的细胞壁成分,难以被消化吸收利用,HEBG和LEBG的加入束缚住了面包中的成分(比如淀粉及蛋白质等)[30],减少了淀粉酶与淀粉的接触,从而减缓淀粉的消化吸收。HEBG和LEBG的分子量及组成成分的不同使得它们对于淀粉消化的影响也有所差异。此外,β-葡聚糖还可通过抑制游离水分,限制淀粉的糊化来降低淀粉的消化[19,31-32]。
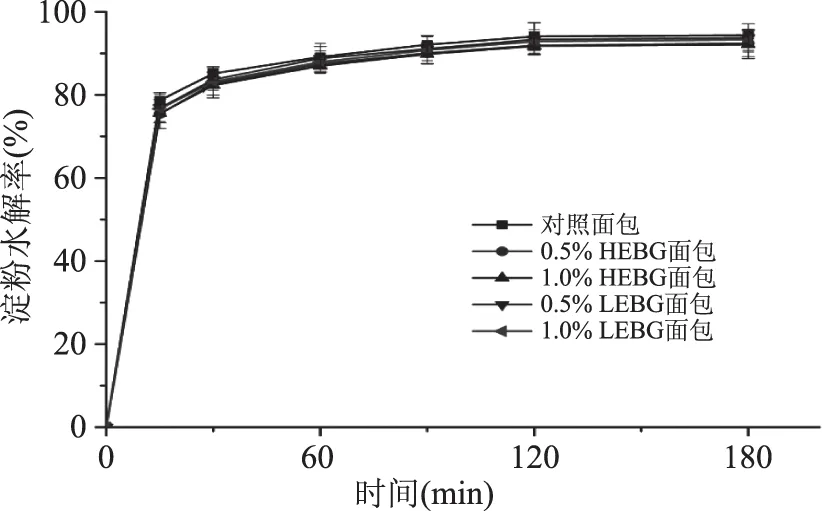
图3 不同面包样品体外消化的水解率曲线Fig.3 In vitro starch hydrolysis rate of different breads
进一步分析图3中的数据,参照快慢淀粉消化理论并通过公式进行计算分析,得到结果如表5所示。由表5可知,HEBG和LEBG延缓了面包中淀粉的消化和吸收,导致快消化淀粉比例下降,慢消化淀粉和抗消化淀粉含量的增加,1.0% HEBG的添加对淀粉消化的影响最大。与对照白面包相比,1.0% HEBG白面包中慢消化淀粉增加了10.54%,抗消化淀粉增加了22.5%。
3 结论
综上所述,与对照组面包相比,添加HEBG、LEBG的面包比容增大或减小,虽然对面包色泽影响显著,但总体不影响消费者对产品的接受程度。综合考虑对面包质构特性和老化的分析,HEBG、LEBG对面包品质具有明显的改善作用,面包硬度由对照组的271.25 g分别降低至134.70 g(0.5% HEBG)和184.78 g(1.0% LEBG),且与对照组具有显著性差异。同时面包的胶着性以及咀嚼性也较对照组降低,且相互间具有显著性差异(0.5% LEBG除外)。添加HEBG、LEBG的面包内部结构细腻,质地柔软,同时能够有效地延缓面包的老化,在储藏期间面包硬度增加趋势缓慢。通过模拟体外消化的研究,添加HEBG、LEBG的面包,快消化淀粉含量低于对照组,而慢消化淀粉和抗性淀粉含量高于对照组,表明添加HEBG、LEBG面包在延缓淀粉消化速率和控制血糖水平上都优于白面包,其中添加1.0%的HEBG的面包中的慢消化淀粉较对照组(11.39%)增加至12.59%,增加了10.54%,而抗消化淀粉较对照组(5.92%)增加至7.25%,增加了22.5%,且分子量HEBG(2.20×106u)大于LEBG(1.868×106u),因此1.0% HEBG添加量对延缓淀粉消化的效果最好。可见,将β-葡聚糖作为功能性配料添加到面包中,既可以改善面包的质构特性,提高其食用品质,还具有一定的控制血糖水平、预防心脑血管等慢性疾病的辅助作用,是开发新型功能性面包产品的一个有益探究。
[1]缪铭,江波,张涛. 低血糖生成指数淀粉类衍生物的研究进展[J]. 食品科学,2008,29(4):452-456.
[2]洪雁,顾娟,顾正彪. 体内外实验测定荞麦淀粉消化特性[J]. 食品科学,2010,31(5):293-297.
[3]Ferrer-Mairal A,Pealva-Lapuente C,Iglesia I,et al.Invitroandinvivoassessment of the glycemic index of bakery products:influence of the reformulation of ingredients.[J]. European Journal of Nutrition,2012,51(8):947-954.
[4]Kumar S B,Prabhasankar P. Low glycemic index ingredients and modified starches in wheat based food processing:A review[J]. Trends in Food Science & Technology,2014,35(1):32-41.
[5]何笑丛,王洁,蔡东联.β-葡聚糖对代谢综合征的防治作用研究进展[J]. 中国医药指南,2013(31):351-353.
[6]Giavasis I. Bioactive fungal polysaccharides as potential functional ingredients in food and nutraceuticals[J]. Current Opinion in Biotechnology,2014,26(7):162-173.
[7]叶忠春,梁智. 食用菌多糖综述[J]. 轻工科技,2012(10):16-18.
[8]Kim J,Lee S M,Bae I Y,et al.(1-3)(1-6)-β-Glucan-enriched materials from Lentinus edodes mushroom as a high-fibre and low-calorie flour substitute for baked foods[J]. Journal of the Science of Food & Agriculture,2011,91(10):1915-1919.
[9]Cavallero A,Empilli S,Brighenti F,et al. High(1→3,1→4)-β-Glucan Barley Fractions in Bread Making and their Effects on Human Glycemic Response[J]. Journal of Cereal Science,2002,36(1):59-66.
[10]Cleary L J,Andersson R,Brennan C S. The behavior and susceptibility to degradation of high and low molecular weight barleyβ-glucan in wheat bread during baking andinvitrodigestion[J]. Food Chemistry,2007,102(3):889-897.
[11]Skendi A,Biliaderis C G,Papageorgiou M,et al. Effects of two barleyβ-glucan isolates on wheat flour dough and bread properties[J]. Food Chemistry,2010,119(3):1159-1167.
[12]Symons L J,Brennan C S. The Influence of(1 3)(1 4)-β-D-Glucan-rich Fractions from Barley on the Physicochemical Properties andInVitroReducing Sugar Release of White Wheat Breads[J]. Journal of Food Science,2004,69(69):C463-C467.
[13]Chan C F,Chan W K,Sze M Y. The effects ofβ-glucan on human immune and cancer cells[J]. Journal of Hematology & Oncology,2009,2(6):1-11.
[14]Brennan C S,Cleary L J. The potential use of cereal(1→3,1→4)-β-d-glucans as functional food ingredients[J]. Journal of Cereal Science,2005,42(1):1-13.
[15]Gründemanna C,Garcia-Käufera M,Sauera B,et al.Comparative chemical and biological investigations ofβ-glucan-containing products from shiitake mushrooms[J]. Journal of Functional Foods,18(A):692-702.
[16]江帆. RVA仪分析不同添加物对大米粉糊化特性的影响[J]. 食品研究与开发,2013(8):74-77.
[17]朱海霞,程丽丽. 木糖醇全麦面包工艺[J]. 农业工程,2013,3(5):92-95.
[18]Morris V J. Marine Polysaccharides-Food Applications[J]. Trends in Food Science & Technology,2012,25(1):53.
[19]Angioloni A,Collar C. Physicochemical and nutritional properties of reduced-caloric density high-fiber breads[J]. LWT-Food Science and Technology,2011,44(3):747-758.
[20]Swieca M,Sęczyk L,Gawlikdziki U,et al. Bread enriched with quinoa leaves-the influence of protein-phenolic interactions on the nutritional and antioxidant quality[J]. Food Chemistry,2014,26(3):209-217.
[21]AOAC Official Method 996.11 Starch(Total)in cereal products.
[22]Patindol J A,Guraya H S,Champagne E T,et al. Nutritionally Important Starch Fractions of Rice Cultivars Grown in Southern United States[J]. Journal of Food Science,2010,75(5):137-144.
[23]Giuberti G,Gallo A,Cerioli C,et al.Invitrostarch digestion and predicted glycemic index of cereal grains commonly utilized in pig nutrition[J]. Animal Feed Science & Technology,2012,174(3-4):163-173.
[24]Banchathanakij R,Suphantharika M. Effect of differentβ-glucans on the gelatinization and retro gradation of rice starch[J]. Food Chemistry,2009,114(1):5-14.
[25]Enkhjargal U,Joan-Hwa Y,Li-Yun L,et al. Quality of bread supplemented with mushroom mycelia[J]. Food Chemistry,2013,138(1):70-76.
[26]Hager A S,Ryan L A M,Schwab C,et al. Influence of the soluble fibres inulin and oatβ-glucan on quality of dough and bread[J]. European Food Research & Technology,2011,232(3):405-413.
[27]魏决,罗雯.β-葡聚糖对改善面包品质的研究[J]. 食品科技,2010(11):174-178.
[28]詹冬玲,任玉雪,闵伟红,等. 面包老化机理及其分析技术的研究进展[J]. 食品工业科技,2013,34(23):353-355.
[29]Ulziijargal E,Yang J H,Lin L Y,et al. Quality of bread supplemented with mushroom mycelia[J]. Food Chemistry,2013,138(1):70-76.
[30]郭小权,胡国良,刘妹.β-葡聚糖的抗营养作用及β-葡聚糖酶在饲料中的应用[J]. 江西饲料,2001(2):11-13.
[31]吴佳,谢笔钧. 燕麦β-葡聚糖对α-淀粉酶的体外作用[J]. 营养学报,2011,33(6):612-615.
[32]Regand A,Chowdhury Z,Tosh S M,et al. The molecular weight,solubility and viscosity of oat beta-glucan affect human glycemic response by modifying starch digestibility[J]. Food Chemistry,2011,129(2):297-304.
The influence ofβ-glucan fromHericiumerinaceusandLentinusedodeson the qualities andinvitrostarch digestibility of white bread
ZHUANG Hai-ning1,GAO Lin-lin2,FENG Tao2,*,BING Fang-ling2,SANG Min2,YANG Yan1,ZHANG Jing-song1
(1.Institute of Edible Fungi,Shanghai Academy of Agricultural Sciences,National Engineering Research Center of Edible Fungi,Shanghai 201403,China;2.School of Perfume and Aroma Technology,Shanghai Institute of Technology,Shanghai 201418,China)
β-glucan had the potential to influence starch digestibility and consequently reducing glycemic responses. As the viscosity ofβ-glucan increased,invitrostarch digestibility was reduced and the glucose responses were lowered. The impacts ofHericiumerinaceusβ-glucan(HEBG)andLentinusedodesβ-glucan(LEBG)on the qualities,textural properties andinvitrostarch digestion rate of white bread was evaluated. The incorporation of both HEBG and LEBG resulted in higher specific volume and little effect on the color of the bread,compared to the control. Through the determination of the textural studies of bread,it was found that HEBG and LEBG had significant improvement towards hardness,gumness,chewiness of bread. The inner structure of bread was tiny and smooth,the texture was soft and the retrogradation of bread had been effectively retarded which made the hardness of bread be increased slowly during the storage period. The hardness of bread decreased from 271.25 g to 134.7 g(0.5% HEBG)and 184.78 g(1.0%LEBG),respectively. There was a significant difference with the control group. At the same time,the addition of HEBG/LEBG could inhibit the bread from aging,the hardness of bread increased slowly during storage. The digestioninvitromodel revealed the addition of HEBG/LEBG decreased the starch digestibility in bread,which attenuated reducing sugars release,the rapidly digestible starch was also reduced,slowly digestible starch and resistant starch was increased compared to the control. HEBG was significantly more active in reducing sugars release when the addition of HEBG was 1.0%,the slowly digestible starch and resistant starch increased by 10.54% and 22.5%,respectively.
β-glucan;bread;invitrostarch digestibility;texture properties
2016-06-30
庄海宁(1980-),女,博士,助理研究员,研究方向:食用菌的高效增值化利用,E-mail:zhuanghaining@saas.sh.cn。
*通讯作者:冯涛(1978-),男,博士,教授,研究方向:食品风味分析、淀粉应用,E-mail:fengtao@sit.edu.cn。
2015年度上海市市级农口系统青年人才成长计划(沪农青字(2015)第1-8号)。
TS213.2
A
:1002-0306(2017)04-0152-06
10.13386/j.issn1002-0306.2017.04.021
