左乙拉西坦对癫痫小鼠内嗅皮层GABA神经元电生理干预的研究
2017-03-14倪红郑卜真王恩马传花柯绍发周元林金笑平储照虎
倪红 郑卜真 王恩 马传花 柯绍发 周元林 金笑平 储照虎
左乙拉西坦对癫痫小鼠内嗅皮层GABA神经元电生理干预的研究
倪红 郑卜真 王恩 马传花 柯绍发 周元林 金笑平 储照虎
目的研究癫痫小鼠内嗅皮层γ-氨基丁酸(GABA)能神经元的电生理变化及使用左乙拉西坦(Lev)干预治疗后的电生理变化。方法将绿色荧光蛋白转基因(FVB-Tg)小鼠随机分为对照组、模型制备组和Lev干预组。Lev采用灌胃给药。在造模成功后直接断头取脑,制作脑片,在人工脑脊液中孵育后,利用膜片钳技术,进行全细胞记录。观察并比较3组小鼠大脑内嗅皮层GABA能神经元动作电位的阈电位(Vts)、静息膜电位(Vr)、绝对不应期(ARP)和动作电位间距(ISI)。结果模型制备组ARP值较对照组和Lev干预组延长,差异均有统计学意义(均P<0.05);Lev干预组较对照组仅ARP4比较差异有统计学意义(P<0.05)。模型制备组Vts-Vr值较对照组明显延长,但Lev干预组Vts-Vr值较对照组及模型制备组明显缩短,差异均有统计学意义(均P<0.05)。模型制备组ISI值较对照组和Lev干预组延长,差异均有统计学意义(均P<0.05),Lev干预组与对照组比较,差异均无统计学意义(均P>0.05)。结论Lev干预能使癫痫小鼠内嗅皮层GABA能神经元Vts-Vr、ARP、ISI缩短,有增强GABA能神经元兴奋性和编码能力的作用。
左乙拉西坦 癫痫 内嗅皮层 GABA神经元
癫痫是一组由大脑神经元异常放电所引起的短暂中枢神经系统功能失常为特征的慢性脑部疾病,是一种常见的神经系统疾病。颞叶癫痫是难治性癫痫的主要类型,病灶主要位于颞叶内侧的边缘系统结构如海马、内嗅皮层、嗅周皮层及杏仁核等。Baicia等[1]经微透析技术将γ-氨基丁酸(GABA)灌注到大鼠杏仁核后,癫痫发作的持续时间缩短,同时导致病灶的后发作和发作阈值明显提高,说明了GABA对癫痫发作的抑制作用。因此GABA能神经元成为研究抗癫痫使用药物作用靶点[2]的热点。左乙拉西坦(levetiracetam,Lev)是比利时UCB公司研发的具有全新抗癫痫机制的抗癫痫药物。Palma等[3]提出Lev的抗癫痫作用可能与GABA受体敏感性有关。Ueda等[4]研究发现Lev能阻断大脑皮层GABA能神经元受体下调,并将下调的受体滞留于海马而增强GABA对神经元回路的抑制作用,但具体机制尚不明确。本实验选择急性癫痫小鼠内嗅皮层GABA能神经元作为研究对象,利用绿色荧光蛋白(green fluorescent protein,GFP)标记GABA能神经元,研究GABA能神经元在癫痫发作前后的电生理变化,了解GABA能神经元兴奋性与癫痫发作之间的关系;并对比使用Lev干预处理后,GABA能神经元电生理的变化,了解Lev干预后GABA能神经元的电生理改变,为Lev应用于癫痫及难治性癫痫提供理论依据。
1 材料和方法
1.1 实验动物的选择健康GFP转基因[FVB-Tg(Gad GFP)4 570Swn/J]小鼠30只,出生后15~17d,购于中国科学院生物物理研究所。
1.2 实验分组将30只FVB-Tg小鼠随机分为对照组、模型制备组和Lev干预组各10只。Lev干预组在致癫前48h开始腹腔注射给药,200mg/(kg·d)分2次给药。模型制备组和对照组同时予0.9%氯化钠溶液灌胃。
1.3 动物模型建立取FVB-Tg小鼠,腹腔注射东莨菪碱1mg/kg,30min后向小鼠腹腔注射匹鲁卡品30mg/kg,若注射30min后仍然未诱发Ⅲ级以上痫性发作,可重复给予原剂量匹鲁卡品,以5次为最高限,V级发作持续1h示为模型建立成功。
1.4 痫性发作分级标准小鼠痫性发作分级标准按Racine标准:0级无惊厥,Ⅰ级面部阵挛,Ⅱ级面部阵挛+节律点头,Ⅲ级面部阵挛+节律点头+前肢阵挛,Ⅳ级面部阵挛+节律点头+前肢阵挛+后肢站立,V级面部阵挛+节律点头+前肢阵挛+后肢站立+跌倒。
1.5 膜片钳GABA能神经元电位记录
1.5.1 脑片制备腹腔注射20g/L戊巴比妥0.1ml麻醉小鼠,取出大脑,在充分氧合的冰水混合人工脑脊液中行冠状切片,厚度400μm,脑片被孵育在25°C氧饱和的人工脑脊液(124mmol/L氯化钠,3mmol/L氯化钾,1.2mmol/L磷酸二氢钠,26mmol/L碳酸氢钠,2.4mmol/L氯化钙,1.3mmol/L硫酸镁,10mmol/L右旋葡萄糖,5mmol/L羟乙基哌嗪乙磺酸,pH 7.35)[5]中1~2h。然后转移到31°C氧饱和的人工脑脊液灌流的记录槽中(180μl,Warner RC-26G)进行膜片钳全细胞电位记录(图1)。
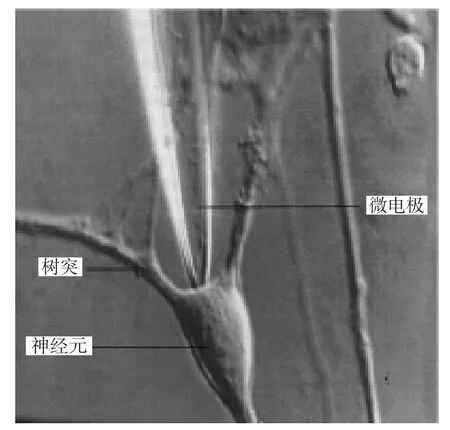
图1 电镜下的膜片钳与GABA能神经元胞体
1.5.2 GABA能神经元的选择因将GFP基因插入该小鼠谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)基因下游,故GABA能神经元在荧光显微镜蓝光(488nm)的激发下发出绿色荧光,以此可与其他神经元相鉴别。本实验结合内嗅皮层解剖结构,定位选择内嗅皮层的荧光标记GABA能神经元。
1.5.3 GABA能神经元电位记录采用Axoclamp-200B放大器,放大器的高频滤波为3kHz。在膜片钳全细胞电位记录模式下采集电信号,输入pClamp 9.2进行分析。全细胞电位记录的电极管内充满标准电极液,渗透压为295~305mOsmol,电极阻抗为5~6MΩ。先利用去极化刺激,记录前4次动作电位的绝对不应期(absolute refractory period,ARP)。再使用长时程电流脉冲(300ms),分别记录前5次动作电位的阈电位(threshold potential,Vts)、静息膜电位(resting membrance potential,Vr)和动作电位间距(inter-spike interval,ISI)。神经元能障以Vts与Vr的差值(Vts-Vr)表示。记录的神经元电位,以刺激的顺序表示,仅当细胞膜静息膜电位负值超过-70mV时,所得资料才用于统计分析,其Vr、动作电位幅度和输入阻抗的波动范围在5%之内的数据也认为在标准范围内而被采用。
1.6 统计学处理采用SPSS 18.0统计软件。计量资料以表示,多组间比较采用方差分析,两两比较采用LSD-t检验。采用Sigmaplot 10.0统计软件绘图。
2 结果
2.1 3组内嗅皮层GABA能神经元APR的变化3组内嗅皮层GABA能神经元ARP值比较差异均有统计学意义(均P<0.05)。两两比较发现,模型制备组ARP值较对照组和Lev干预组延长,差异均有统计学意义(均P<0.05);对照组与Lev干预组仅ARP4比较差异有统计学意义(P<0.05),见表1和图2。
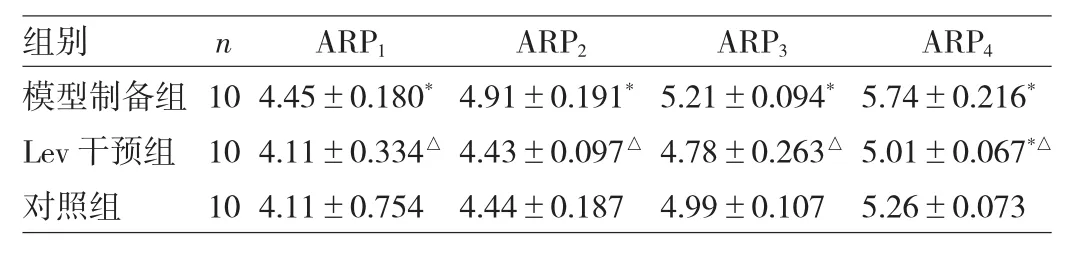
表1 3组内嗅皮层GABA能神经元连续发放动作电位的ARP1~4值变化(ms)
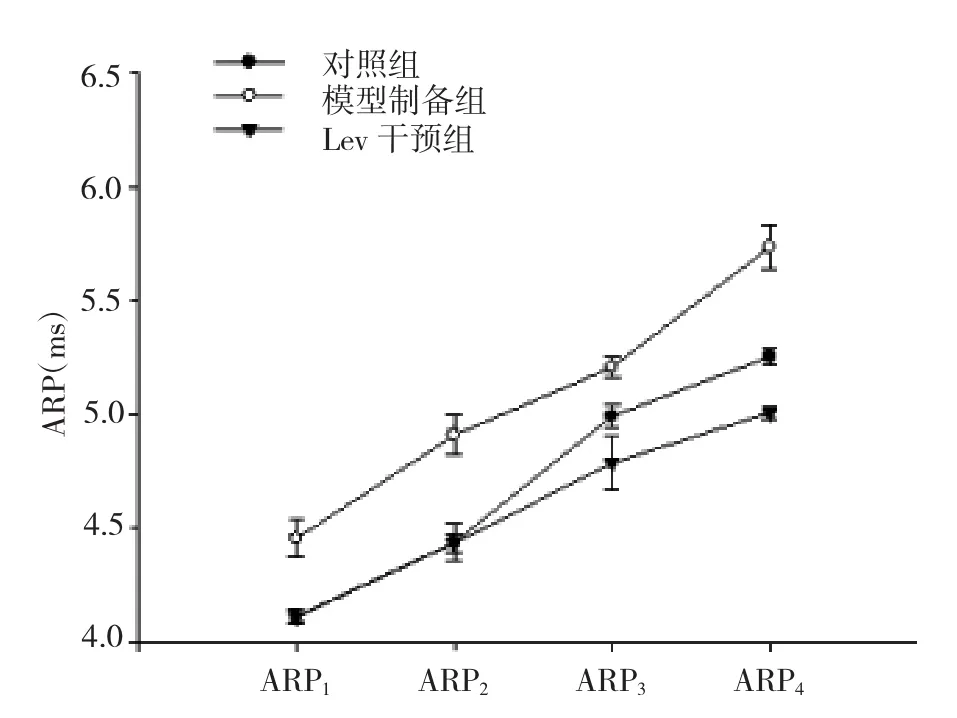
图2 3组内嗅皮层GABA能神经元ARP1~4值变化图
2.2 3组内嗅皮层GABA能神经元Vts-Vr的变化3组内嗅皮层GABA能神经元Vts-Vr值比较差异均有统计学意义(均P<0.05)。两两比较发现,模型制备组Vts-Vr值较对照组和Lev干预组明显延长,差异均有统计学意义(均P<0.05);Lev干预组Vts-Vr值较对照组缩短,差异均有统计学意义(均P<0.05),见表2和图3。
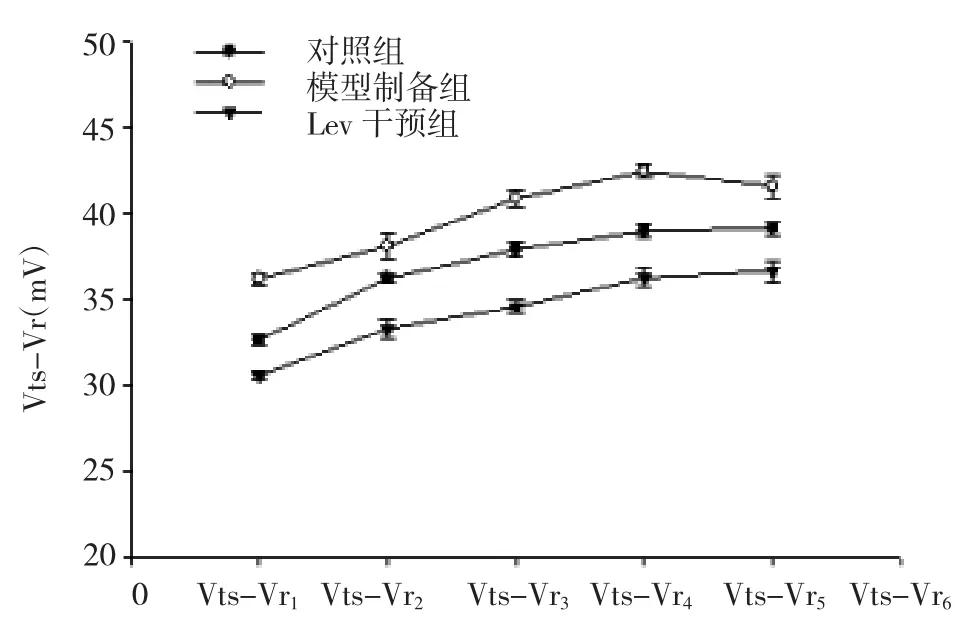
图3 3组内嗅皮层GABA能神经元Vts-Vr变化图

表2 3组内嗅皮层GABA能神经元Vts-Vr值的变化(mV)
2.3 3组内嗅皮层GABA能神经元ISI的变化3组内嗅皮层GABA能神经元ISI值比较差异均有统计学意义(均P<0.05)。两两比较发现,模型制备组ISI值较对照组和Lev干预组延长,差异均有统计学意义(均P<0.05);Lev干预组与对照组比较,差异均无统计学意义(均P>0.05),见表3和图4。

表3 3组内嗅皮层GABA能神经元ISI值的变化(ms)
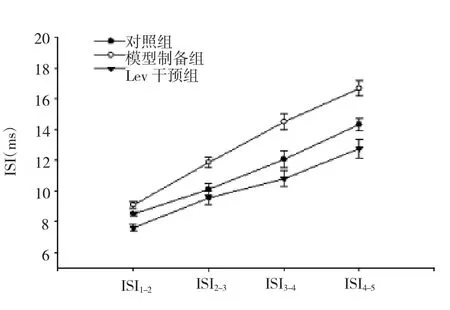
图4 3组内嗅皮层GABA能神经元ISI值变化图
3 讨论
癫痫的发病机制一直是近年来研究的热点,目前人们普遍认为癫痫的发生是由于兴奋性神经元的活性和谷氨酸的释放量增高或抑制性神经元的活性和GABA的释放量降低造成的。GABA是中枢神经系统最主要的抑制性神经递质,各类癫痫的发生几乎都与脑内GABA的功能变化有关。本研究采用匹鲁卡品建立癫痫实验动物模型,利用膜片钳全细胞记录的电生理学技术,研究位于内嗅皮层的GABA能神经元的电生理改变。通过研究发现在相同刺激强度、刺激时间作用下癫痫小鼠内嗅皮层的群集动作电位的内在特性及编码能力发生了可塑性变化,表现为模型制备组GABA能神经元动作电位的Vts-Vr、ARP、ISI均较对照组延长,说明癫痫后GABA能神经元动作电位不应期延长,阈电位水平升高,群集动作电位的发放容量降低。ISI升高表明癫痫后GABA能神经元发放的动作电位个数减少,即兴奋性降低,精确性下降。不应期的延长意味着在一定的时间内给细胞特定的刺激,细胞在单位时间内动作电位发放的个数减少,即发放频率降低,这使动作电位发放容量降低。Vts-Vr是静息电位上升到阈电位的能障,能更好地显示突出输入是如何驱动神经元激发动作电位产生的。该值增大说明癫痫后GABA能神经元接受外来信号刺激后,细胞由静息状态到激发动作电位产生的充电过程延长,跨越的能障增大,GABA能神经元对刺激动作电位产生的兴奋性输入反应不敏感,细胞功能受到抑制。癫痫后大脑皮层GABA能神经元发放动作电位的不应期延长和阈电位升高,内在特性的改变使大脑皮层GABA能神经元对动作电位编码的控制能力降低,从而使大脑皮层GABA能神经元受到抑制和动作电位发放的精确性下降。上述变化可能使皮层抑制性和兴奋性两大类神经元间的动态平衡遭到破坏,进而导致大脑功能发生紊乱,引起行为变化。动作电位的不应期和阈电位由电压门控的动力学控制[6]。癫痫造成GABA能神经元内在电生理的改变,可能是由于电压门控的活性降低所致。通过神经元电生理参数的量化有助于对神经信号编码的研究[7-9]。
Lev具有广谱抗癫痫药的特点,其适应证及使用人群逐渐扩大,特别是在难治性局灶性癫痫发作方面。Klit-gaard等[10]报道在急性最大电休克癫痫模型和戊四唑诱导的急性癫痫模型中,Lev几乎不发挥抗惊厥作用,但在匹罗卡品和红藻氨酸药物诱发的颞叶癫痫中能够减少海马神经元死亡,显示出神经保护作用,且在大剂量时对动物行为影响极小,说明其特殊的抗癫痫机制和安全性。本研究通过Lev干预对癫痫小鼠内嗅皮层GABA能神经元电生理的研究发现:(1)Lev干预组GABA能神经元动作电位的Vts-Vr、ARP、ISI较模型制备组明显缩短。提示使用Lev干预后,内嗅皮层GABA能神经元兴奋性较模型制备组升高、编码能力增强,其抑制作用增强。(2)Lev干预组较对照组Vts-Vr缩短,但ARP、ISI无明显差异,表明Lev干预后GABA能神经元兴奋性与未发生癫痫小鼠接近,但Vts-Vr降低,其可兴奋性有所增强。本研究进一步证实了Lev能增强癫痫发作时内嗅皮层GABA能神经元的抑制作用,但其增强内嗅皮层GABA能神经元的具体作用机制及其与海马GABA能神经元之间的关系等,尚有待进一步研究。
综上所述,本研究发现模型制备组GABA能神经元动作电位的Vts-Vr、ARP、ISI均较对照组延长,提示癫痫发作时GABA能神经元兴奋性降低。Lev干预组GABA能神经元动作电位的Vts-Vr、ARP、ISI较模型制备组明显缩短,说明Lev干预能使癫痫小鼠内嗅皮层GABA能神经元兴奋性增强,有提高GABA能神经元编码能力的作用。
[1]Baicia J A,Castillo A,Guti rrez R,et al.Continuous inatr-amygdalar infusion Of GABAin the amygdala kindling modelof epilepsy in rat[J].Epilepsy research,2005,58(1):19-26.
[2]Gassmann M,Bettler B.Regulation of neuronalGABA(B)receptor functions by subunit composition[J].Nat Rev Neurosci,2012,13 (6):380-394.doi:10.1038/nrn3249.
[3]Palma E,Ragozzino D,Di Angelantonio S,et al.The antiepileptic drug Leve tiracetam stabilizes the human epileptic GABA A receptors upon repetitive activation[J].Epilepsia,2007,48(10): 1842-1849.
[4]Ueda Y,DoiT,Nagatomo K.Effect of Levetiracetam on molecular regulation of hippocampal glutamate and GABA transporters in rats with chronic seizures induced by amygdalar FeCl3 injection [J].Brain Res,2007,1151(1):55-61.
[5]Li J,Baccei M L.Neonatal Tissue Damage Promotes Spike Timing-Dependent Synaptic Long-Term Potentiation in Adult Spinal Projection Neurons[J].Neurosci,2016,36(19):5405-5416.doi: 10.1523/JNEUROSCI.3547-15.2016.
[6]Zhang M,Hung F S,Zhu Y,et al.Calcium signal-dependent plasticity of neuronal excitability developed postnatally[J].Neurobiol,2004,61(2):277-287.
[7]Crochet S,Petersen C C.Correlating whisker behavior with membrane potential in barrel cortex of awake mice[J].Nat Neurosci, 2006,9(5):608-610.
[8]Powell E M.Recipes for making human interneurons from stem cells require multiple factors,careful timing,and long maturation periods[J].Epilepsy Curr,2013,13(6):266-268.doi:10.5698/ 1535-7597-13.6.266.
[9]Bale M R,Ince R A,Santagata G,et al.Efficient population coding of naturalistic whisker motion in the ventro-posterior medial thalamus based on precise spike timing[J].Front Neural Circuits, 2015,9:50.doi:10.3389/fncir.2015.00050.eCollection 2015.
[10]Klit-gaard H,Verdru P.Levetiracetam:the first SV2A ligand for the treatment of epilepsy[J].Expert Opin Drug Discov,2007,2 (11):1537-1345.
Electrophysiological changes of GABAergic neurons of entorhinal cortex in epileptic mouse after levetiracetam intervention
NI Hong, ZHENG Buzhen,WANG En,et al.Department of Neurology,the Affiliated Taizhou Hospital of Wenzhou Medical University,Taizhou 317000,China
ObjectiveTo investigate the electrophysiological changes of GABAergic neurons in entorhinal cortex of epileptic mouse after levetiracetam intervention.MethodsTransgenic FVB-Tg mice were randomly divided into control group, model group,and levetiracetam group.The epilepsy model was induced by sequential injection of scopolamine and pilocarpine in TVB-Tg mice.Levetiracetam was given by intragastric administration.Tissue specimens of entorhinal cortex were obtained after animals were sacrificed.The brain slices(400μm)were prepared and incubated in oxygenated artificial cerebrospinal fluid. The sequential spike patters(inter-spike intervals,ISI)and intrinsic properties(ARP,Vts,Vr)of GABAergic neurons were recorded by the whole-cell clamp and analyzed with pClamp 9.ResultsCompared to control groups,in model group the ARP was prolonged,the Vts-Vr increased,and the ISI was extended(all P<0.05).Compared to model group,in levetiracetam group the ARP were significantly shortened(P<0.05),the threshold potentials significantly decreased(P<0.01),and the ISI was shortened (P<0.05).ConclusionWith the intervention of levetiracetam,the spike encoding and intrinsic properties of GABAergic neurons were improved in epileptic mice,which suggests that the functional enhancement of GABAergic neurons may play an important role in epileptic control.
LevetiracetamEpilepticEntorhinal cortexGABAergic neuron
2014-11-28)
(本文编辑:陈丽)
10.12056/j.issn.1006-2785.2017.39.4.2014-1439
台州市科技局资助项目(121ky08)
317000临海,温州医科大学附属台州医院神经内科(倪红、王恩、马传花、柯绍发、周元林、金笑平);台州恩泽医疗中心(集团)恩泽医院手足外科(郑卜真);安徽皖南医学院弋矶山医院神经内科(储照虎)
储照虎,E-mail:chuzhaohu787@126.com
