长期索拉菲尼暴露促进Huh7 肝癌细胞上皮间质变的实验研究
2017-03-14刘俊王清清曹浩强张浩
刘俊 王清清 曹浩强 张浩
长期索拉菲尼暴露促进Huh7 肝癌细胞上皮间质变的实验研究
刘俊 王清清 曹浩强 张浩
目的探讨索拉菲尼耐药肝癌细胞发生上皮间质变(EMT)及侵袭、转移能力增强的机制。方法通过药物连续诱导人肝癌细胞株Huh7建立索拉菲尼耐药肝癌细胞株Huh7R,显微镜下观察细胞形态学变化;CCK-8细胞增殖试验检测Huh7R细胞增殖能力;荧光定量PCR检测ABC家族耐药基因ABCB1、ABCC1、ABCG2及EMT相关调控锌指蛋白转录因子Snail、Slug基因表达水平;Western blot检测耐药蛋白ABCG2,EMT标记分子E-cadherin、Vimentin及N-cadherin,转录因子Snail、Slug蛋白表达水平;Transwell小室侵袭试验检测Huh7R细胞迁移、侵袭能力。结果Huh7R细胞呈细长形,伴纤维状突起,形态学上符合EMT改变;CCK-8细胞增殖试验显示在索拉菲尼作用下,Huh7R细胞生存率高于Huh7细胞;荧光定量PCR结果显示,Huh7R细胞ABCB1、ABCC1、ABCG2及Snail、Slug基因表达水平均高于Huh7细胞(均P<0.05);Western blot显示,Huh7R细胞上皮标记蛋白E-cadherin表达水平低于Huh7细胞(P<0.05),而间质标记蛋白Vimenti、N-cadherin及Snail、Slug蛋白表达水平均高于Huh7细胞(均P<0.05);Transwell小室侵袭试验显示Huh7R细胞迁移、侵袭能力均较Huh7细胞增强。结论长期低剂量索拉菲尼暴露会促进肝癌细胞Snail和Slug表达,诱导肿瘤细胞发生EMT,增强其侵袭、转移能力。
肝癌 索拉菲尼 转录因子 上皮间质变 耐药
索拉菲尼是目前唯一有效且被美国FDA批准用于中晚期肝癌治疗的分子靶向药物[1]。研究表明,长期低剂量索拉菲尼暴露造成的继发性耐药会增强肝癌细胞迁移、侵袭能力。ABC家族耐药基因与肝癌继发性耐药相关,ABCG2、ABCB1和ABCC1基因属其家族成员,编码的蛋白可参与肝癌细胞内靶向药物的分布,改变药物的作用靶点,促进药物外排。上皮间质变(EMT)是指上皮细胞获得间充质、成纤维样特征,细胞间的黏附能力降低,细胞的运动性能增强。EMT被认为是肝癌细胞发生索拉菲尼耐药及迁移、侵袭能力增强的主要原因[2]。Snail、Slug基因属于锌指蛋白转录因子Snail基因家族成员,参与调控EMT。目前索拉菲尼耐药肝癌细胞发生EMT的机制尚不明确。基于此,本研究运用实验室研究方法探讨索拉菲尼耐药肝癌细胞发生EMT及迁移、侵袭能力增强的机制,以期为肝癌的靶向治疗提供参考。
1 材料和方法
1.1 材料甲苯磺酸索拉菲尼片购自德国Bayer公司;Huh7人肝癌细胞株购自中国科学院细胞库;FBS、胰酶购自美国Gibco公司;DMEM培养基购自美国Hyclone公司;PCR引物由上海生物工程有限公司合成;DMSO购自美国Sigma公司;用于荧光定量PCR的逆转录试剂盒(PrimeScript RT reagent Kit with gDNA Eraser)购自日本Takara公司;细胞增殖检测试剂(cell counting kit-8,CCK-8)购自日本同仁化学研究所;用于Western blot试验抗体(E-cadherin、N-cadherin、Vimentin、Snail、Slug、ABCG2及GAPDH)均购自美国Cell Signaling Technology公司;用于Transwell侵袭实验的小室购自美国Corning公司;PCR扩增仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 配制索拉菲尼药液将甲苯磺酸索拉菲尼1片(200mg)溶于15.7ml无菌DMSO中,配制成浓度为2× 104mol/L的索拉菲尼贮藏液,分装,-20℃保存备用。
1.2.2 细胞培养将Huh7置于含10%胎牛血清的DMEM培养液中,在37℃、5%二氧化碳浓度的培养箱中孵育,待细胞生长,密度达到70%~80%时进行胰酶消化传代,取对数生长期细胞用于后续实验。
1.2.3 建立索拉菲尼耐药肝癌细胞株(sorafenib resistant Huh7 cells,Huh7R)采用索拉菲尼连续诱导、逐步增加药物浓度的方法筛选耐药细胞株。取对数生长期细胞接种至含10%胎牛血清的DMEM培养液中,起始药物浓度为2μmol/L,低浓度持续诱导1~2个月,继续增加索拉菲尼药物浓度至最大耐受浓度,总诱导周期为6个月,获得Huh7R。
1.2.4 CCK-8细胞增殖试验检测细胞增殖能力调制8种不同浓度索拉菲尼药液(0、1、2、4、6、8、10、12μmol/L),Huh7、Huh7R各设实验组(不同浓度索拉菲尼+细胞+DMEM培养液+CCK8试剂)、对照组(细胞+DMEM培养液+CCK8试剂)和空白组(DMEM培养液+CCK8试剂)。取生长良好的对数生长期细胞按每孔5×103个/100μl的细胞密度接种于96孔板培养,孵育过夜,除去旧培养液,实验组加入不同浓度索拉菲尼含5%FBS的DMEM培养液,孵育48h;按1∶10体积比例配制CCK-8试剂和DMEM培养液,每孔加入100μl,孵育1h,用酶标仪在450nm波长处测定吸光度(A)值,记录结果;计算在索拉菲尼作用后的细胞生存率[细胞生存率=(实验组A值-空白组A值)/(对照组A值-空白组A值)],并计算出其半数抑制浓度IC50值。
1.2.5 荧光定量PCR检测ABC家族耐药基因及Snail、Slug基因表达水平Huh7R细胞于提取前予以含10% FBS的DMEM培养液培养24h,Huh7、Huh7R各加入Trizol抽提细胞总RNA;紫外分光光度计检测RNA纯度和质量;根据逆转录试剂盒的操作说明将1 000ng RNA逆转录成cDNA。然后将cDNA模板经PCR扩增仪进行扩增,引物序列见表1,PCR扩增条件:94℃预变性3min;接着进行40个循环,包括95℃变性5s,60℃退火3s,72℃延伸10s后进行荧光检测,分析熔解曲线和扩增曲线。用2-ΔΔCt方法对Huh7、Huh7R细胞基因表达差异进行分析。实验重复3次,取平均值。

表1 各基因引物序列
1.2.6 Western blot检测EMT标记蛋白(E-cadherin、N-cadherin、Vimentin)、转录因子蛋白(Snail和Slug蛋白)及耐药蛋白(ABCG2蛋白)表达水平Huh7R于提取前予以含10%FBS的DMEM培养基培养24 h,配制蛋白裂解液、蛋白酶抑制剂和磷酸酶抑制剂的混合液,加入待检测细胞并于冰上放置30min,12 000r/min 4℃条件下离心15min,取其上清液,蛋白定量;加入5× SDS上样缓冲液,煮沸10 min,-20℃保存备用;每孔加入20~30μl目的蛋白样品,将十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)在60V电压下电泳,然后在300 mA电流下湿转到聚偏氟乙烯(PVDF)膜上;脱脂奶粉室温封闭1h,加入一抗4℃孵育过夜,PBST漂洗15min×3次,加入对应的二抗室温孵育1h,PBST漂洗15min×3次,加入ECL发光剂后显影拍照,以与GAPDH的灰度值代表蛋白表达水平。实验重复3次,取平均值。
1.2.7 Transwell小室侵袭试验检测细胞迁移、侵袭能力取对数生长期的Huh7、Huh7R细胞消化离心后加入无血清DMEM培养液吹打均匀,取5×104个/100μl细胞加入小室上层,下层加入含10%FBS的DMEM培养液;孵育48h,4%多聚甲醛固定细胞15min,0.1%结晶紫染色2h,用棉签拭去上室细胞;100倍显微镜下随机计数5个视野取平均值。侵袭试验是将50mg/L的Matrigel胶4℃融化,用无血清DMEM培养液将其1∶8稀释混匀,取100 μl放于小室上层,其余步骤和迁移实验一样。
1.3 统计学处理应用SPSS 17.0统计软件;计量资料以表示,两组比较采用配对t检验。
2 结果
2.1 Huh7、Huh7R细胞形态学比较见图1。
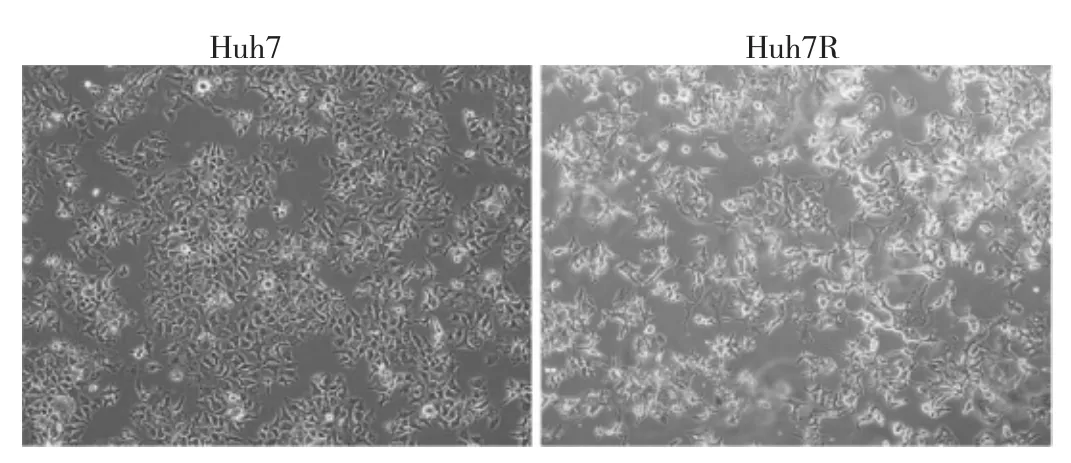
图1 Huh7、Huh7R细胞形态学比较(×100)
由图1可见,Huh7细胞是分化较好的人源性上皮来源肝癌细胞,表现为上皮细胞样形态,呈现多边形簇集生长;Huh7R细胞则呈细长形,伴纤维状突起,形态学上改变符合EMT改变。
2.2 索拉菲尼作用下Huh7、Huh7R细胞生存率比较见图2。
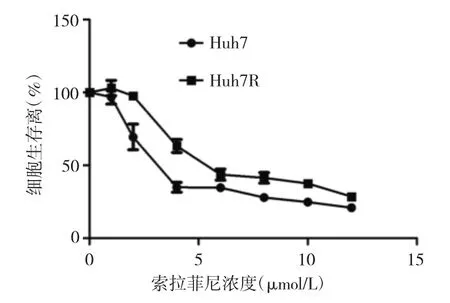
图2 Huh7与Huh7R细胞生存率比较
由图2可见,随着索拉菲尼药物浓度的升高,Huh7、Huh7R细胞生存率均呈下降趋势。除1μmol/L索拉菲尼作用浓度外,在2、4、6、8、10、12μmol/L作用浓度时,Huh7R细胞生存率均明显高于Huh7细胞(均P<0.05),同时可以观察到Huh7R细胞的IC50(6.38μmol/L)明显高于Huh7细胞(3.71μmol/L)。
2.3 Huh7、Huh7R细胞ABC家族耐药基因表达水平及ABCG2蛋白表达水平比较见表2、图3、表3。
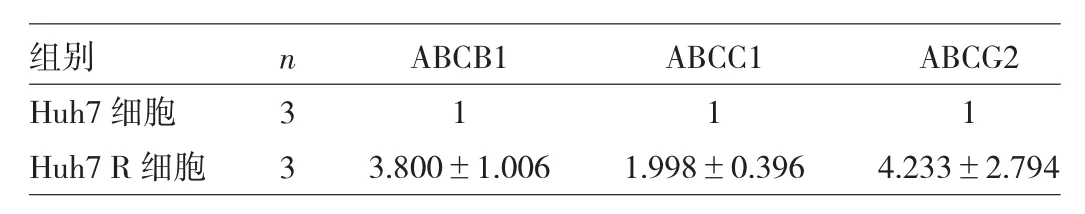
表2 Huh7、Huh7R细胞ABC家族耐药基因表达水平比较
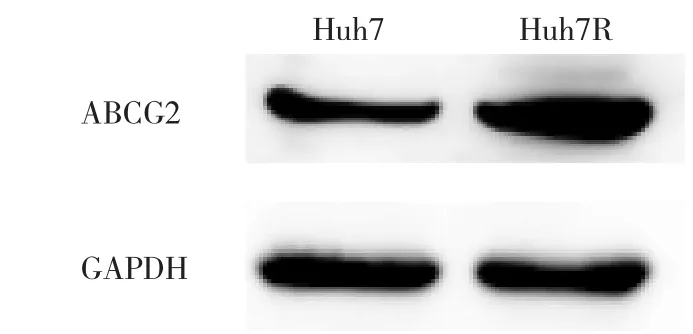
图3 Huh7、Huh7R细胞ABCG2蛋白表达条带图比较
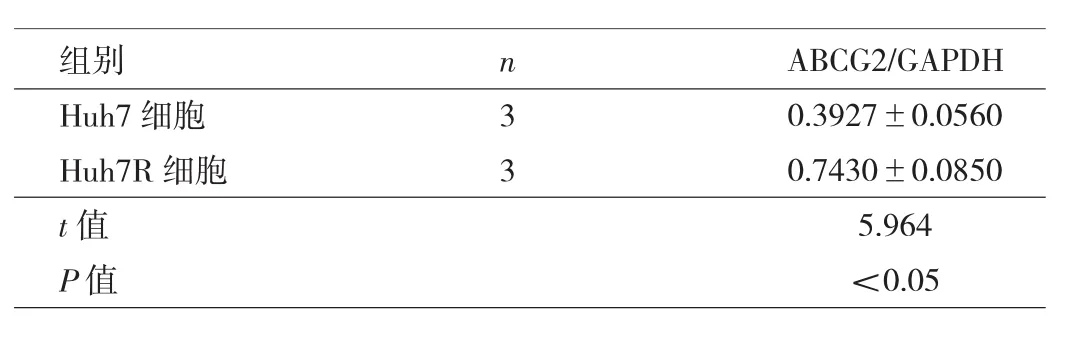
表3 Huh7、Huh7R细胞ABCG2蛋白表达水平比较
由表2可见,Huh7R细胞ABCB1、ABCC1、ABCG2基因表达水平均高于Huh7细胞(均P<0.05)。由图3、表3可见,Huh7R细胞ABCG2蛋白表达水平高于Huh7细胞(P<0.05)。2.4Huh7、Huh7R细胞EMT标记蛋白及Snail、Slug蛋白表达水平比较见图4、表4。
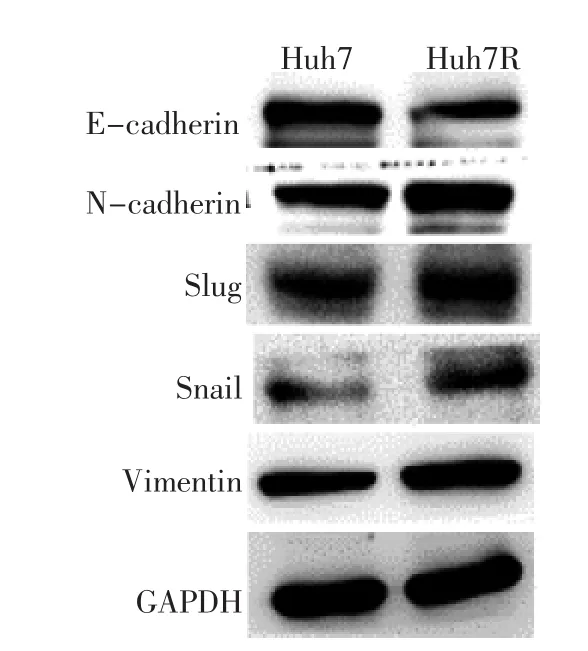
图4 Huh7、Huh7R细胞EMT标记蛋白及Snail、Slug蛋白表达条带图比较

表4 Huh7、Huh7R细胞EMT标记蛋白及Snail、Slug蛋白表达水平比较
由图4、表4可见,Huh7R细胞上皮标记蛋白E-cadherin表达水平低于Huh7细胞(P<0.05),而间质标记蛋白N-cadherin、Vimentin表达水平均高于Huh7细胞(均P<0.05)。同时,Huh7R细胞Snail、Slug蛋白表达水平均高于Huh7细胞(均P<0.05)。
2.5 Huh7、Huh7R细胞迁移、侵袭能力比较见图5。
由图5可见,Huh7R细胞黏附于下室面的细胞数量明显多于Huh7细胞,表现出更高的迁移、侵袭能力。
3 讨论
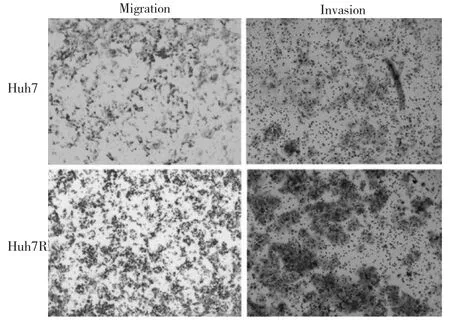
图5 Huh7、Huh7R细胞迁移、侵袭能力比较(结晶紫染色,×100)
肝癌是国人最为常见的恶性肿瘤之一,其发病率居恶性肿瘤第6位,病死率居第3位[3]。手术虽然是肝癌治疗的最有效方法,但由于肝癌恶性程度高,且大多患者发现时已是中晚期,丧失了手术治疗机会。索拉菲尼是目前唯一对于无法手术治疗的中晚期肝癌有效的治疗药物。研究指出,对于肝功能Child A级患者,索拉菲尼治疗组较安慰剂治疗组平均延长约3个月生存期[4-6],这一治疗效果给本已陷入无药可用、无计可施的中晚期肝癌患者带来重大希望。但也有研究显示,长期低剂量索拉菲尼暴露会促进肝癌细胞发生索拉菲尼耐药[7-8]。本研究结果显示,长期低剂量索拉菲尼暴露促进肝癌细胞Snail、Slug表达,从而诱导肝癌细胞发生EMT,耐药性增加,侵袭、转移能力增强。
EMT是指上皮细胞在形态学上发生向成纤维细胞或间充质细胞表型的转变并获得迁移的能力。在EMT过程中,上皮细胞标记蛋白E-cadherin表达水平下降,间质细胞标记蛋白N-cadherin表达水平升高,从而使具有极性的上皮表型细胞发生细胞骨架重塑,上皮细胞失去它们的上皮特性,获得更多的迁移间质细胞样特性。肿瘤侵袭性取决于上皮细胞的迁移能力,在EMT这一过程中,上皮细胞获得成纤维细胞样特性并呈现细胞间黏附能力的下降及运动的增加,从而增强了肿瘤细胞的迁移、侵袭能力[9-10]。本研究结果显示,长期索拉菲尼培养促进了肝癌细胞的耐药形成,诱导耐药细胞发生EMT,这与Chow等[10]研究结果一致。长期索拉菲尼暴露诱导肝癌EMT形成机制尚不明确,可能与PI3K/AKT信号通路激活有关[11]。因此,进一步了解肝癌细胞索拉菲尼耐药过程中EMT分子调控机制,并进行针对性干预,有望为索拉菲尼耐药肝癌的治疗提供新方向。
Snail通过竞争性结合E-cadherin启动子区域E-box连接基序,抑制E-cadherin表达,上调间质标记蛋白N-cadherin表达,从而导致细胞连接减少,促进EMT形成[12-13]。Yang等[14]研究发现,在原发性肝癌切除标本中,Snail阳性表达率为56.9%,Slug阳性表达率为51.4%,其中Snail阳性表达患者预后显著差于阴性表达患者;在细胞水平,Huh7为低水平表达Snail肝癌细胞株,将其过表达Snail后,细胞侵袭及转移能力显著增强,而将高水平表达Snail的肝癌细胞株Mahlavu进行Snail基因敲除后其侵袭及转移能力显著抑制,进一步研究发现Snail通过调控EMT标记蛋白表达促进肝癌细胞侵袭及转移能力。Zhao等[15]研究发现Slug高表达与肝癌转移及患者生存期密切相关,进一步研究发现Slug促进sox2及nanog表达,增加肿瘤干性,从而促进肝癌转移。这些研究结果均支持本研究结论。
综上所述,长期低剂量索拉菲尼暴露通过促进肝癌细胞Snail、Slug表达,诱导肝癌发生EMT,进而增强肿瘤细胞侵袭、转移能力,这一研究结果或在肝癌索拉菲尼耐药相关预测指标的确定和可能干预靶点筛选等方面有重要的临床价值和应用前景。
[1]Pascual S,Herrera I,Irurzun J.New advances in hepatocellular carcinoma[J].World J Hepatol,2016,8(9):421-438.
[2]Nishida N,Kitano M,Sakurai T,et al.Molecular Mechanism and Prediction of Sorafenib Chemoresistance in Human Hepatocellular Carcinoma[J].Dig Dis,2015,33(6):771-779.
[3]Chen W,Zheng R,Baade P D,et al.Cancer statistics in China, 2015[J].CACancer J Clin,2016,66(2):115-132.
[4]Forner A,Llovet J M,Bruix J.Hepatocellular carcinoma[J].Lancet, 2012,379(9822):1245-1255.
[5]Cheng A L,Kang Y K,Chen Z,et al.Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phase III randomised,double-blind, placebo-controlled trial[J].Lancet Oncol,2009,10(1):25-34.
[6]Rimassa L,Santoro A.Sorafenib therapy in advanced hepatocellular carcinoma:the SHARP trial[J].Expert Rev Anticancer Ther, 2009,9(6):739-745.
[7]Chen J,Jin R,Zhao J,et al.Potential molecular,cellular and microenvironmental mechanism of sorafenib resistance in hepatocellular carcinoma[J].Cancer Lett,2015,367(1):1-11.
[8]Ombrato L,MalanchiI.The EMT universe:space between cancer cell dissemination and metastasis initiation[J].Crit Rev Oncog, 2014,19(5):349-361.
[9]Thiery J P,Acloque H,Huang R Y,et al.Epithelial-mesenchymal transitions in development and disease[J].Cell,2009,139(5):871-890.
[10]Chow A K,Ng L,Lam C S,et al.The Enhanced metastatic potential of hepatocellular carcinoma(HCC)cells with sorafenib resistance[J].PLoS One,2013,8(11):e78675.
[11]Thillai K,Ross P,Sarker D.Molecularly targeted therapy for advanced hepatocellular carcinoma-a drug development crisis? [J].World J Gastrointest Oncol,2016,8(2):173-185.
[12]Kaufhold S,Bonavida B.Centralrole of Snail1 in the regulation of EMT and resistance in cancer:a target for therapeutic intervention[J].J Exp Clin Cancer Res,2014,33(1):62.
[13]Lin Y,Dong C,Zhou B P.Epigenetic regulation of EMT:the Snail story[J].Curr Pharm Des,2014,20(11):1698-1705.
[14]Yang M H,Chen C L,Chau G Y,et al.Comprehensive analysis of the independent effect of twist and snail in promoting metastasis of hepatocellular carcinoma[J].Hepatology,2009,50(5): 1464-1474.
[15]Zhao X,Sun B,Sun D,et al.Slug promotes hepatocellular cancer cell progression by increasing sox2 and nanog expression [J].OncolRep,2015,33(1):149-156.
Epithelial-mesenchymal transition and migrant/invasion ability in human sorafenib-resistant hepatocellular carcinoma Huh7 cells
LIU Jun,WANG Qingqing,CAO Haoqiang,et al.Bengbu Medical College,Bengbu 233000,China
ObjectiveTo investigate epithelial-mesenchymal transition(EMT)and migrant/invasion ability in sorafenibresistant human hepatocellular carcinoma cells(Huh7R).MethodsThe Huh7R was induced by long-term exposure to low dose sorafenib.The morphological changes of Huh7R was observed with phase contrast microscopy,the drug sensitivity was evaluated with cytotoxicity cell counting kit-8(CCK-8)assay;the expression of ABC family resistance genes ABCB1,ABCC1, ABCG2,and transcription factor genes Snail,Slug was detected with real-time PCR(RT-PCR),the resistance related protein ABCG2,EMT marker E-cadherin,Vimentin and N-cadherin,transcription factors Snail and Slug was detected with Western blot. Migration and invasion properties of Huh7R cells were assessed using Transwell assays.ResultsPhase contrast microscopy showed that the Huh7R cells were elongated with fibrous projections and the morphological changes were consistent with typical EMT changes.CCK-8 results showed that the Huh7R cells were less sensitive to sorafenib than parental Huh7 cells. Fluorescence quantitative PCR results showed that compared to the parental Huh7 cells,the expression of resistance gene ABCB1,ABCC1 and transcription factor Snail,Slug in Huh7R cells was up-regulated significantly,and Western blot results showed that the expression of ABCG2 protein was significantly increased,the expression of epithelial marker E-cadherin protein was decreased,and the expression of mesenchymal marker protein Vimentin and N-cadherin increased,the expression levels of snail and slug were up-regulated.Transwell invasion assay indicated that Huh7R migration and invasion ability was increased compared with parental cells.Conclusion The results indicate thatlong termexposure tolowdose sorafenib promotes the expression ofsnailand Slug inhumanheparocellularcarcinoma Huh7Rcells,whichmediates EMTand enhances the migrantand invasionabilityof Huh7Rcells.
Hepatocellular carcinomaSorafenibTranscriptionfactor Epithelial mesenchymal transitionDrug resistance
2016-06-24)
(本文编辑:李媚)
10.12056/j.issn.1006-2785.2017.39.4.2016-953
浙江省“十二五”基层卫生适宜技术成果转化工程重大项目(2013T301-12、15);嘉兴市科技计划项目(2013AY21042-5);嘉兴市重点科技创新团队项目([2013]3号)
233000安徽,蚌埠医学院(刘俊);嘉兴市第一医院普外科(王清清、曹浩强、张浩)
张浩,E-mail:changgung1@163.com
