沉默Calnexin 基因表达对胃癌细胞SGC- 7901 内质网应激凋亡及其信号通路的影响
2017-03-14张晓海张洪涛胡孝定钟华
张晓海 张洪涛 胡孝定 钟华
沉默Calnexin 基因表达对胃癌细胞SGC- 7901 内质网应激凋亡及其信号通路的影响
张晓海 张洪涛 胡孝定 钟华
目的探讨沉默钙连蛋白(Calnexin)基因对胃癌细胞SGC-7901内质网应激凋亡信号通路的影响。方法构建靶向Calnexin基因的慢病毒干扰载体,利用包装细胞293T获得重组慢病毒,转染人胃癌SGC-7901细胞,并分为转染shRNA-Calnexin的实验组,转染shRNA空白质粒的空白载体组,并将未转染的SGC-7901细胞作为对照组。应用RT-PCR技术检测靶向沉默Calnexin的表达,应用四甲基偶氮唑蓝(MTT)检测各组细胞增殖情况;流式细胞术检测各组细胞凋亡情况;Western blot检测GRP94、IRE1、ATF6及CHOP表达水平。结果转染shRNA沉默Calnexin基因可明显下调Calnexin mRNA的表达,实验组与对照组比较差异有统计学意义(P<0.05);MTT法检测实验组细胞转染后细胞增殖能力明显下降(P<0.05);沉默Calnexin基因可提高细胞凋亡率,转染72h后实验组与对照组比较,差异有统计学意义(P<0.05);沉默Calnexin基因使胃癌细胞中GRP94、IRE1、ATF6及CHOP蛋白表达水平明显升高(均P<0.05)。结论靶向沉默Calnexin基因抑制人胃癌细胞增殖和促进细胞凋亡可能是通过抑制内质网应激信号通路实现的。
钙连蛋白 SGC-7901 细胞 慢病毒 内质网应激 凋亡 胃癌
在我国每年大约有50万新发胃癌患者,病例数占全球的1/2,胃癌在恶性肿瘤中发病率、死亡率均为第3位。目前我国对于胃癌的治疗手段主要为手术治疗及化疗,但上述治疗方法并不能达到患者及医生的期望疗效,且具有5年生存率低、不良反应大等特点[1]。钙连蛋白(Calnexin)是内质网中的I型跨膜蛋白,具有辅助糖蛋白折叠装配、监控内质网折叠蛋白质量、调节细胞内Ca2+稳态和缓解内质网应激(endoplasmic reticulum stress, ERS)等作用[2]。已有研究发现,在肿瘤的发生及发展过程中,ERS现象普遍存在[3],并且ERS选择性地保留了对ERS有拮抗倾向的细胞,使存活下的肿瘤细胞向更恶性的方向进展[4]。基于上述研究,本研究提出下调Calnexin基因表达,干扰Calnexin/Calreticulin循环,使肿瘤细胞内Ca2+稳态及错误蛋白降解能力失衡,促进原本耐受ERS的肿瘤细胞向凋亡路线倾斜。本研究观察了胃癌细胞SGC-7901沉默Calnexin基因后,对ERS下游凋亡相关因子GRP94、IRE1、ATF6及CHOP的表达,为胃癌的靶向治疗提供理论依据。
1 材料和方法
1.1 材料SGC-7901细胞(ATCC公司,美国);光学显微镜(BX51,Olympus公司,日本);一氧化氮检测仪(NO-501,IMN,日本);水平摇床(WD-9405B,六一公司,中国);GRP94、IRE1、ATF6及CHOP抗体(Boster公司,中国)、β-actin内参抗体(wanleibio公司,中国);Annexin V细胞凋亡试剂盒(SIGMA,美国);RPMI 1640(GIBCO,美国);流式细胞仪(LSR-Ⅱ,BD公司,美国)。
1.2 构建针对Calnexin基因的shRNA慢病毒载体采用Ambion公司的设计软件,针对人Calnexin的mRNA(NM 014062)设计4条siRNA序列,经过构建质粒,转染293T细胞,根据其对Calnexin基因的抑制效率,确定有效RNAi序列为:sense:5′-CACAGCAACCACTTCCCTTC-3′,设计为短发卡shRNA序列合成并退火成双链。慢病毒的骨架质粒pLVTHM经BamHI和EcoRI双酶切消化后与双链DNA进行连接反应,进行PCR鉴定,连接成功的载体送基尔顿生物科技公司进行菌种培养扩增并抽提质粒DNA。
1.3 shRNA慢病毒颗粒包装出毒对数生长期的293T细胞接种于25ml细胞培养皿,细胞密度约70%时将重组的慢病毒骨架质粒与包装辅助质粒用磷酸钙共转染至病毒包装细胞293T,培养12h后弃去含有转染混和物的培养液,加入新鲜的细胞培养液继续培养。收集转染72h的293T细胞上清液,于4℃,4 000g离心10min以去除细胞碎片,0.45μm滤器过滤后置于25 000r/min超速离心90min,而后以冰PBS液重悬病毒沉淀,分装置于-80℃冰箱保存,该实验步骤于基尔顿生物科技公司完成。
1.4 细胞培养与分组SGC-7901细胞加入到10%灭活胎牛血清的MEM培养液中(条件:37℃;5%体积分数CO2;饱和湿度,每2~3天传代1次)。将细胞悬浊液以5×104/孔的密度接种于24孔板,细胞融合80%~90%进行转染,将细胞分为对照组(未转染的SGC-7901细胞)、空白载体组(转染shRNA空白质粒)、实验组(转染shRNA-Calnexin的胃癌细胞)。
1.5 细胞转染(1)取出冷藏保存的病毒,并轻轻摇匀;(2)感染目的细胞:观察细胞生长状态,细胞贴壁,状态良好则开始实验;(3)用移液器精准吸出10倍于细胞的病毒液加入培养基中;(4)加入ploybrene(8μg/ml)液体,加入培养基中以提高感染效率;(5)混匀后在37℃、5%CO2浓度条件的培养箱中孵育过夜;(6)孵育24h后将培养基更换为正常培养液,在原有条件下继续培养48h[5],该实验步骤于基尔顿生物科技公司完成。
1.6 采用RT-PCR检测Calnexin基因表达引物信息:Calnexin F:5′-GAAGGGAAGTGGTTGCTGTG-3′,R:5′-CGTCTTTCTTGGCTTTGGAT-3′。经过总RNA提取后进行RNA浓度检测,将得到的RNA样本进行反转录得到对应的cDNA。在冰浴的无核酸酶的离心管中加入反应混合物,加热条件:70℃加热5min,冷却2min。离心后加入5×Buffer(4μl)、RNasin(0.5μl)、1μl M-MLV,轻轻混匀。25℃温浴10min,42℃温浴50min,95℃加热5min,终止反应。经由PCR仪完成上述过程,可得20μl cDNA,待PCR循环结束后,马上升温至95℃,维持10min,再降至60℃,维持20s;从60℃提升至72℃,维持30s,最后降至4℃维持5min,此过程循环40次。每个样品基因行6个复孔平行实验,实验结果舍去较大误差数值后选取剩余值平均值为实验数据,实验结果采用2-△△CT法分析数据,该实验步骤于基尔顿生物科技公司完成。
1.7 采用四甲基偶氮唑蓝(MTT)检测各组细胞增殖率取各组转染24h细胞,实验前用台盼蓝拒染法确认SGC-7901细胞拒染率在95%以上,调整细胞数为4× 107/L,取200μl接种于96孔板中(每组细胞5个复孔),设对照组、空白载体组、实验组,培养24、48、72h后,每孔加入5g/L MTT 20μl,继续培养4h后去上清液,逐一加入DMSO 100μl后震荡混匀,待蓝色晶体完全溶解反应后,应用酶标仪测定570nm处的吸光度值(OD值),并计算抑制率。抑制率=(1-实验组OD值/空白对照组OD值)×100%[6]。该实验步骤于基尔顿生物科技公司完成。
1.8 流式细胞仪检测各组细胞凋亡分别收集72h培养的SGC-7901细胞,经过消化、PBS冲洗、悬浮、300目尼龙网过滤细胞后加入300μl的Binding Buffer悬浊细胞,加入5μl的Annexin V-FITC混合,再加入Propidium Iodide并充分混匀;常温下避光反应20min;采用流式细胞仪检测并应用软件分析结果,该实验步骤于基尔顿生物科技公司完成。
1.9 Western blot检测各组胃癌细胞内GRP94、IRE1、ATF6及CHOP表达分别收集72h培养的SGC-7901细胞,制备组织匀浆,Western blot检测步骤:蛋白质抽提→蛋白质定量→SDS-PAGE→转印至PVDF膜→封闭→孵育一抗→孵育二抗→ECL底物发光→图像保存。普通抗体的封闭液、一抗孵育液、二抗孵育液为5%脱脂奶粉溶液。检测各组细胞中GRP94、IRE1、ATF6及CHOP的表达[7]。该实验步骤由浙江省皮肤病防治研究所自行研究完成。
1.10 统计学处理采用SPSS 17.0统计软件。计量资料以表示,两组间比较采用t检验;多组间比较采用方差分析,两两比较采用SNK-q检验。
2 结果
2.1 采用RT-PCR检测Calnexin基因表达经RTPCR检测,对照组细胞中Calnexin mRNA水平为1.00± 0.02,实验组细胞中Calnexin mRNA水平为0.35±0.01,明显减少,两组比较差异有统计学意义(P<0.05);而空白载体组(1.02±0.01)与对照组比较,Calnexin mRNA水平无明显变化,差异无统计学意义(P>0.05)。
2.2 各组细胞增殖的影响MTT法检测细胞增殖情况显示,与对照组比较,实验组Calnexin基因沉默后对胃癌细胞SGC-7901抑制生长作用明显,且培养时间越长,抑制作用越明显,差异有统计学意义(P<0.05),空白载体组与对照组比较差异无统计学意义(P>0.05),见表1。
2.3 各组细胞凋亡的影响与对照组比较,实验组细胞凋亡率明显上升,差异有统计学意义(P<0.05);而空白载体组与对照组比较,细胞凋亡率无明显变化,差异无统计学意义(P>0.05),见表1和图1。

表1 沉默Calnexin基因对胃癌细胞SGC-7901增殖及凋亡的影响(n=6)
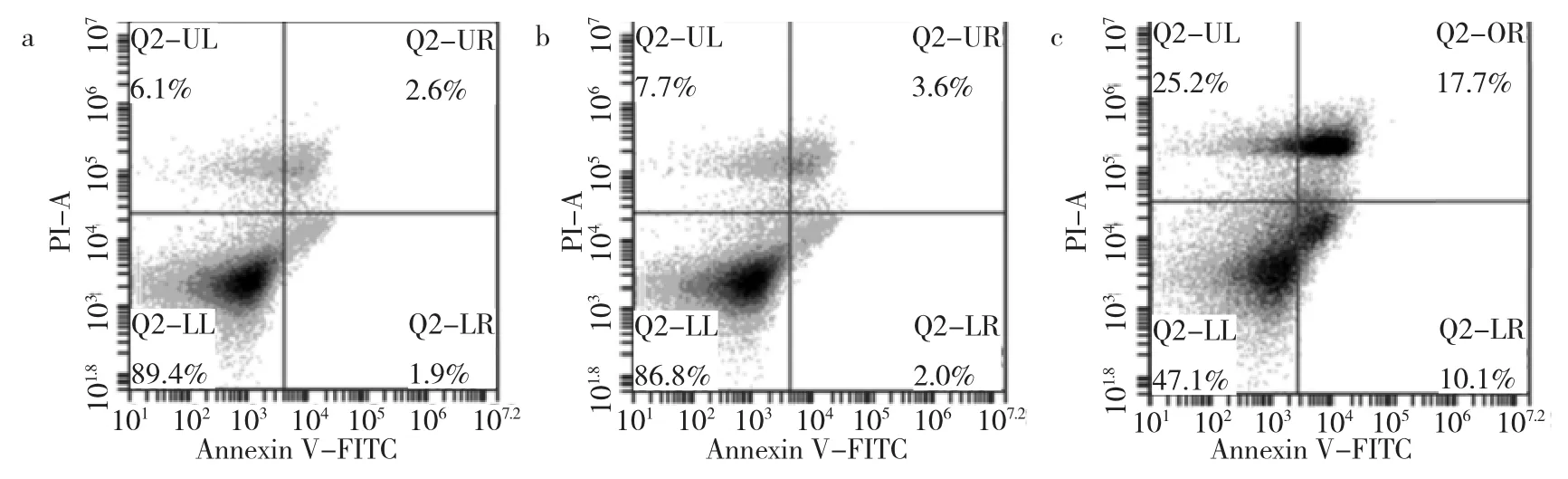
图1 流式细胞仪检测各组细胞凋亡情况(a:对照组;b:空白载体组;c:实验组)
2.4 各组细胞中GRP94、IRE1、ATF6及CHOP表达沉默Calnexin基因后,与对照组比较,实验组GRP94、IRE1、ATF6及CHOP表达升高,差异均有统计学意义(均P<0.05),而空白载体组与对照组相比较上述蛋白表达,差异均无统计学意义(均P>0.05),见表2和图2。

表2 各组细胞中GRP94、IRE1、ATF6及CHOP的表达(n=6)
3 讨论
在我国胃癌发现时多为中晚期,手术治疗效果欠佳,临床治疗多以手术、化疗相结合为主[8]。但化疗药物具有毒性反应强、且靶向性不明确、易产生耐药性等缺点,在临床应用中受到了诸多限制。因此,寻找高效、靶向治疗胃癌的方法不仅是目前的研究热点,更是亟待解决的问题。
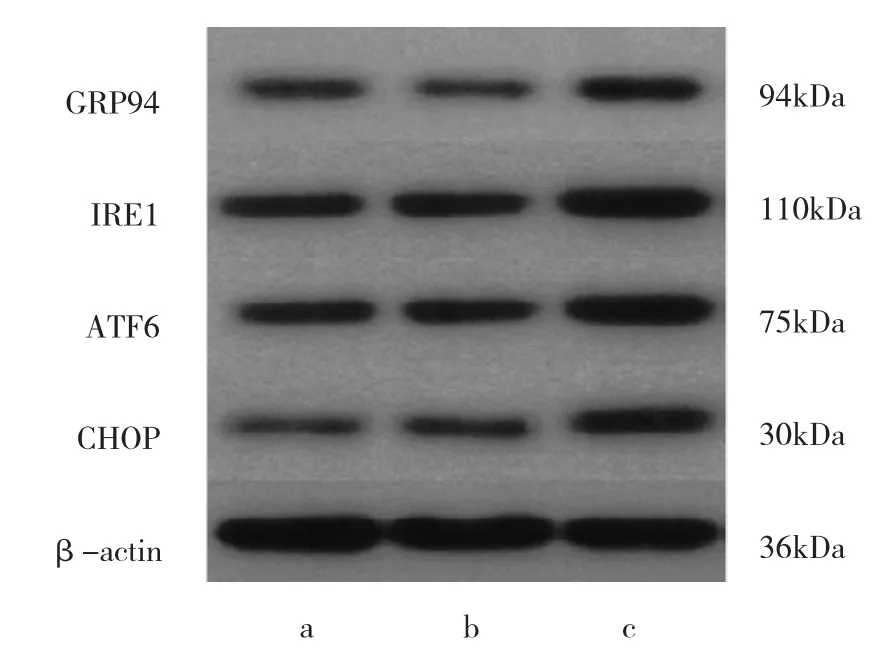
图2 各组细胞中GRP94、IRE1、ATF6及CHOP表达电泳图(a:对照组;b:空白载体组;c:实验组)
胃癌细胞由于其自身疯狂繁殖和处于高酸环境等特点,传统抗癌药物难以将胃癌细胞杀死。目前现代科学技术对于细胞的靶向诱导逐渐成熟,诱导肿瘤细胞凋亡已成为治疗肿瘤的希望和研究热点。ERS是近年来新发现的凋亡机制,现阶段研究认为ERS发生的主要原因是内质网折叠蛋白功能异常,导致错误蛋白在内质网内堆积[4],短时间的ERS是细胞自我修复的一种方法,但长期的ERS发生即可引起细胞凋亡。大量研究证实[8-9],恶性肿瘤细胞疯狂生长和繁殖,致使肿瘤细胞普遍缺氧并发生ERS,但发生ERS的肿瘤细胞并不走向凋亡,这可能与肿瘤细胞长期处于缺氧状态已产生耐缺氧及ERS耐受有关[8],减少肿瘤细胞对ERS的耐受性,使肿瘤细胞更倾向于凋亡,可能成为治疗胃癌的新靶点。
Calnexin是内质网内稳态体系的重要组成部分,即Calnexin/Calreticulin循环,可使错误折叠的糖蛋白重新折叠,而难以纠正构象的糖蛋白为避免在内质网过度堆积造成危害,则在内质网甘露糖苷酶I作用下从Calnexin/Calreticulin循环中释放出来,与受体蛋白EDEM结合,后者通过Sec61p通道进入胞液,在泛素-蛋白酶体系中将其降解,这一过程称为糖蛋白内质网相关性降解[10]。内质网分子伴侣蛋白GRP94与肿瘤细胞关系密切,姚元春等[11]通过免疫组化及分子生物学等技术研究发现GRP94在人胃癌组织中呈高表达状态,并且与胃癌细胞侵袭力相关,可作为胃癌分期及恶性程度的检验指标。现阶段公认的ERS信号通路共有(1)PERK→eIF2a→ATF-4→CHOP;(2)IRE1→CHOP;(3)ATF6→CHOP等3条,诱导CHOP、Caspase-3及JNK因子的表达及活化,驱使细胞凋亡。虽然已有研究证实,Calnexin与ERS的发生有关[12],但尚未有研究报道Calnexin的表达是否可以干扰胃癌细胞这种长期耐受ERS的“特能细胞”的增殖速度及凋亡情况。
慢病毒载体的研究发展迅速,该载体可以将外源基因有效地整合到宿主染色体且成功率较高[13],本研究通过慢病毒介导干扰RNA沉默Calnexin基因表达,并用RT PCR技术验证Calnexin基因沉默效果,观察干扰后胃癌细胞增殖及凋亡情况,以了解Calnexin基因与胃癌细胞生存的关系。MTT结果显示,沉默Calnexin基因后胃癌细胞增殖受到抑制,并且凋亡率增加,为了探讨胃癌细胞增殖抑制的机制,本研究进一步采用Western blot检测ERS标志物GRP94及ERS信号通路。研究结果显示,当Calnexin基因沉默时,GRP94、IRE1、ATF6及CHOP表达增加,这说明Calnexin基因沉默可使ERS标志物GRP94表达更高,打破胃癌细胞原本对ERS耐受的平衡,并且通过IRE1→CHOP、ATF6→CHOP通路诱导胃癌细胞凋亡。
综上所述,本研究虽然证实沉默Calnexin基因可通过IRE1→CHOP/ATF6→CHOP通路诱导胃癌SGC-7901细胞凋亡、抑制细胞增殖,但对于胃癌细胞其他凋亡通路的影响、分裂周期时相的分布尚不得而知,下一步研究将更深入地挖掘Calnexin基因对胃癌细胞的影响,为胃癌的临床治疗提供新靶点和新思路。
[1]季加孚.我国胃癌防治研究三十年回顾[J].中国肿瘤临床,2013,40 (22):1346-1351.
[2]张峰.内质网分子伴侣Calnexin的研究进展[J].生物学通报,2008,43 (8):7-10.
[3]贾宇鹏,何苗,魏敏杰.GRP78在肿瘤发生发展及干性形成中的研究进展[J].生命的化学,2015,35(4):559-564.
[4]曾惠爱,刘先领.内质网应激与肿瘤细胞凋亡[J].肿瘤防治研究, 2013,40(2):206-208.
[5]王伊林,赵雅君,杨洋,等.磷酸肌酸钠对慢病毒介导Calumenin蛋白沉默阿霉素损伤心肌细胞内质网应激信号通路的作用[J].临床心血管病杂志,2015,31(10):1119-1122.
[6]Kim S H,Kim K Y,Yu S N,et al.Silibinin induces mitochondrial NOX4-mediated endoplasmic reticulum stress response and its subsequent apoptosis[J].BMC Cancer,2016,16(1):452.doi:10. 1186/s 12885-016-2516-6.
[7]王伊林,单晓彤,柴花,等.丹参酮ⅡA磺酸钠腹腔注射对阿霉素心肌病大鼠心功能及左室纤维化的影响[J].山东医药,2016,56(7): 34-36.
[8]叶建新,刘声源,庄金福.新辅助化疗对进展期胃癌手术并发症的影响[J].肿瘤防治研究,2014,41(9):1026-1030.
[9]Ghadban T,Jessen A,Reeh M,et al.In vitro study comparing the efficacy of the water-soluble HSP90 inhibitors,17-AEPGA and 17-DMAG,with that of the non water-soluble HSP90 inhibitor, 17-AAG,in breast cancer cell lines[J].Int J Mol Med,2016,38 (4):296-302.doi:10.3892/ijmm.2016.2696.
[10]林胜利,李载权,唐朝枢.Calnexin/Calreticulin循环与糖蛋白内质网应激相关性降解[J].医学分子生物学杂志,2004,1(5):298-301.
[11]姚元春,张红,赖丽琴.GRP78、GRP94蛋白mRNA在人胃癌组织中的表达及临床意义[J].安徽医科大学学报,2013,48(2):152-154.
[12]Zhang Q,Liu J,Chen S,et al.Caspase-12 is involved in stretch-induced apoptosis mediated endoplasmic reticulum stress[J].Apoptosis,2016,21(4):432-442.doi:10.1007/s 10495-016-1217-6.
[13]Lei C J,Yao C,Pan Q Y,et al.Lentivirus vectors construction of SiRNA targeting interference GPC3 gene and its biological effects on liver cancer cell lines Huh-7[J].Asian Pac J Trop Med, 2014,7(10):780-786.doi:10.1016/s 1995-7645(14)60136-X.
Effectsof calnexin silencing on endoplasmicreticulum stress-apoptosisand itssignaling pathway in gastriccancer cellline SGC-7901
ZHANG Xiaohai,ZHANG Hongtao,HU Xiaoding,etal.Departmentof Internal Medicine,Zhejiang Skin Disease Prevention and Treatment Center,313200Deqing,China
ObjectiveTo investigate the effects of calnexin gene silencing on endoplasmic reticulum stress-apoptosis and its signaling pathway in gastric cancer SGC-7901cells.MethodsLentiviral vectors for short hairpin RNAs targeting the coding region of human calnexin gene were constructed.The recombinant lentiviral vectors were harvested from 293T cells and were used to transfect human gastric cancer SGC-7901 cells.SGC-7901 cells were transfected with shRNA-Calnexin (experimental group)or shRNA blank plasmid(blank vector group),and the non-transfected SGC-7901 cells were used as control group.Expression of calnexin mRNA in SGC-7901 cells were detected by RT-PCR,cell proliferation was detected by MTT,cell apoptosis was detected by flow cytometry,expression of GRP94,IRE1,ATF6 and CHOP were detected by Western blot.ResultsThe expression of Calnexin mRNA was down-regulated in experimental group compared to control group(P<0.05),and the cell proliferation was significantly decreased(P<0.05).The apoptosis rate was increased 72h after transfection, compared with the control group(P<0.05).The expression of GRP94,IRE1,ATF6 and CHOP was significantly increased in experimental group(P<0.05).ConclusionCalnexin silencing can inhibit cell proliferation and induce apoptosis of gastric cancer SGC-7901 cells probably by inhibiting endoplasmic reticulum stress signaling pathway.
CalnexinSGC-7901 cellSlow virusEndoplasmic reticulum stressApoptosisGastric cancer
2016-08-17)
(本文编辑:陈丽)
10.12056/j.issn.1006-2785.2017.39.4.2016-1304
浙江省医药卫生科研项目(2013KYB076)
313200德清,浙江省皮肤病防治研究所内科
张晓海,E-mail:doczhangxiaohai@163.com
