雌激素对去卵巢大鼠骨组织Wnt16、β- catenin、OPG、RANKL 表达的影响
2017-03-14魏双双张治芬黄哲人何轶然吴红艳刘文华汤珊珊黄坚
魏双双 张治芬 黄哲人 何轶然 吴红艳 刘文华 汤珊珊 黄坚
●论著
雌激素对去卵巢大鼠骨组织Wnt16、β- catenin、OPG、RANKL 表达的影响
魏双双 张治芬 黄哲人 何轶然 吴红艳 刘文华 汤珊珊 黄坚
目的研究雌激素对去卵巢大鼠骨组织中Wnt16、β-catenin、OPG、RANKL表达的影响,探讨雌激素对骨组织的保护作用。方法选取3月龄Wistar雌性大鼠40只,随机分为假手术组、去势组、实验组1和实验组2。两组实验组分别给予17β-雌二醇皮下注射4周和16周,其余两组给予等量0.9%氯化钠溶液。16周后测定骨组织中Wnt16、OPG、RANKL、β-catenin表达量,HE染色分析大鼠胫骨平台处骨小梁厚度(Tb.Th)、骨小梁数目(Tb.N)和骨小梁间距(Tb.SP)变化,ELISA法测定血清雌二醇(E2)水平。结果假手术组、实验组2与去势组比较,OPG、β-catenin、Wnt16 mRNA、血清E2水平、Tb.Th和Tb.N明显升高,RANKL水平和Tb.SP明显下降,差异均有统计学意义(均P<0.05)。实验组1与去势组相比,β-catenin、血清E2水平、Tb.Th和Tb.N明显升高,RANKL水平和Tb.SP明显下降,差异均有统计学意义(均P<0.05)。结论雌激素可能通过上调Wnt16、β-catenin、OPG表达,下调RANKL表达,来预防骨质疏松。
雌激素 Wnt16 β-catenin OPG RANKL 骨质疏松
骨质疏松分为原发性和继发性两种,其中原发性骨质疏松以绝经后骨质疏松(postmenopausal osteoporosis, PMO)最常见[1-3],这可能与绝经后雌激素减少有关[4-5]。基础和临床研究均证实雌激素的骨保护作用,但其作用机制仍不明确[6-7]。近年来随着Wnt/β-链蛋白(βcatenin)信号途径的发现,对其调节作用的研究也受到关注,研究表明Wnt1突变引起成骨不全症[8];成骨细胞高表达Wnt7b可促进骨量的增加[9],高表达Wnt4可在一定程度上缓解卵巢切除诱导的骨质流失[10]。Wnt16属于Wnt家族,可通过Wnt/β-catenin信号途径,参与调控人类骨骼系统疾病,与骨密度、骨皮质厚度、骨强度、骨折发生风险有关[11]。本实验利用去卵巢大鼠,探讨雌激素通过调节Wnt16/β-catenin信号途径预防骨质疏松的可能作用机制。Henry等[11]提出雌激素的骨保护作用机制可能与骨保护素(OPG)/NF-κB活化受体(RANK)/ NF-κB活化受体配体(RANKL)系统有关,Wnt16/βcatenin信号途径可调控OPG的表达,故本实验又对OPG、RANKL进行检测,试图进一步探讨雌激素的保护机制,为雌激素防治PMO提供理论依据。
1 材料和方法
1.1 主要试剂雌二醇试剂(美国Sigma公司);大鼠雌二醇免疫吸附测定(ELISA)试剂盒ESBL4287(美国EVER公司);总RNA提取试剂盒(TRIzol)(美国Invitrogen Life Technologies公司);Wnt16引物(武汉谷歌生物科技有限公司合成);一抗RANKL(美国Santa Cruz公司);一抗β-catenin、一抗OPG(美国abcam公司);HRP标记山羊抗兔鼠通用二抗、组化试剂盒DAB显色剂(丹麦DAKO公司)。
1.2 实验动物选取SPF级3月龄Wistar雌性大鼠40只,体质量180~200g,由浙江省中医药大学动物中心提供。Wistar雌性大鼠饲养于屏障动物室,室温(23±1)℃,湿度(50±10)%,自由进水,普通饲料喂养,5只/笼。
1.3 实验分组3月龄雌性大鼠随机分为4组,分别为假手术组、去势组、实验组1和实验组2,每组10只。去势组和两组实验组在喂养1周后切除双侧卵巢组织,假手术组切除等质量的腹部脂肪组织。术后2周两组实验组给予颈背部皮下注射17β-雌二醇(17β-E2)100mg/kg,其余两组给予等量0.9%氯化钠溶液,1次/d。实验组1给药4周,实验组2给药16周。
1.4 方法
1.4.1 取材大鼠称质量后给予10%水合氯醛麻醉,腹主动脉采血,经3 500r/min离心10min,分离血清,置-80℃冰箱保存。采血后,打开胸腔暴露心脏,将灌注针经左心室插入升主动脉,剪开右心房,用0.9%氯化钠溶液灌注。剥离出大鼠双侧股骨、胫骨,天平称其质量,一侧股骨、胫骨置于-80℃冰箱保存备用,另一侧股骨、胫骨采用4%多聚甲醛固定。
1.4.2 组织学观察将各组已固定的胫骨标本脱水脱钙、包埋,制成蜡块,连续切片,厚度约为5μm,HE染色。光镜下随机选取胫骨平台骨皮质区域,20倍高倍镜视野下观察骨小梁厚度(Tb.Th)、骨小梁数目(Tb.N)、骨小梁间距(Tb.SP)。
1.4.3 免疫组化方法检测大鼠胫骨骨皮质区RANKL、OPG、β-catenin表达水平取各组大鼠胫骨平台区骨皮质标本,石蜡切片脱蜡至水后置于胰酶抗原修复缓冲液(0.1%)的修复盒中修复抗原20min,分别滴加相应一抗(抗RANKL、抗OPG、抗β-catenin,1∶100),4℃孵育切片,过夜。然后滴加HRP标记山羊抗兔鼠通用二抗覆盖组织,室温孵育50min。DAB显色,常规脱水、封片、显微镜镜检和照相,观察并比较各组棕黄色颗粒的阳性细胞表达情况。
1.4.4 Western blot法检测大鼠胫骨骨皮质区RANKL、OPG、β-catenin表达水平取各组大鼠胫骨平台区骨皮质标本,用不连续丙烯酰胺凝胶电泳分离目的蛋白后转膜固定,用5%脱脂牛奶封闭1h,加一抗(抗RANKL、抗OPG、抗β-catenin,1∶1 000)后4℃孵育摇晃过夜,TBST冲洗孵育二抗(1∶3 000)后,曝光显色。甘油醛-3-磷酸脱氢酶(GAPDH)作为内参。用图像分析软件曝光后,Alpha软件处理系统分析目标带的光密度值。
1.4.5 RT-PCR法测定大鼠胫骨骨皮质区Wnt16表达水平取各组大鼠胫骨平台区骨皮质标本,采用总RNA提取试剂盒提取骨组织总RNA,取1μg RNA进行随机引物逆转录反应得cDNA,用Wnt16特异性引物进行PCR反应,引物正链:AGAGGTGGAACTGTATGGTCGC,负链:AATGAATGCTGTCTCCTTGGTG。PCR反应:95℃预变性5min,94℃变性1min,60℃复性1min,72℃延伸1min。同时加入内参GAPDH,正链:TTCCTACCCCCAATGTATCCG,负链:CATGAGGTCCACCACCCTGTT。取PCR产物10μl电泳,计算每一样品和其内参对照的相对含量。
1.4.6 血清E2水平测定采用ELISA法测定各组大鼠血清E2水平,使用大鼠雌二醇免疫吸附测定(ELISA)试剂盒,操作按说明书进行。
1.5 统计学处理采用SPSS 19.0统计软件。计量资料以表示,组间比较采用单因素方差分析,进一步两两比较,方差齐时采用LSD-t检验,方差不齐时采用Tamhane′s检验。
2 结果
2.1 各组骨组织形态学比较去势组与假手术组、实验组1、实验组2比较,Tb.N减少且排列疏、Tb.Th变薄且Tb.SP增宽(均P<0.05),骨髓环境中脂肪细胞数量增多,见表1和图1。
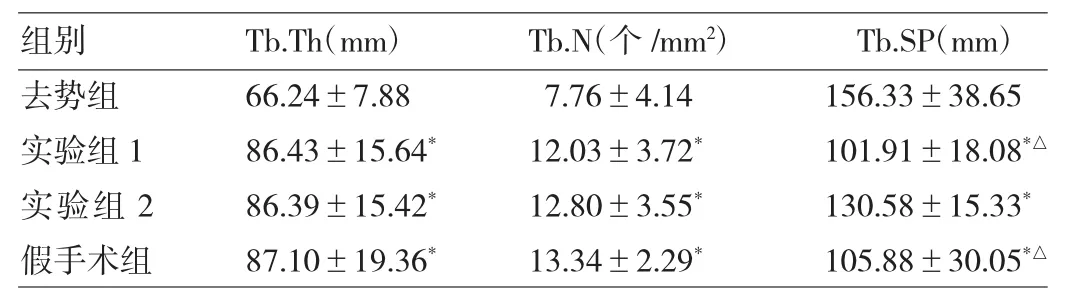
表1 各组骨组织形态学分析
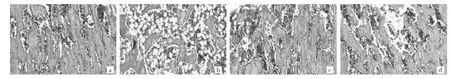
图1 各组骨组织形态(a:假手术组;b:去势组;c:实验组1;d:实验组2)
2.2 各组骨组织OPG、RANKL、β-catenin免疫组化检测结果比较骨组织OPG、β-catenin阳性细胞在假手术组最多,实验组2次之,实验组1较少,去势组最少;骨组织RANKL阳性细胞在假手术组最少,实验组2次之,实验组1较多,去势组最多,见图2。
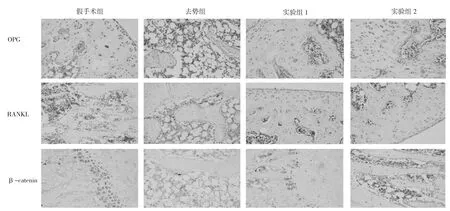
图2 免疫组化检测OPG、RANKL、β-catenin蛋白表达结果(×200)
2.3 各组骨组织OPG、RANKL、β-catenin Western blot检测结果比较假手术组、实验组2与去势组比较,OPG、β-catenin水平均升高,RANKL水平均下降,差异均有统计学意义(均P<0.05)。实验组1与去势组比较,β-catenin水平升高,RANKL水平下降,差异均有统计学意义(均P<0.05)。实验组1和实验组2与假手术组比较,OPG水平均下降,差异均有统计学意义(均P<0.05),见表2和图3。
2.4 各组骨组织Wnt16 mRNA及血清E2表达水平比较假手术组、实验组2与去势组比较,Wnt16 mRNA和血清E2水平均升高,差异均有统计学意义(均P<0.05)。实验组1与去势组比较,血清E2水平升高,差异有统计学意义(P<0.05)。实验组2与假手术组比较,Wnt16 mRNA水平升高,差异有统计学意义(P<0.05),见表3和图4。
3 讨论
Wnt家族是富含分泌型半胱氨酸的糖蛋白,根据是否依赖β-catenin转导,分为经典型和非经典型[12-13]。Wnt16属于Wnt家族,具有高度保守性,通过Wnt/βcatenin信号途径,参与调控人类骨骼系统疾病[11]。Wnt16与配体结合后,通过活化低密度脂蛋白受体相关蛋白/卷曲蛋白受体,使β-catenin从β-catenin/糖原合酶激酶3β复合体中解离,引起β-catenin在胞质中累积[14-15]。β-catenin表达量增加时,引起成骨细胞相关基因表达活跃,促进骨形成;β-catenin基因失活时,导致间充质细胞向软骨细胞分化而不是向成骨细胞分化[16-17]。因此,本研究采用去卵巢Wistar雌性大鼠,利用免疫组化、Western blot、RT-PCR法从蛋白质、mRNA水平探讨雌激素发挥骨保护的可能作用机制,结果发现切除大鼠双侧卵巢引起雌激素缺乏导致Wnt16 mRNA、β-catenin表达减少,Tb.N减小且排列稀疏、Tb.Th变薄且Tb.SP增宽,最终导致骨质疏松[18]。给予外源性雌激素16周后,Wnt16 mRNA表达量升高[11],提示Wnt16的表达可能很大程度上依赖雌激素的作用,其具体调节机制尚不明确。目前认为可能机制是,Wnt16启动子上含有功能性c-Jun结合位点[19],雌激素直接和/或间接作用于Wnt16启动子,调控Wnt16的表达,激活Wnt16/βcatenin信号途径,进而促进成骨细胞相关基因表达,发挥骨保护作用。此外,雌激素治疗,可缓解因雌激素缺乏导致的骨髓环境中脂肪细胞的增多。Gao等[16]研究表明,17β-E2呈剂量依赖性,通过Wnt/β-catenin信号途径抑制骨髓间充质干细胞向脂肪细胞分化。在鼠3T3-L1脂肪前体细胞中,β-catenin通过减少CCAAT/增强子结合蛋白-α和过氧化物酶体增殖物激活受体γ(PPARγ)的表达[20],抑制其分化为脂肪细胞。敲除β-catenin基因,可增加PPARγ表达,促进骨髓环境的脂肪形成[21]。因此,雌激素可能通过Wnt/β-catenin信号途径抑制脂肪细胞形成,从而发挥骨保护作用。本研究还发现,E2处理4周时,β-catenin即可增加,而Wnt16仅在16周时出现差异,这表明可能存在其他Wnt/β-catenin途径参与雌激素调节的过程。马威等[22]研究也证实,雌激素可以促进Wnt2、β-catenin蛋白表达,通过调节Wnt2/βcatenin信号途径促进去卵巢后骨质疏松大鼠成骨细胞增殖,这可能是引起Wnt16与β-catenin非同步变化的原因。
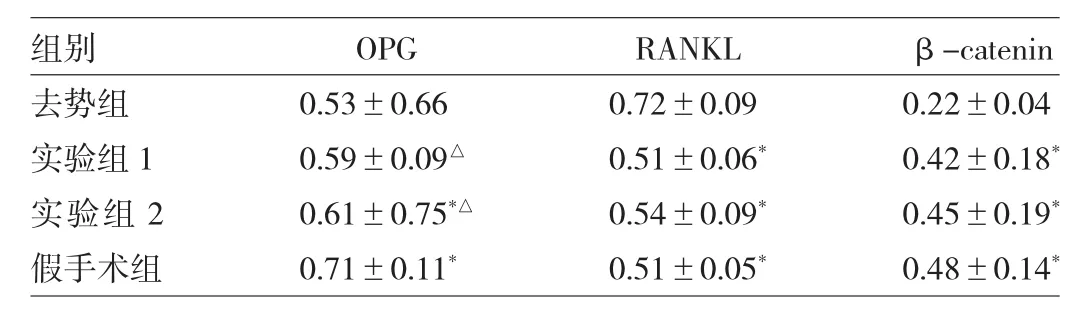
表2 各组骨组织OPG、RANKL、β-catenin表达水平比较
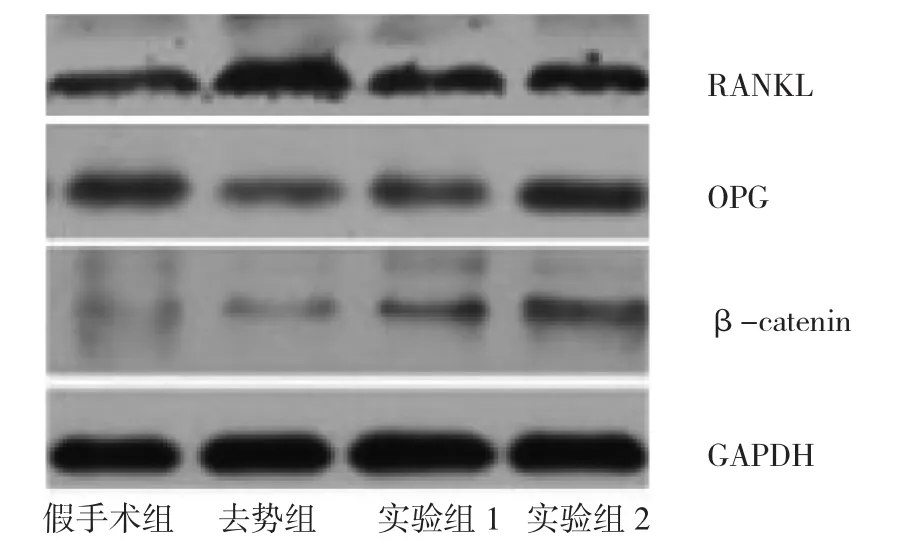
图3 各组骨组织OPG、RANKL、β-catenin蛋白的表达
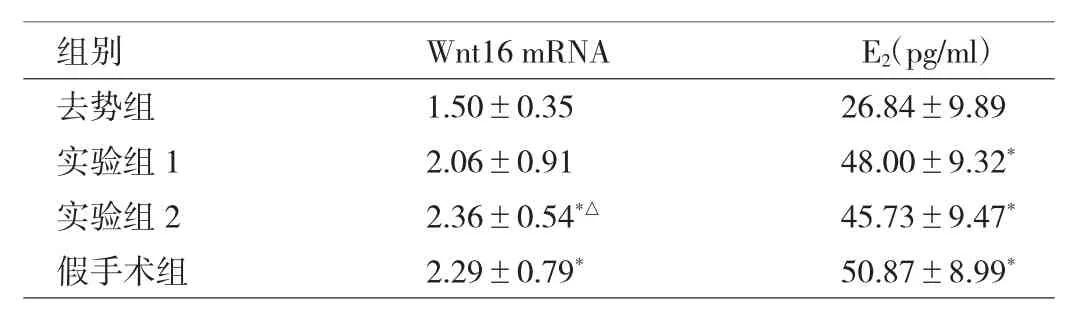
表3 各组骨组织Wnt16 mRNA及血清E2表达水平比较
图4 骨组织Wnt16 mRNA扩增曲线
RANKL是表达在成骨细胞和基质细胞上的膜结合蛋白,可被金属蛋白酶分解为可溶性RANKL,通过与RANK特异受体结合后活化成熟破骨细胞,最终引起骨质吸收[23]。OPG是成骨细胞和骨髓基质细胞分泌的可溶性诱导受体,通过与RANK竞争性结合RANKL,阻断RANK/RANKL信号通路,抑制成熟破骨细胞的骨吸收活性[4,23]。本研究发现,外源性给予雌激素16周后,促进OPG表达、抑制RANKL表达,进而增加OPG/RANKL比率,对去卵巢大鼠骨质疏松有明显的防治作用。因此,雌激素可能通过OPG/RANK/RANKL系统发挥骨保护作用。
Movérare-Skrtic等[24]研究表明,成骨细胞来源的Wnt16可增加OPG表达,间接抑制破骨细胞分化,也可作用于破骨祖细胞,直接抑制破骨细胞生成;特异性敲除成骨细胞Wnt16基因,可导致OPG表达减少,破骨细胞数量增多,骨皮质变薄,使骨折发生风险增加。结合本研究,E2处理16周后,Wnt16、β-catenin、OPG表达增加。因此,雌激素可能作用Wnt16/β-β-catenin途径后,进一步作用于OPG/RANK/RANKL系统发挥骨保护作用,但具体机制尚不明确,仍需进一步细胞学研究。
[1]Henriksen K,Christiansen C,Karsdal M A.Role of biochemical markers in the management of osteoporosis[J].Climacteric, 2015,18(2):10-18.doi:10.3109/13697137.2015.1101256.
[2]GambaccianiM,LevanciniM.Hormone replacement therapy and the prevention ofpostmenopausalosteoporosis[J].Prz Menopauzalny,2014,13(4):213-220.
[3]Ma Z,Yang Y,Lin J,et al.BFH-OST,a new predictive screening tool for identifying osteo-porosis in postmenopausal Han Chinese women[J].Clin Interv Aging,2016,4(11):1051-1059.doi: 10.2147/CIA.S107675.
[4]Boyce B F,Xiu Y,Li J,et al.NF-kappaB-Mediated Regulation of Osteoclastogenesis[J].Endocrinol Metab(Seoul),2015,30(1): 35-44.doi:10.3803/EnM.2015.30.1.35.
[5]Watts N B,GLOW investigators.Insights from the Global LongitudinalStudy of Osteoporosis in Women(GLOW)[J].Nat Rev Endocrinol,2014,10(7):412-422.doi:10.1038/nrendo.2014.55.
[6]de Villiers T J.The role of menopausal hormone therapy in the management ofosteoporosis[J].Climacteric,2015,18(12):19-21. doi:10.3109/13697137.2015.1099806.
[7]Shao B,Liao L,Yu Y,et al.Estrogen preserves Fas ligand levels by inhibiting microRNA-181a in bone marrow-derived mesenchymal stem cells to maintain bone remodeling balance[J]. FASEB J,2015,29(9):3935-3944.doi:10.1096/fj.15-272823.
[8]Keupp K,Beleggia F,Kayserili H,et al.Mutations in WNT1 cause different forms of bone fragility[J].Am J Hum Genet,2013,92(4): 565-574.doi:10.1016/j.ajhg.2013.02.010.
[9]Chen J,Tu X,Esen E,et al.WNT7B promotes bone formation in part through mTORC1[J].PLoS Genet,2014,10(1):e1004145. doi:10.1371/journal.pgen.1004145.eCollection 2014.
[10]Yu B,Chang J,Liu Y,et al.Wnt4 signaling prevents skeletal aging and inflammation byinhibiting nuclear factor-kappaB[J].Nature medicine,2014,20(9):1009-1017.doi:10.1038/nm0915-1101.
[11]Henry Todd,Gabriel L G,Lee B M,et al.Wnt16 Is Associated with Age-RelatedBoneLossandEstrogen Withdrawal in Murine Bone[J].PLoS One,2015,10(10):e0140260.doi:10. 1371/journal.pone.0140260.eCollection 2015.
[12]Maeda K,Kobayashi Y,Udagawa N,et al.Wnt5a-Ror2 signaling between osteoblast-lineage cells and osteoclast precursorsenhances osteoclastogenesis[J].Nat Med,2012,18(3): 405-412.doi:10.1038/nm.2653.
[13]Wu S M,Shih L H,Lee J Y,et al.Estrogen enhances activity of Wnt signaling during osteogenesis by inducing Fhl1 expression [J].J Cell Biochem,2015,116(7):1419-1430.doi:10.1002/jcb. 25102.
[14]Kobayashi Y,Uehara S,Udagawa N,et al.Regulation of bone metabolism by Wnt signals[J].J Biochem,2016,159(4): 387-392.doi:10.1093/jb/mvv124.
[15]Ma C,Shuai B,Shen L,et al.Serum carcinoembryonic antigen-related cell adhesion molecule 1 level in postmenopausal women:correlation with β-catenin and bone mineraldensity[J]. Osteoporos Int,2016,27(4):1529-1535.doi:10.1007/s00198-015-3408-3.
[16]Gao B,Huang Q,Lin Y S,et al.Dose-Dependent effect of estrogen suppresses the osteo-adipogenic transdifferentiation of osteoblasts via canonical Wnt signaling pathway[J].PLoS One, 2014,9(6):e99137.doi:10.1371/journal.pone.0099137.eCollection 2014.
[17]Rossini M,Gatti D,Adami S.Involvement of WNT/b-catenin signaling in the treatment of osteoporosis[J].Calcif Tissue Int, 2013,93(2):121-132.
[18]Galea G L,Meakin L B,Williams C M,et al.Protein kinase Calpha(PKCalpha)regulates bone architecture and osteoblast activity[J].J Biol Chem,2014,289(37):25509-25522.doi:10. 1074/jbc.M114.580365.
[19]Kan A,Tabin C J.c-Jun is required for the specification of joint cell fates[J].Genes Dev,2013,27(5):514-524.doi:10.1101/ gad.209239.112.
[20]Christodoulides C,Laudes M,Cawthorn W P,et al.The Wnt antagonist Dickkopf-1 and its receptors are coordinately regulated during early human adipogenesis[J].J Cell Sci,2006,119(Pt 12):2613-2620.
[21]Jeong B C,Kim T S,Kim H S,et al.Transmembrane protein 64 reciprocally regulates osteoblast and adipocyte differentiation by modulating Wnt/β-catenin signaling[J].Bone,2015,78:165-173.doi:10.1016/j.bone.2015.05.009.
[22]马威,潘静,胡必成.补肾活血中药对骨质疏松大鼠Wnt信号的影响[J].中国骨质疏松杂,2015,21(7):820-823.
[23]Boyce B F.Advances in osteoclast biology reveal potential new drug targets and new roles for osteoclasts[J].J Bone Miner Res, 2013,28(4):711-722.doi:10.1002/jbmr.1885.
[24]Mov rare-Skrtic S,Henning P,Liu X,et al.Osteoblast-derived WNT16 represses osteoclast-ogenesis and prevents cortical bone fragility fractures[J].Nat Med,2014,20(11):1279-1288. doi:10.1038/nm.3654.
Effects of estrogen on Wnt16,β-catenin,OPG,RANKL expression in bone tissue of ovariectomized rats
WEI Shuangshuang, ZHANG Zhifen,HUANG Zheren,et al.Department of Obstetrics and Gynecology,Hangzhou Hospital of Nanjing Medical University, Hangzhou 310006,China
ObjectiveTo investigate the effects of estrogen on the expression of Wnt16,β-catenin,OPG,RANKL in bone tissue of ovariectomized rats.MethodsForty female Wistar rats were randomly dividedinto sham operation group, ovariectomized group,estrogen group 1 and estrogen group 2.In the estrogen groups,17β-E2was injected subcutaneously for 4 weeks or 16 weeks after ovariectomy,respectively.The other two groups were given the same volume of normal saline.The expression of Wnt16 mRNA was detected with RT-PCR,the expressions of OPG,RANKL,β-catenin proteins in bone cortex tissue were detected with Western blot and immunohistochemistry,respectively.The thickness of the trabecular bone(Tb.Th), number of trabecular bone(Tb.N)and thetrabecular spacing(Tb.SP)were measured using HE staining analysis,and serum E2level was determined by ELISA.ResultsCompared to ovariectomized group,The expression of OPG,β-catenin,Wnt16 mRNA in bone tissue,the serum E2levels,and Tb.Th,Tb.N in estrogen group 2 and sham operation group were significantly increased, the expression of RANKL and Tb.SP were significantly decreased(all P<0.05).Compared to ovariectomized group the expression of β-catenin,serum E2,and Tb.Th,Tb.N in estrogen group 1 were significantly increased,the expression of RANKL and Tb.SP were significantly decreased(all P<0.05).ConclusionEstrogen may prevent osteoporosis by up-regulation of Wnt16, β-catenin,OPG and down-regulation RANKL expression in bone tissue.
EstrogenWnt16β-cateninOPGRANKLOsteoporosis
2016-09-22)
(本文编辑:陈丽)
10.12056/j.issn.1006-2785.2017.39.4.2016-1489
国家卫生计生委科学研究基金-浙江省医药卫生重大科技计划(WKJ-ZJ-024);浙江省科技厅重大科技专项重点项目(2014C03044-1);杭州市医药卫生科技计划重点项目2011Z003);杭州市科技局重点项目(20142013A58,20140733Q16)
310006南京医科大学附属杭州医院妇产科(魏双双、张治芬、黄哲人、何轶然、吴红艳);杭州市妇产科医院妇产科(刘文华、汤珊珊、黄坚)
张治芬,E-mail:zhangzf@zju.edu.cn
