葡萄球菌感染的膝关节置换兔局部低强度超声波刺激观察
2017-03-13刘拴张明勇胡冰武汉科技大学附属天佑医院武汉430064
刘拴,张明勇,胡冰(武汉科技大学附属天佑医院,武汉430064)
葡萄球菌感染的膝关节置换兔局部低强度超声波刺激观察
刘拴,张明勇,胡冰
(武汉科技大学附属天佑医院,武汉430064)
目的 观察葡萄球菌感染的膝关节置换兔局部低强度超声波刺激的效果。方法 清洁级SD兔40只,采用膝关节试件(万古霉素骨水泥制作)对兔膝关节行膝关节置换,术后随机分为观察组和对照组各20只。术后第3 天取两组兔于膝关节处紧贴膝关节后方穿刺注射金黄色葡萄球菌菌液0.1 mL1次后,观察组予低强度超声辐射,1次/d,连续5 d。对照组不做任何处理。 术后第7天,采集两组颈动脉血检测两组血清万古霉素。术后第30 天观察两组膝关节炎症情况,术后第30 天处死兔,观察膝关节液金黄色葡萄球菌培养情况,观察膝关节滑膜组织感染情况。结果 术后第7天观察组、对照组血清万古霉素水平分别为(60.23±8.36)、(40.36±6.28)mmol/L,两组比较,P<0.05。术后第30天时观察组、对照组炎症评分分别为(2.13±0.08)、(3.12±1.02)分,两组比较,P<0.05。观察组对照组膝关节附近、关节腔内均可见炎症,但观察组炎症范围信号低,范围小。观察组金黄色葡萄球菌生长较少,甚至没有菌落生长,对照组可见大量淡黄色的阳性葡萄球菌菌落。术后第30天时观察组、对照组感染评分分别为(2.23±0.79)、(4.84±0.13)分,两组比较,P<0.05。结论 局部低强度超声波刺激可防治膝关节置换术后早期感染。
膝关节植入术;低强度超声;抗生素骨水泥;感染
膝关节置换术[1]是在人工髋关节置换成功应用于临床后发展起来的治疗膝关节疾病的新技术,目前已广泛应用于临床治疗中。膝关节置换术后感染是其严重并发症,一旦发生可延长患者术后康复时间,使患者遗留不同程度的关节活动受限[2]。具有抗菌能力的骨组织工程修复材料-抗生素骨水泥[3]已被应用于预防膝关节置换术后早期感染[4,5]。研究[6]发现,葡萄球菌是导致膝关节假体感染的相关菌群,具有高耐药性(50%耐庆大霉素)。万古霉素属于糖肽类大分子抗生素,对革兰阳性菌具有较强的杀伤力,且治疗过程中不良反应较少[7]。但抗生素释放能力不稳定[8]。万古霉素骨水泥的体外释放率仅为15%左右[9,10]。提高抗生素骨水泥的释放率,以便更好控制膝关节术后早期感染具有重要的临床研究意义。低强度超声在促进药物靶向释放上具有明显优势,可促进小分子物质穿透多孔膜[11~13],但目前关于其促渗作用的研究报道较少。2014年1月~2016年2月,我们观察了葡萄球菌感染的膝关节置换兔局部低强度超声波刺激的效果。现将结果报告如下。
1 材料与方法
1.1 实验动物、试剂及仪器 8周龄清洁级SD兔40只,雌雄不限,体质量(250±10)g[许可证号:SCXK(粤)2015-0020]。实验过程对动物的处置符合动物伦理学要求。聚甲基丙烯酸甲酯粉末、固化液购自美国Sigma公司;万古霉素购自浙江医药股份有限公司新昌制药厂;骨试件模具购自武汉博士德生物有限公司; 磁力搅拌器购自苏州净化公司。40只兔常规喂养1周后采用膝关节试件[14,15](将40 g聚甲基丙烯酸甲酯粉末及3 g万古霉素放置于密闭容器内,磁力搅拌器充分搅拌后混合30 min,加入固化液20 g,充分搅拌30 min,将搅拌物注入到骨试件模具中铸型,室温下放置1 h,400 mg/L环氧乙烷消毒后保存,备用)对兔膝关节行膝关节置换术。术后将40只兔随机分为观察组和对照组,每组各20只,自由喂养,备用。
1.2 膝关节置换兔葡萄球菌感染方法及低强度超声干预方法 置换术后第3 天取两组兔,于膝关节处紧贴膝关节后方穿刺注射金黄色葡萄球菌菌液0.1 mL。术后第3天观察组予低强度超声辐射,探头对准兔局部的膝关节,紧贴皮肤,30 min/次,输出声强300 mW/cm2,输出频率25 kHz,1次/d,连续5 d。对照组不做任何处理。
1.3 两组血清万古霉素水平检测 于造模第7天,取两组兔,采集颈动脉血5 mL,3 000 r/min离心5 min,取上清,采用免疫偏振荧光法检测两组血清万古霉素水平,测定范围在0~100 μg/mL。
1.4 两组膝关节炎症程度观察 造模第30 天取两组实验兔,对膝关节矢状面、横断面进行MRI检查,观察两组膝关节炎症情况,根据Lazaerttos制定的炎症表现标准[16]评估两组膝关节炎症程度,主要包括情绪、体温升高、患侧压痛、组织脓肿形成、体质量下降。出现1项上述症状记1分,总分最高为5分,最低为0分。
1.5 两组膝关节液金黄色葡萄球菌培养菌落生长情况观察 造模第30 天10%采用苯巴比妥钠处死两组兔,抽取膝关节液100 μL,观察膝关节液金黄色葡萄球菌培养情况:将关节液接种至培养基上培养48~72 h,记录两组金黄色葡萄球菌落的生长情况。
1.6 两组膝关节滑膜组织感染情况观察 取“1.4”中膝关节滑膜组织1~2 g,PBS 10 mL冲洗,匀浆器处理,多聚甲醛固定,石蜡包埋、切片,行HE染色,显微镜下采用Riegels-Nieiesn的感染诊断标准[17,18]观察膝关节滑膜组织炎症表现。按照镜下组织炎症情况计分,发现阳性计1分,每组取5个组织标本,最低分为0分,最高分为5分。
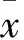
2 结果
2.1 两组血清万古霉素水平比较 造模第7天观察组、对照组血清万古霉素水平分别为(60.23±8.36)、(40.36±6.28)mmol/L,两组比较,P<0.05。
2.2 两组膝关节炎症情况比较 造模第30天时两组手术切口均愈合。造模第30天时两组膝关节,两组膝关节炎症情况见图1。观察组、对照组膝关节附近、关节腔内均可见炎症,但观察组炎症范围信号低,范围小。造模第30天时观察组、对照组炎症评分分别为(2.13±0.08)、(3.12±1.02)分,两组比较,P<0.05。
2.3 两组膝关节液金黄色葡萄球菌培养情况 观察组金黄色葡萄球菌生长较少,甚至没有菌落生长,对照组可见大量淡黄色的阳性葡萄球菌菌落。
2.4 两组膝关节滑膜组织感染情况比较 造模第30天时观察组、对照组感染评分分别为(2.23±0.79)、(4.84±0.13)分,两组比较,P<0.05。造模第30天时两组膝关节滑膜组织感染情况见图2。
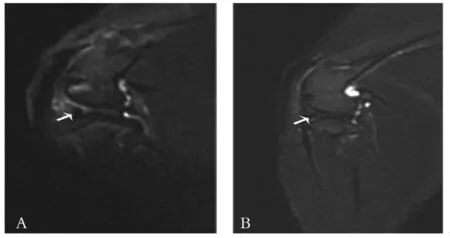
注:A对照组可见膝关节附近、关节腔炎症表现,炎症范围信号强,炎症范围大;B观察组可见可见膝关节附近、关节腔炎症表现,炎症范围信号低,炎症范围小。
图1 造模第30天时两组膝关节MRI图像
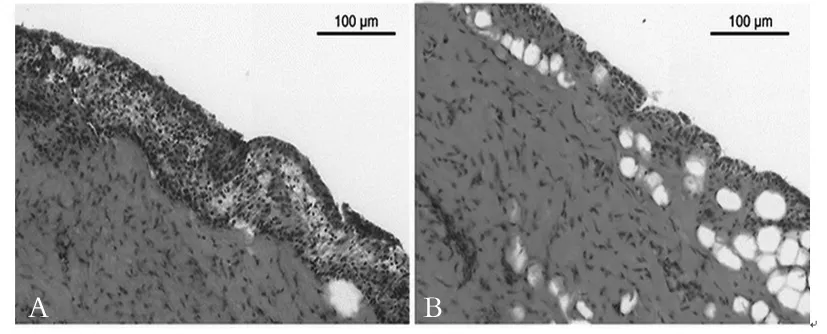
注:A对照组,可见组织水肿充血,淋巴细胞、中性粒细胞、巨噬细胞弥漫分布;B观察组,可见组织炎症细胞较少。
图2 造模第30天时两组膝关节滑膜组织HE染色
3 讨论
据不完全统计,全球约5%膝关节置换术患者术后发生假体移植相关感染,导致严重并发症或手术失败[19]。抗生素骨水泥作为局部装载药物缓释作用系统被应用与人工置换假体置入,对术后假体相关感染起到了积极的控制作用,但是其抗生素药物释放效果有待于进一步研究[20]。研究发现,低强度超声系统可通过空化效应产生微声流、机械传感、温热效应对抗生素骨水泥药物释放具有促进作用,同时研究[21]发现,导致假体相关感染的葡萄球菌对广谱抗生素庆大霉素具有较高的耐药性,而万古霉素对创伤感染革兰阳性菌具有极强的杀菌抑菌作用,且耐药性较低,全身毒副反应较少[22]。因此,万古霉素是目前假体置换抗生素骨水泥的首选药物。抗生素骨水泥由于结构致密,在药物释放上受到一定的限制,抗生素难以溶出,因此促进抗生素释放增加孔隙的药物溶出率,提高抗生素骨水泥抗生素所载抗生素的能力,显得尤为关键,目前多数研究仅为体外研究,体内释放作用并不明确。
低强度脉冲超声是一种经皮传递的非侵入性的机械能,是一种频率低,功率小的超声波。其在生物器官内产生高频声压波。既往研究发现,低强度超声在促进药物靶向释放上具有明显优势,可促进小分子物质穿透多孔膜[11~13]。 本研究我们观察了葡萄球菌感染的膝关节置换兔局部低强度超声辐射的效果,结果显示造模第7天观察组血清万古霉素浓度高于对照组,说明低强度超声可提高细胞通透性,在作用抗生素骨水泥局部,提高了血药浓度,以低强度连续频率为超声作为干预手段,大大提高了药物释放的浓度,加速早期释放,发挥生物声学效应。对照组膝关节液细菌培养出现大量淡黄色的葡萄球菌菌落,观察组菌落生长较少,甚至没有菌落生长。HE染色光学显微镜发现对照组样本普遍发现组织水肿充血,弥漫分布淋巴细胞、中性粒细胞、巨噬细胞;而观察组镜下可见组织炎症细胞较少,甚至没有发现炎症细胞。猜测低强度超声干预辅助万古霉素对兔膝关节置换处早期感染的预防作用可能机制为:大剂量抗生素释放后,低强度超声可抑制一般无法彻底清除的悬浮细菌及黏附细菌的增殖,促进万古霉素穿过细菌的细胞膜,加强抗生素局部应力,最终增强万古霉素的杀菌作用;另外在体内间隔较短的时间采用低强度超声,增加局部的药物浓度,在用药的早期发挥杀菌作用,缩短局部无效抑菌浓度的时间,减少耐药菌出现的可能性。
综上所述,低强度超声辐射对葡萄球菌感染的膝关节置换兔局部感染具有防治作用。
[1] Djurasovic M, Glassman SD, Carreon LY, et al. Contemporary Management of Symptomatic Lumbar Spinal Stenosis[J]. Orthop Clin north Am, 2010,41(2):42-43.
[2] Tumialan LM, Ponton RP, Riccio AL, et al. Rate of return to military active duty after single level lumbar interbody fusion:a 5-year retrospective review[J]. Neuro Surg, 2012,71(2):317-324.
[3] Felson DT. Arthroscopy as a treatment for knee osteoarthritis[J]. Best Pract Res Clin Rheumatol, 2010,5(1):47-50.
[4] Kim HJ, Bak KH, Chun HJ, et al. Posterior interspinous fusion device for onelevel fusion in degenerative lumbar spine disease:comparison with pedicle screw fixation. Preliminary report of at least one year follow up[J]. J Korean Neurosurg Soc, 2012,52(4):395-364.
[5] Djurasovic M, Glassman SD, Carreon LY, et al. Contemporary Management of Symptomatic Lumbar Spinal Stenosis[J]. Orthop Clin North Am, 2010,41(2):42-43.
[6] Tumialan LM, Ponton RP, Riccio AL, et al. Rate of return to military active duty after single level lumbar interbody fusion:a 5-year retrospective review[J]. Neuro Surg, 2012,71(2):317-324.
[7] Chen M, Chen R, Xiong J, et al. Evaluation of different moxibustion doses for lumbar disc herniation:multicentre randomised controlled trial of heat-sensitive moxibustion therapy[J]. Acupunct Med, 2012,30(4):266-272.
[8] Felson DT. Arthroscopy as a treatment for knee osteoarthritis[J]. Best Pract Res Clin Rheumatol, 2010,5(1):47-50.
[9] Rackwitz L, Eden L, Reppenhagen S, et al. Stem cell-and growth factor-based regenerative therapies for avascular necrosis of the femoral head[J]. Stem Cell Res Ther, 2012,3(1):7.
[10] Helbig L, Simank HG, Kroeber M, et al. Core decompression combined with implantation of a demineralised bone matrix for non-traumatic osteonecrosis of the femoral head[J]. Arch Orthop Trauma Surg,2012,132(8):1095-1103.
[11] Liu Y, Liu S, Su X. Core decompression and implantation of bone marrow mononuclear cells with porous hydroxylapatite composite filler for the treatment of osteonecrosis of the femoral head[J]. Arch Orthop Trauma Surg, 2013,133(1):125-133.
[12] Chen CH, Chang JK, Lai KA, et al. Alendronate in the prevention of collapse of the femoral head in nontraumatic osteonecrosis:a two-year multicenter, prospective,randomized, double-blind, placebo-controlled study[J]. Arthritis Rheum, 2012,64(5):1572-1578.
[13] Peled E, Bejar J, Barak M, et al. Core decompression and alendronate treatment of the osteonecrotic rat femoral head:computer-assisted analysis[J]. Int J Exp Pathol, 2013,94(3):212-216.
[14] Kim HJ. Autologous adipose tissue-derived stem cells induce persistent bone-like tissue in osteonecrotic femoral heads:not bone-like,but fat-like tissue[J]. Pain Phy, 2012,15(5):749-752.
[15] Kaushik AP, Das A, Cui Q. Osteonecrosis of the femoral head:An update in year 2012[J]. World J Orthop,2012,3(5):49-57.
[16] Witasp A, Carrero JJ, Heimburger O, et al. Increased expression of pro-inflammatory genes in abdominal subcutaneous fat in advanced chronic kidney disease patients[J]. J Intern Med, 2011,26(9):410-419.
[17] Pauyo T.Management of femoral neck fractures in the young patient:A critical analysis review[J]. World Jour Orth Pedics,2014,5(3):204.
[18] Wang W, Wu JJ, Xu ZW, et al. Open reduction and closed reduction internal fixation in treatment of femoral neck fractures:a meta-analysis[J]. BMC Muscul Disord, 2014,30(15):167.
[19] Elmi A. Long-Term Follow-Up Results of Delayed Fixation of Femoral Neck Fractures in Adults[J]. Trauma Monthly, 2013,18(1):8-11.
[20] Bishop JA, Behn AW, Castillo TN,et al.The Biomechanical Significance of Washer Use With Screw Fixation[J]. Jour Orthop Trauma, 2014,28(2):114-117.
[21] Thomas A, Mason F, Deshpande S, et al. An unusual presentation of femoral neck fracture in a young patient[J]. Jour Surg Case Rep, 2014,(12):123-125.
[22] 李长签,丛海波,杜全红,等.抗生素骨水泥链珠在创伤性骨髓炎治疗中的应用[J].山东医药,2014,54(6):59-61.
胡冰(E-mail: 897138981@qq.com)
10.3969/j.issn.1002-266X.2017.07.013
R31
A
1002-266X(2017)07-0043-03
2016-05-23)
