原发性肝癌患者癌组织、血清miR-202表达变化及其意义
2017-03-13於琳张开炯柴利李宝林杨志惠刘靳波西南医科大学附属医院四川泸州646000
於琳,张开炯,柴利,李宝林,杨志惠,刘靳波(西南医科大学附属医院,四川泸州646000)
·论著·
原发性肝癌患者癌组织、血清miR-202表达变化及其意义
於琳,张开炯,柴利,李宝林,杨志惠,刘靳波
(西南医科大学附属医院,四川泸州646000)
目的 观察原发性肝癌患者癌组织及血清微小RNA 202(miR-202)水平变化,并探讨其意义。方法 70例原发性肝癌患者,留取其术前血清标本及手术切除的原发性肝细胞癌组织标本;30例份正常肝组织来自本院手术切除的肝血管瘤旁组织(病理检查证实无肿瘤浸润),30例体检健康者留取血清标本,检测原发性肝癌患者癌组织、正常肝组织miR-202,检测原发性肝癌患者、健康体检者血清miR-202。分析miR-202表达与原发性肝癌患者临床病理参数的关系,绘制ROC曲线评价miR-202、AFP、miR-202联合AFP对原发性肝癌的诊断价值。结果 原发性肝癌组织标本中miR-202的相对表达量低于正常肝组织标本(P均<0.05),原发性肝癌患者血清中miR-202的相对表达量低于健康体检者(P<0.05);原发性肝癌组织中miR-202的相对表达量高于血清miR-202(P<0.05)。原发性肝癌组织中miR-202表达与原发性肝癌性别、年龄、血清AFP水平、肿瘤直径、肿瘤数目、肿瘤部位、分化程度、TNM分期、转移与否、包膜浸润、HBV感染、是否伴随肝硬化以及门静脉癌栓均无关(P均>0.05);原发性肝癌血清中miR-202的水平仅与肿瘤数目有关(P<0.05),与性别、年龄、血清AFP水平、肿瘤直径、肿瘤数目、肿瘤部位、分化程度、TNM分期、转移与否、包膜浸润、HBV感染、是否伴随肝硬化以及门静脉癌栓均无关(P均>0.05)。miR-202联合AFP诊断原发性肝癌的ROC曲线下面积0.942,敏感度81.8%,特异度93.0%。结论 原发性肝癌组织中miR-202低表达,血清miR-202水平降低。血清miR-202水平与原发性肝癌肿瘤数目有关。miR-202联合AFP诊断原发性肝癌的敏感度、特异度均较高。
肝癌;原发性肝癌;肝肿瘤;微小RNA;微小RNA202
原发性肝癌是常见的肝脏恶性疾病之一,目前已有的生物学标志物特异度及敏感度均不高导致对肝癌的诊断价值欠佳[1],因此亟需寻找对肝癌具有特异诊断价值的标志物。微小RNA(miRNA)是一类内源性非编码小RNA,其异常表达可影响肿瘤的发生、发展过程[2,3],提示miRNA可作为潜在的肿瘤诊断标志物。miR-202在肝癌患者癌组织中呈低表达[4],但目前尚无文献报道原发性肝癌组织及患者血清miR-202水平与肝癌临床病理参数之间的关系。我们观察了原发性肝癌患者癌组织及血清miR-202表达变化,并分析血清miR-202检测诊断原发性肝癌的效能。现将结果报告如下。
1 资料与方法
1.1 临床资料 选取2014年7月~2015年1月西南医科大学附属医院就诊的原发性肝癌患者70例,男59例,女11例,年龄23~72岁,中位年龄48岁。均行手术切除,留取其术前血清标本及手术切除的原发性肝细胞癌组织标本。纳入标准:①经病理检查确诊为原发性肝癌者;②在此次治疗前均未接受任何治疗者;③存在外科手术指征者。排除标准:①伴有严重营养不良者;②存在双相情感障碍、应激相关性精神障碍、偏执性精神障碍、分裂情感性精神障碍、精神分裂症等重型精神疾病,对自己的行为无完全刑事承担能力者;③不愿意参加本次研究者。同时收集30例份正常肝组织甲醛固定石蜡包埋标本,标本均取自本院手术切除的肝血管瘤旁组织,病理组织学证实无肿瘤浸润,患者中男16例、女14例,年龄26~61岁、中位年龄42岁。选择同期在本院体检中心体检30例体检健康者的血清标本,检查者中男18例、女12例,年龄21~55岁、中位年龄38岁。本研究经医院医学伦理学委员会批准,均获得患者知情同意。
1.2 原发性肝癌患者癌组织及血清miR-202检测 采用实时荧光定量PCR法检测原发性肝癌患者癌组织、正常肝组织miR-202及原发性肝癌患者、健康体检者血清miR-202。取保存于1.5 mL灭酶、灭菌EP管中的原发性肝癌组织切片,加入二甲苯320 μL,漩涡震荡10 s,瞬时离心后,将切片浸入二甲苯中,56 ℃干浴锅中温育3 min,待石蜡完全溶解后取出,置于室温冷却,按照miRNeasy FFPE Kit说明书操作提取RNA;血清RNA提取:将血清从-80 ℃冰箱取出,置室温解冻,待完全溶解后取200 μL血清至1.5 mL灭菌、灭酶EP管中,按照miRNeasy Serum/Plasma Kit说明书操作提取RNA。根据逆转录试剂盒PrimeScriptTMRT reagent Kit说明书操作将RNA逆转录为cDNA,样本置-80 ℃保存。通过miRBase数据库查找miR-202成熟序列:AGAGGUAUAGGGCAUGGGAA,采用茎环原则设计miR-202(GeneBank序列号:NC_000010.11)引物,其中上游引物序列:5′-GCTGGAGAGGTATAGGGCA-3′;下游引物序列:5′-GTGCAGGGTCCGAGGT-3′。U6基因(GeneBank序列号:NC_000015.10)上游引物序列:5′-CTCGCTTCGGCAGCACATATACT-3′,下游引物序列:5′-ACGCTTCACGAATTTGCGTGTC-3′,引物均由美国Invitrogen公司合成。PCR总反应体系为20 μL,包括上、下游引物各0.8 μL,SYBR®Premix Ex Taq Ⅱ 10μL, ROX Reference Dye Ⅱ 0.4 μL,模板cDNA 2 μL,无菌ddH2O补足体积至20 μL。反应参数:95 ℃预变性30 s;95 ℃ 3 s、60 ℃ 30 s,共40个循环。用ABI 7500 Fast Real-time PCR仪自带软件进行熔解曲线分析, miR-202的相对表达量以2-ΔΔCt表示,ΔΔCt=[(样本Ct目的基因-样本Ct内参基因)/(对照组Ct目的基因-对照组Ct内参基因)]。
1.3 统计学方法 采用SPSS21.0 统计软件行统计学处理。不符合正态分布的计量资料以中位数(四分位数)[M(P25,P75)]表示,两组间比较采用Mann-Whitney U检验,多组间比较采用Cruskal-Wallis H检验。同时记录原发性肝癌患者肿瘤直径、肿瘤数目、肿瘤部位、TNM分期[参照国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)标准]、分化程度、是否转移、HBV感染(采用乙肝 DNA定量PCR法判定,以<100 IU/mL为阴性)、AFP浓度(采用德国西门子公司ADVIA Centaur®XP 全自动化学发光免疫分析仪检测)等临床资料。以血清miR-202表达水平为变量绘制ROC曲线并进行二元Logistics回归分析评价miR-202单项和联合AFP检测对原发性肝癌的诊断价值。P<0.05为差异具有统计学意义。
2 结果
2.1 原发性肝癌组织及血清中miR-202相对表达量比较 正常肝组织、原发性肝癌组织标本中miR-202的相对表达量分别为为1.05(0.85,1.39)、0.44(0.34,0.63),原发性肝癌患者和健康体检者血清中miR-202的相对表达量分别为0.26(0.10,0.51)、1.15(0.88,1.43)。原发性肝癌组织标本中miR-202的相对表达量均低于正常肝组织标本(P均<0.05),原发性肝癌患者血清中miR-202的相对表达量低于健康体检者(P<0.05),原发性肝癌组织标本中miR-202的相对表达量高于血清中(P<0.05)。
2.2 miR-202表达与原发性肝癌患者临床病理参数的关系 miR-202表达与原发性肝癌患者临床病理参数的关系见表1。 原发性肝癌组织中miR-202表达与原发性肝癌性别、年龄、血清AFP水平、肿瘤直径、肿瘤数目、肿瘤部位、分化程度、TNM分期、转移与否、包膜浸润、HBV感染、是否伴随肝硬化以及门静脉癌栓均无关(P均>0.05);原发性肝癌血清中miR-202的水平仅与肿瘤数目有关(Z=-2.74,P<0.05),与性别、年龄、血清AFP水平、肿瘤直径、肿瘤数目、肿瘤部位、分化程度、TNM分期、转移与否、包膜浸润、HBV感染、是否伴随肝硬化以及门静脉癌栓均无关(P均>0.05)。
以血清miR-202水平为变量绘制ROC曲线(miR-202 值取 0.35, AFP值取400 g/L)评价miR-202、AFP、mR-202联合AFP对原发性肝癌的诊断价值。与miR-202、AFP单独检测比较,miR-202联合AFP诊断原发性肝癌的ROC曲线下面积(AUCROC)0.942,敏感度81.8%,特异度93.0%。见图1、表1。
3 讨论
肝癌的发生、发展是一个多因素、多阶段的复杂过程,由于起病隐匿,仅有小部分肝癌患者在确诊时能够手术治疗,此为造成肝癌患者预后不良的关键因素。目前肝癌的诊断主要依靠血清AFP水平联合影像学检查(包括腹部超声、MRI、CT增强扫描等),但各有其不足之处,影像学检查对组织细微改变的灵敏度不高,血清AFP对肝癌的诊断灵敏度和特异度分别为39%~64%与76%~91%[5],导致其诊断价值受限,因此寻找一种有效的肝癌早期诊断标志物尤为重要。
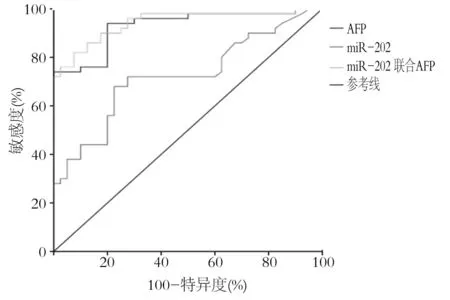
图1 血清miR-202、AFP、miR-202联合AFP诊断原发性肝癌的ROC曲线
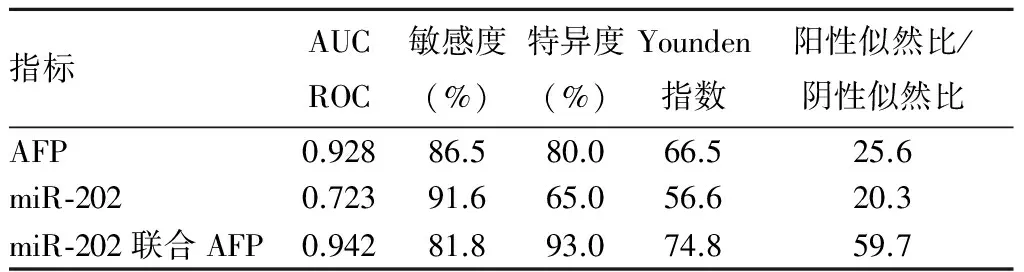
指标AUCROC敏感度(%)特异度(%)Younden指数阳性似然比/阴性似然比AFP0.92886.580.066.525.6miR⁃2020.72391.665.056.620.3miR⁃202联合AFP0.94281.893.074.859.7
研究[6,7]报道肝癌组织中存在多种miRNAs的表达异常,但其在肝癌发生、发展过程中的具体调控机制仍有待阐明。在众多肝癌相关miRNAs中,miR-202位于10q26的脆性位点,其丢失与子宫内膜结核及大脑肿瘤有关,尽管许多文献已报道miR-202胃癌、食管癌、宫颈癌、白血病中表达异常降[8~10],但关于肝癌组织中miR-202的表达情况目前仅有1例报道[4],且肝癌组织及患者血清标本中的水平及其与肝癌临床病理参数之间的相关性至今尚无报道。在福尔马林固定石蜡包埋标本(FFPE)中,miRNA虽然含量相对较少但稳定存在,不受标本制作过程影响导致降解[11]。此外有学者分析新鲜组织与FFPE中提取出的miRNA水平发现,两种组织样本中的miRNA含量具有较好的相关性[12],且FFPE较新鲜组织样本易于保存和获取。尽管目前已有大量文献[13,14]报道miRNAs在肿瘤中有表达谱改变,但是大部分研究仅采集组织标本,导致其临床应用受到一定的限制。miRNA在血清标本中稳定存在,不会轻易被RNA酶降解,且其水平具有组织特异性[15]。miRNA的上述优点均使其可能成为潜在的生物标志物。
本研究结果表明,原发性肝癌组织标本中miR-202的相对表达量均低于正常肝组织标本,原发性肝癌患者血清中miR-202的相对表达量低于健康体检者。与以往文献[4]报道miR-202在肝癌组织中表达降低的结果基本一致,提示miR-202在肝癌中发挥类似抑癌基因的作用。肝癌组织中miR-202表达与肝癌细胞系中miR-202表达一致,表明 miR-202作为一种可能的肝癌抑制基因,其表达下调在肝癌的发生、发展过程中起着重要作用。miR-202表达与肝癌患者生物学特性之间相关性分析表明,肝癌组织中miR-202的表达与肝癌患者性别、年龄、肿瘤直径、分化程度、临床分期、肿瘤部位、AFP浓度、包膜浸润、门静脉癌栓、包膜浸润、HBV感染、是否肝硬化、是否转移均无关。本研究同时检测了miR-202在上述70例肝癌患者血清中的表达情况,结果与组织标本相符,其在肝癌患者血清中的水平明显低于健康志愿者,但在肝癌血清标本中miR-202的表达水平与患者临床病理参数之间的相关性分析结果表明,miR-202表达水平仅与肿瘤数目有关,而与患者性别、年龄、肿瘤直径等无关,二者分析并不完全一致,可能是由于其在组织和血清中的调控机制不同导致。多发性肿瘤患者miR-202表达水平显著低于单发性肿瘤患者,提示miR-202可能在影响肝癌细胞增殖方面起到一定作用。miR-202在肝癌各进展期组织及血清中表达相对稳定,提示其可作为肝癌诊断标志物。本研究中原发性肝癌组织标本中miR-202的相对表达量高于血清中,分析原因其一可能由于miR-202的调控机制不同所致;其二,血清miRNA主要来源于细胞主动分泌释放入血,故血清miRNA水平本就低于组织水平。由miR-202、AFP及两者联合对肝癌诊断的ROC曲线来看,miR-202对血清AFP具有一定的补充诊断意义。
综上,原发性肝癌组织中miR-202低表达,血清miR-202水平降低。血清miR-202水平与原发性肝癌肿瘤数目有关;miR-202联合AFP诊断原发性肝癌的敏感度、特异度均较高。
[1] Chauhan R, Lahiri N. Tissue-and serum-associated biomarkers of hepatocellular carcinoma [J]. Biomark Cancer, 2016,8(Suppl 1):37-55.
[2] Wu Y, Yu J, Ma Y, et al. miR-148a and miR-375 may serve as predictive biomarkers for early diagnosis of laryngeal carcinoma [J]. Oncol Lett, 2016,12(2):871-878.
[3] Espinosa-Parrilla Y, Muoz X, Bonet C, et al. Genetic association of gastric cancer with miRNA clusters including the cancer-related genes MIR29, MIR25, MIR93 and MIR106: results from the EPIC-EURGAST study [J]. Int J Cancer, 2014,135(9):2065-2076.
[4] Zhang Y, Zheng D, Xiong Y, et al. miR-202 suppresses cell proliferation in human hepatocellular carcinoma by downregulating LRP6 post-transcriptionally [J]. FEBS Lett, 2014,588(10):1913-1920.
[5] Marrero JA, Lok AS. Newer markers for hepatocellular carcinoma [J]. Gastroenterology, 2004,127(5):113-119.
[6] Wu SG, Huang YJ, Bao B, et al. miR-508-5p acts as an anti-oncogene by targeting MESDC1 in hepatocellular carcinoma [J]. Neoplasma, 2016,64(1):85-87.
[7] Zhang X, Jiang P, Shuai L, et al. miR-589-5p inhibits MAP3K8 and suppresses CD90+cancer stem cells in hepatocellular carcinoma [J]. J Exp Clin Cancer Res, 2016,35(1):176.
[8] Zhao Y, Li C, Wang M, et al. Decrease of miR-202-3p expression, a novel tumor suppressor, in gastric cancer[J]. PLoS One, 2013,8(7):69756.
[9] Meng X, Chen X, Lu P, et al. MicroRNA-202 inhibits tumor progression by targeting LAMA1 in esophageal squamous cell carcinoma[J]. Biochem Biophys Res Commun, 2016,473(4):821-827.
[10] Farahani M, Rubbi C, Liu L, et al. CLL exosomes modulate the transcriptome and behaviour of recipient stromal cells and are selectively enriched in miR-202-3p[J]. PLoS One, 2015,10(10):0141429.
[11] Doleshal M, Magotra AA, Choudhury G, et al. Evaluation and Validation of Total RNA Extraction Methods for MicroRNA Expression Analyses in Formalin-Fixed, Paraffin-Embedded Tissues[J]. J Mol Diagn,2008,10(3):203-211.
[12] Lim LP, Lau NC, Garrett-Engele P, et al. Microarray analysis shows that some microRNAs down regulate large numbers of target mRNAs [J]. Nature, 2005,433(7027):769-773.
[13] Yang G, Zhang P, Lv A, et al. MiR-205 functions as a tumor suppressor via targeting TGF-α in osteosarcoma [J]. Exp Mol Pathol, 2016,100(1):160-166.
[14] Li Y, Chen D, Jin L, et al. MicroRNA-20b-5p functions as a tumor suppressor in renal cell carcinoma by regulating cellular proliferation, migration and apoptosis[J]. Mol Med Rep, 2016,13(2):1895-1901.
[15] Fu Y, Wei X, Tang C, et al. Circulating microRNA?101 as a potential biomarker for hepatitis B virus?related hepatocellular carcinoma[J]. Oncol Lett, 2013,6(6):1811-1815.
Expression changes of miR-202 in cancerous tissues and serum of patients with primary hepatocellular carcinoma
YULin,ZHANGKaijiong,CHAILi,LIBaolin,YANGZhihui,LIUJinbo
(TheAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,China)
Objective To observe the expression changes and clinical significance of microRNA-202 (miR-202) in the cancerous tissues and serum of patients with primary hepatocellular carcinoma (HCC). Methods We collected 70 cases of primary HCC tissues and preoperative serum from 70 HCC patients, 30 cases of normal liver tissues which were confirmed with no tumor infiltration by pathology from 30 hepatic hemangioma patients, as well as 30 cases of serum from 30 healthy volunteers. RT-PCR was used to detect the expression of miR-202 in the normal liver tissues and primary HCC tissues, and in the serum of HCC patients and healthy volunteers, respectively. The relationship between miR-202 expression and the clinicopathological parameters in HCC patients was analyzed. We drew the ROC curve to evaluate the diagnostic value of miR-202, AFP, miR-202 combined with AFP in primary liver cancer.Results The relative expression of miR-202 in the primary HCC tissues was lower than that in the normal liver tissues (allP<0.05). The relative expression of miR-202 in the serum of HCC patients was lower than that in healthy subjects (P<0.05). The relative expression of miR-202 in primary HCC tissues was higher than that in the serum of HCC patients (P<0.05). The expression of miR-202 in primary HCC tissues was not correlated with gender, age, serum AFP level, tumor diameter, tumor size, tumor location, TNM stage, metastasis, invasion, HBV infection, with or without liver cirrhosis and portal vein thrombosis in HCC patients (allP>0.05).The serum levels of miR-202 in HCC pateints were only correlated with the number of tumors (P<0.05), but were not correlated with sex, age, serum AFP, tumor diameter, tumor number, tumor location, TNM stage, metastasis or not, capsule infiltration, HBV infection, with or without liver cirrhosis and portal vein thrombosis (allP>0.05). Combined detection of miR-202 and tumor marker AFP could get the higher sensitivity (81.8%) and specificity (93.0%) in the diagnosis of HCC, the AUC was 0.942. Conclusions The miR-202 expression in HCC tissues and serum is significantly lower in HCC patients, the miR-202 expression in HCC serum is correlated with tumor number, and the combined detection of miR-202 and AFP could get the higher sensitivity and specificity in the diagnosis of HCC.
hepatocellular carcinoma; primary hepatocellular carcinoma; liver neoplasm; microRNA; microRNA 202
四川省科学技术厅基金资助项目(14JC0801);西南医科大学附属医院科研项目(2015-QS-017)。
於琳(1989-),女,硕士研究生在读,主要研究方向为肿瘤的分子诊断。E-mail: 790460087@qq.com
刘靳波(1970-),女,博士,硕士研究生导师,教授,主要研究方向为肿瘤的分子诊断。E-mail: liujb7203@163.com
10.3969/j.issn.1002-266X.2017.07.001
R735.7
A
1002-266X(2017)07-0001-04
2016-07-31)
