芒柄花黄素对人胃癌细胞株MKN-45增殖、凋亡的影响及其机制
2017-03-13董陈诚钟漓张广钰王振冉冉福林陈霄广西壮族自治区人民医院南宁5300桂林医学院附属医院
董陈诚,钟漓,张广钰,王振冉,冉福林,陈霄(广西壮族自治区人民医院,南宁5300;桂林医学院附属医院)
芒柄花黄素对人胃癌细胞株MKN-45增殖、凋亡的影响及其机制
董陈诚1,钟漓2,张广钰2,王振冉2,冉福林2,陈霄2
(1广西壮族自治区人民医院,南宁530021;2桂林医学院附属医院)
目的 观察芒柄花黄素对人胃癌MKN-45细胞株增殖、凋亡的影响,并探讨其可能作用机制。方法 取对数生长期人胃癌MKN-45细胞分为A、B、C、对照组,A、B、C组分别加入20、 40、 80 μg/mL芒柄花黄素培养,对照组加入不含芒柄花黄素的完全培养基。采用MTT法观察给药24、48、72 h各组细胞增殖情况,计算细胞增殖抑制率。采用 DAPI染色法评价其对MKN-45细胞形态学的影响。采用Western blotting法检测给药48 h时各组细胞磷酸化IκB(p-IκB)及NF-κB p65。结果 随芒柄花黄素浓度升高,细胞增殖抑制率升高,且随干预时间增加,细胞增殖抑制率升高(P均<0.05)。给药72 h时A、B、C、对照组的凋亡率分别为25.62%±2.57%、48.27%±3.18%、72.51%±4.35%、1.07%±0.54%,A、B、C组与对照组相比,P均<0.05。给药48 h时A、B、C组细胞p-IκB、NF-κB p65蛋白相对表达量均高于对照组,且随芒柄花黄素浓度升高,细胞p-IκB及NF-κB p65蛋白相对表达量增加,P均<0.05。结论 芒柄花黄素可抑制人胃癌MKN-45细胞株的增殖、促进细胞凋亡,其机制可能为芒柄花黄素激活NF-κB信号通路。
芒柄花黄素;胃癌;胃肿瘤;细胞增殖;细胞凋亡
胃癌是消化道疾病恶性肿瘤之一,肿瘤侵袭性、患者病死率均较高[1,2]。目前,化疗、放疗及手术治疗在很大程度上提高了胃癌患者生存率[3]。常规化疗药物可降低肿瘤复发率,但存在毒性作用大、易产生耐药性等缺点。近年来抗肿瘤药物逐渐转向于植物来源的天然化合物,这些天然药物因其多靶点、多环节和多途径的抗肿瘤作用,日渐成为临床抗肿瘤药物研究的热点[4~6]。芒柄花黄素分离自植物红三叶草,为一种生物活性异黄酮,具有完善的生物功能和抗肿瘤作用[7]。研究发现其可通过激活p38 MAPK途径和清除氧自由基发挥肿瘤作用[8,9],但目前尚未见其对人胃癌MKN-45细胞NF-κB信号通路影响的报道。2015年6月~2016年4月,我们观察了芒柄花黄素对人胃癌MKN-45细胞株增殖、凋亡的影响,并探讨其可能作用机制。现将结果报告如下。
1 材料与方法
1.1 细胞、试剂及仪器 人胃癌MKN-45细胞株购自中科院上海细胞生物所细胞库。芒柄花黄素(纯度>98.0%):上海佳和生物科技有限公司。DMEM培养基购自Gibico公司。胰蛋白酶购自Sigma-Aldrich公司。四甲基偶氮唑盐(MTT)购自上海拜力生物科技有限公司。细胞凋亡DAPI染色试剂盒购自上海卧宏生物科技有限公司。p-IκB、NF-κB p65和磷酸甘油醛脱氢酶(GAPDH)抗体购自Sigma-Aldrich公司。Series8000 直热式CO2培养箱(美国Thermo Scientific公司)。DM IRB倒置显微镜(德国Leica仪器有限公司)。SpectraMax 190全波长酶标仪(美国Molecular Devices公司)。GelDoc 2000 伯乐凝胶成像系统(美国Bio-Rad公司)。ECL 检测系统(美国Thermo Scientific公司)。
1.2 MKN-45细胞分组及芒柄花黄素给药方法 取对数生长期人胃癌MKN-45细胞株,加入含10%胎牛血清、150 U/mL链霉素、120 U/mL青霉素的 DMEM 培养基中,37 ℃、5% CO2条件下常规培养传代。待细胞贴壁生长良好时,经胰酶消化后在96 孔板中每孔加入 200 μL细胞液。培养 24 h 后将细胞分为干预组(A、B、C组)及对照组,A、B、C组分别加入20、 40、80 μg/mL芒柄花黄素培养(浓度参照文献[9]), 对照组加入不含芒柄花黄素的完全培养基,将各组细胞置于37 ℃、5% CO2培养箱中培养,备用。
1.3 各组细胞增殖情况观测 采用MTT法。分别取给药24、48、72 h各组细胞,接种于96孔板中。每孔加入 20 μL的MTT 溶液,持续孵育4 h,吸除上清液,然后加入150 μL的DMSO,37 ℃匀速摇床15 min。采用酶标仪检测各组细胞在 490 nm 波长处的光密度值 (OD)。实验重复5次,取平均值。采用GraphPad Prism 5.0软件计算细胞增殖抑制率。细胞增殖抑制率(%)=(1-OD干预组/OD对照组)×100%。
1.4 各组细胞凋亡情况观察 采用DAPI染色法观察各组细胞凋亡情况。取给药72 h时各组细胞,吸尽培养液,用PBS漂洗5 min,之后DAPI工作液室温染色15 min, PBS漂洗5 min,水溶性封片剂封片,最后置于荧光显微镜下观察各组细胞形态学变化:早期凋亡细胞呈现核浓缩伴随染色加深,或核染色质呈新月形聚集于核膜一边;晚期的凋亡细胞则表现为核碎裂成大小不等的圆形小体,并被细胞膜所包绕,即凋亡小体。凋亡率计算方法:在200×视野下随机找5个视野观测,每个视野计数200个细胞,以平均凋亡细胞数所占百分比作为细胞凋亡率,实验重复5次,取平均值。
1.5 各组细胞磷酸化IκB(p-IκB)及NF-κB p65蛋白检测 采用Western blotting法。取给药48 h对数生长期各组细胞,采用BCA法提取细胞总蛋白。以3:1体积比与上样缓冲液混合,取20μL蛋白样品上样。PVDF膜,转膜1.5 h。含5%脱脂奶粉的PBS液封闭1 h,分别加入IκB抗体(抗体稀释度1∶500)和NF-κB p65抗体(抗体稀释度1∶500),4 ℃缓慢摇动过夜,TBST洗膜10 min×3次,加入HRP标记的山羊抗兔IgG(抗体稀释度1∶5 000)室温反应1 h,超敏化学发光法显色,凝胶分析系统分析记录条带光密度。用图像分析系统分析,以积分光密度值表示相应目的蛋白的相对表达量。实验重复3次,取平均值。
2 结果
2.1 各组细胞增殖抑制率比较 随芒柄花黄素浓度升高,细胞增殖抑制率升高,且随干预时间增加,细胞增殖抑制率升高,P均<0.05。各组细胞增殖抑制率比较见表1。
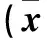
表1 不同给药时间各组细胞增殖抑制率比较±s)
注:与前一给药时间比较,#P<0.05。
2.2 各组细胞凋亡情况观察 给药72 h时A、B、C、对照组的凋亡率分别为25.62%±2.57%、48.27%±3.18%、72.51%±4.35%、1.07%±0.54%,A、B、C组与对照组相比,P均<0.05。给药72 h时对照组细胞均匀分布,结构形态完好,胞质丰富。A组细胞体积皱缩变形,核收缩并且染色加深。B、C两组细胞可见典型的细胞凋亡形态,胞核明显固缩,呈致密的颗粒状,核破碎明显。
2.3 各组细胞p-IκB及NF-κB p65蛋白相对表达量比较 给药48 h时各组细胞p-IκB及NF-κB p65蛋白相对表达量比较见表2。
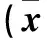
表2 给药48 h时各组细胞p-IκB及NF-κB p65蛋白相对表达量比较±s)
注:与对照组比较,*P<0.01;与A组比较,#P<0.05;与B组比较,&P<0.05。
3 讨论
芒柄花黄素是中药红三叶草的主要活性成分,在当归及黄芪中也发现了该物质,具有明显的植物雌激素特点。植物雌激素,有时也称为饮食雌激素,因为结构相似于雌激素,它们可能产生雌激素或抗雌激素作用,已有研究报道芒柄花黄素具有保护心血管[10,11]、防治骨质疏松[12]、抗肿瘤[13,14]等植物雌激素作用。芒柄花黄素可防止血管生成和癌转移,并在临床中已用于转移性结肠癌的治疗[15],还能在体内和体外通过多种途径抑制肿瘤细胞株的生长及诱导其发生凋亡,例如非小细胞肺癌、卵巢癌及骨肉瘤等[16~18],目前对于其抗肿瘤机制研究报道主要有激活p38磷酸化水平,抑制内源性Akt的磷酸化,降低细胞中Bcl-2蛋白水平及上调Bax表达,下调IGF-1/IGF-1R表达等[8,17,19]。
NF-κB是一类核转录因子,能与免疫球蛋白κ轻链基因的增强子κB序列特异结合,与癌症、炎症和自身免疫病等密切相关[20]。研究表明,NF-κB体系主要涉及机体防御反应、组织损伤和应激、细胞分化和调亡等的信息传递[21~23]。NF-κB信号通路的组成包括受体和受体近端信号接头分子、NF-κB抑制剂IκB蛋白、IκB激酶(IKK)复合物和NF-κB二聚体[21]。在细胞中NF-κB与其抑制蛋白IκB家族成员结合成三聚体,以无活性的形式存在于细胞质中,只有被激活才从细胞质转位于细胞核发挥重要作用。NF-κB通路经典途径的激活是由上游IKK介导,当细胞受到促炎症因子、病原体、氧化应激、生长因子等刺激后,会激活IKK并使IκB磷酸化,然后IκB发生自身多泛素化,并随后被蛋白酶体降解[21]。IκB降解后解离出NF-κB,活化的NF-κB释放并进入细胞核中与相应的靶序列结合可对相当多数量的基因发挥中心性转录调节作用[24,25]: NF-κB作为可诱导并普遍存在的转录因子,NF-κB能通过对肿瘤坏死因子α(TNF-α)、白细胞介素 1(IL-1)、IL-6、IL-8 和GM-CSF 等基因的诱导性调节, 参与免疫细胞的增殖、分化及所引起的免疫应答, 并起到中心调控作用。 NF-κB可通过对生长调节蛋白编码基因的转录和表达的促进作用, 对细胞增殖进行调节。④多种病毒的启动子与增强子之间都存在着NF-κB结合位点, 例如HIV、CMV 和SV40。目前,NF-κB在肿瘤细胞凋亡中的作用众说纷纭,研究[26]证实NF-κB在肿瘤的生长,细胞凋亡等方面发挥关键作用,它的激活能提高肿瘤细胞的抗凋亡能力。近年来也发现NF-κB能调控下游因素,包括Bcl-2家族、IL-8、凋亡抑制蛋白(IAPS)家族、环氧合酶2(COX-2)、人类端粒反转录酶等在胃癌发生发展过程中及肿瘤耐药中起重要作用[27]。而Ryan等[28]证实NF-κB,特别是其RelA(p65)亚基在p53介导的凋亡过程中具有重要作用-NF-κB失活或者活性降低可取消p53 诱导的凋亡。Huh等[12]认为, NF-κB p65 在胃癌早期中表达较高, NF-κB活化与淋巴浸润呈负相关, 与胃癌患者总生存率呈正相关。两种截然相反的结论, 说明NF-κB到底是诱导细胞凋亡还是抑制细胞凋亡也与多种因素有关,这也提示了我们NF-κB除了具有促癌作用还可能发挥抑癌作用。
本研究发现,芒柄花黄素对人胃癌MKN-45细胞有抑制增殖的作用,在同一时间段,随芒柄花黄素浓度升高,细胞增殖抑制率随之升高,在同一浓度,随芒柄花黄素干预时间增加,细胞增殖抑制率升高,说明芒柄花黄素对人胃癌MKN-45细胞具有时间和剂量依赖性。肿瘤细胞从良性发展成恶性的主要原因就是细胞对生长因子信号的敏感性增强,同时细胞对凋亡程序调控的信号敏感性降低。我们使用DAPI染色实验对细胞的凋亡情况进行观察,结果发现药物组的细胞凋亡率明显比对照组高,且随着药物浓度的增加,细胞凋亡率也同时增高,这说明了芒柄花黄素能诱导细胞发生凋亡而抑制细胞增殖。凋亡,又称程序性死亡,是由基因调控细胞衰老、维持机体正常运行的重要机制,由一系列细胞内外信号通路精密调控。各种凋亡信号通过信号传导通路传至细胞内,激活靶基因产生效应,引起凋亡[17]。经芒柄花黄素干预后的MKN-45细胞内p-IκB、NF-κB p65蛋白水平明显地上调,这提示芒柄花黄素激活了细胞内NF-κB 信号通路,结合MTT及DAPI染色实验结果,故我们推测芒柄花黄素激活MKN-45肿瘤细胞内NF-κB 信号通路进而诱导肿瘤细胞凋亡是其抗胃癌活性的作用机制之一。
综上所述,芒柄花黄素可抑制人胃癌MKN-45细胞株的增殖、促进细胞凋亡,其机制可能为芒柄花黄素激活NF-κB信号通路。但NF-κB如何调控下游靶基因诱导肿瘤细胞凋亡还有待进一步研究。
[1] 陈国强,梁启廉,李洲宇,等.2507例胃癌的临床分析[J].医学研究杂志,2011,40(6): 63-66.
[2] Fujitani K. Overview of adjuvant and neoadjuvant therapy for resectable gastric cancer in the East[J]. Dig Surg, 2013,30(2):119-129.
[3] Ngeow J, Tan IB, Choo SP. Targeted therapies in the treatment of gastric cancer[J]. Asia Pac J Clin Oncol,2011,7(3):224-235.
[4] Xu G, Ren G, Xu X, et al. Combination of curcumin and green tea catechins prevents dimethylhydrazine-induced colon carcinogenesis[J].Food Chem Toxicol, 2010,48(1):390-395.
[5] Nautiyal J, Banerjee S, Kanwar SS, et al. Curcumin enhances dasatinib-induced inhibition of growth and transformation of colon cancer cells[J].Int J Cancer, 2011,128(4):951-961.
[6] Martin RC, Aiyer HS, Malik D, et al. Effect on pro-inflammatory and antioxidant genes and bioavailable distribution of whole turmeric vs curcumin: Similar root but different effects [J].Food Chem Toxicol, 2012,50(2):227-231.
[7] 强正泽,王燕,王明伟,等. 土壤营养成分与红芪中毛蕊异黄酮、芒柄花素量之间的相关性研[J].中国中药杂志,2010,35(22):3060-3064.
[8] Xing Z, Ling YB, Yu Y, et al. Formononetin Induces Apoptosis in PC-3 Prostate Cancer Cells Through Enhancing the Bax/Bcl-2 Ratios and Regulating the p38/Akt Pathway[J]. Nutrition Can, 2014,66(4):656-661.
[9] 叶雨,陈健. 芒柄花黄素对超氧阴离子及羟自由基清除作用的研究[J]. 四川生理科学杂志,2012,34(2):53-55.
[10] Chun N, Ford JM. Genetic testing by cancer site: stomach[J]. Cancer J, 2012,18(4):355-363.
[11] Sun T, Wang J, Huang LH, et al. Antihypertensive effect of formononetin through regulating the expressions of eNOS, 5-HT2A/1B receptors and α1-adrenoceptors in spontaneously rat arteries[J]. Eur J Pharmacol, 2013,699(1-3):241-249.
[12] Huh HE, Seo DM, Baek YH, et al. Biphasic positive effect of formononetin on metabolic activity of human normal and osteoarthritic subchondral osteoblasts[J]. Int Immunopharmacol, 2010,10(4):500-507.
[13] Auyeung KK, Law PC, Ko JK. Novel anti-angiogenic effects of formononetin in human colon cancer cells and tumou xenograft[J]. Oncol Rep, 2012,28(6):2188-2194.
[14] Bialesova L, Brtko J, Lenko V, et al. Nuclear receptors-target molecules for isoflavones in cancer chemoprevention[J]. Gen Physiol Biophys, 2013,32(4):467-478.
[15] Auyeung KK, Law PC, Ko Jk. Novel anti-angiogenic effects of formononetin in human colon cancer cells and tumor xenograft[J].Oncol Rep, 2012,28(1-2):2188-2194.
[16] Yang Y, Zhao Y, Ai X, et al. Formononetin suppresses the proliferation of human non-small cell lungcancer through induction of cell cycle arrest and apoptosis[J]. Int J Clin Exp Pathol, 2014,7(12):8453-8461.
[17] 顾万,赵新阁,张幸.芒柄花黄素通过调节Bax和Bcl-2蛋白表达诱导SKOV3细胞凋亡[J].四川生理科学杂志,2014,36(2):60-62.
[18] Hu W, Xiao Z. Formononetin induces apoptosis of human osteosarcoma cell line U2OS by regulating the expression of Bcl-2, Bax and MiR-375 in vitro and in vivo[J]. Cell Physiol Biochem,2015,37(3):933-939.
[19] Huang WJ, Bi LY, Li ZZ, et al. Formononetin induces the mitochondrial apoptosis pathway in prostate cancer cells via downregulation of the IGF-1/IGF-1R signaling pathway[J]. Pharm Biol, 2014,52(4):466-470.
[20] 鲍国强, 章扬培.NF-κB的生物学功能[J].国外医学:分子生物学分册, 2003,25(6):345-348.
[21] Hayden MS, Ghosh S. Shared principles in NF-κB signaling[J]. Cell, 2008,132(3):344-362.
[22] Tilstra JS, Clauson CL, Niedernhofer LJ, et al. NF-κB in aging and disease[J]. Aging Dis, 2011,2(6):449-465.
[23] Niedernhofer LJ, Robbins PD. Signaling mechanisms involved in the response to genotoxic stress and regulating lifespan[J]. Int J Biochem Cell Biol, 2008,40(2):176-180.
[24] Prendes M, Zheng Y, Beg AA. Regulation of developing B cell survival by RelA -containing NF-kappa B complexes[J]. J Immunol,2003,171(8):3963-3969.
[25] 史艳晖,卢圣栋.转录因子NF-JB的研究现状及其应用前景[J].中国生物工程杂志,2007,27(4):110-104.
[26] Zerbini LF, Wang Y, Czibere A.NF_kappa B_mediated repression of growth arrestand DNA_damage_inducible proteins 45 alpha and gamma is essential for cancer cell survival[ J] .Proc Nat l Acad Sci USA, 2004,101(37):13618-136123 .
[27] 唐涛.NF-κB与胃癌关系的研究进展[J] .国际消化病杂志,2006,26(5):296-299.
[28] Ryan KM, Ernst MK, Rice NR.Role of NFKB in p53_mediated programmed cell death[ J] . Nature , 2000,404(6780):892-897.
Effects of formononetin on proliferation and apoptosis of human gastric cancer MKN-45 cells
DONGChencheng1,ZHONGLi,ZHANGGuangyu,WANGZhenran,RANFulin,CHENXiao
(1People[′sHospitalofGuangxiZhuangAutonomousRegion,Nanning530021,China)
Objective To observe the effects of formononetin on the proliferation and apoptosis of human gastric cancer MKN-45 cells and its possible mechanism. Methods The human gastric cancer MKN-45 cells in the logarithmic growth phase were divided into groups A, B, C and the control group. Cells in the groups A, B and C were cultured and the culture medium was added with 20, 40 and 80 μg/mL of formononetin, respectively. The control group was not treated. The cell proliferation of MKN-45 cells was detected by MTT assay at 24, 48 and 72 h of formononetin treatment, and the growth inhibitory rate of MKN-45 cells was assessed. The effect of formononetin on morphological changes was evaluated using DAPI staining. The intracellular phosphorylated IκB (p-IκB) and NF-κB p65 protein expression was measured by Western blotting.Results MKN-45 cell proliferation was inhibited after being treated by formononetin with a time- and dose-dependent manner (allP<0.05). The apoptosis rates of groups A, B, C and the control group after 72-hour treatment were 25.62%±2.57%, 48.27%±3.18%, 72.51%±4.35% and 1.07%±0.54%, respectively (allP<0.05). The expression of p-IκB and NF-κB p65 protein in cells of groups A, B and C was significantly higher than that of the control group at 48 h after administration with a dose-dependent manner (allP<0.05).Conclusion Formononetin inhibits cell proliferation and induces apoptosis of MKN-45 cells, and the possible mechanism may be related to activation of NF-κB signaling pathway.
formononetin; gastric carcinoma; stomach neoplasms; cell proliferation; apoptosis
广西高校科学技术研究项目(LX2014270)。
董陈诚(1981-),男,医学硕士,副主任医师,主要研究方向为胃肠肿瘤外科。E-mail: 18282556@qq.com
钟漓(1969-),男,医学硕士,副主任医师,主要研究方向为胃肠肿瘤外科。E-mail: zhongli0302@163.com
10.3969/j.issn.1002-266X.2017.07.002
R735.2
A
1002-266X(2017)07-0005-04
2016-09-11)
