食管间质成纤维细胞在裸鼠食管癌种植瘤形成中的作用
2017-03-13徐志彬郑秀丽吴明利王士杰袁丽
徐志彬,郑秀丽,吴明利,王士杰,袁丽
(河北医科大学第四医院,石家庄050011)
食管间质成纤维细胞在裸鼠食管癌种植瘤形成中的作用
徐志彬,郑秀丽,吴明利,王士杰,袁丽
(河北医科大学第四医院,石家庄050011)
目的 探讨不同病变阶段食管间质成纤维细胞对裸鼠食管癌种植瘤形成的影响。方法 从人正常食管组织、食管癌前病变组织、食管癌组织中分离、培养正常食管间质成纤维细胞(NFs)、食管不典型增生间质成纤维细胞(AFs)和食管癌相关纤维母细胞(CAFs),并与食管癌细胞ECa109按1∶1混合。选择裸鼠80只,随机分为ECa109组、NFs+ECa109组、AFs+ECa109组、CAFs+ECa109组,每组20只。分别于裸鼠右肩胛皮下接种ECa109、NFs+ECa109、AFs+ECa109、CAFs+ECa109。比较四组成瘤率、成瘤时间以及肿瘤组织α-SMA、PCNA阳性染色情况和肿瘤间质微血管密度(MVD)。结果 成瘤率:NFs+ECa109组、AFs+ECa109组、CAFs+ECa109组均为100%,ECa109组为80%。成瘤时间:AFs+ECa109组、CAFs+ECa109组明显短于ECa109组、NFs+ECa109组(P均<0.05),而AFs+ECa109组与CAFs+ECa109组、ECa109组与NFs+ECa109组比较差异均无统计学意义(P均>0.05)。α-SMA染色:ECa109组为弱阳性,NFs+ECa109组、AFs+ECa109组、CAFs+ECa109组均为强阳性。PCNA阳性表达率:四组均为100%。MVD:AFs+ECa109组、CAFs+ECa109组明显多于ECa109组、NFs+ECa109组(P均<0.05),AFs+ECa109组与CAFs+ECa109组、ECa109组与NFs+ECa109组比较差异均无统计学意义(P均>0.05)。结论 食管间质成纤维细胞与食管癌的发生和发展密切相关,其表型发生改变的AFs和CAFs促癌作用更强。
食管癌;种植瘤;成纤维细胞;裸鼠
在肿瘤-宿主界面微环境中的成纤维细胞具有独特的生物学功能,在肿瘤微血管的形成和发展、肿瘤生长、侵袭过程中扮演重要角色[1~5]。研究证实,在癌组织微环境中存在癌相关纤维母细胞(CAFs),与正常间质成纤维细胞(NFs)的生物学特性明显不同[6~8]。本课题组前期研究发现,在食管癌前病变组织中存在不典型增生间质成纤维细胞(AFs),其表型与NFs明显不同,与CAFs趋向一致[9]。为研究这3种食管间质成纤维细胞的生物学特性,2014年3~12月,我们观察了NFs、AFs、CAFs在裸鼠食管癌种植瘤形成中的作用。现分析结果并报告如下。
1 材料与方法
1.1 材料 人食管癌细胞株ECa109,购自中国科学院细胞中心。人食管间质成纤维细胞分别取自我院胸外科手术切除或内镜下黏膜剥离的正常食管组织、食管癌前病变组织及食管癌组织,经分离、培养、纯化后获得NFs、AFs、CAFs,冻存于我院实验动物中心。雄性BALB/c裸鼠80只,4~6周龄,体质量17~20 g,购自北京华阜康生物科技股份有限公司。所有裸鼠在我院实验动物中心SPF条件下饲养;所需垫料、饲料和饮水经灭菌处理,高效过滤器换气10~15次/h,相对湿度46%~60%,每日保持10 h光照、14 h无光的阴暗周期。α平滑肌肌动蛋白(α-SMA)鼠抗人单克隆抗体、增殖细胞核抗原(PCNA)鼠抗人单克隆抗体及CD34大鼠抗小鼠单克隆抗体均购自北京西雅金桥生物技术有限公司。樱花全自动组织包埋机,日本樱花公司;RM2135型切片机,德国Leica公司;CS-Ⅵ型摊片烤片机,孝感市宏业医用仪器有限公司;BX光学显微镜,日本奥林巴斯公司;尼康Nikon显微照相机,日本Nikon公司。
1.2 动物分组及处理 采用DMEM/F12培养基分别培养NFs、AFs、CAFs和ECa109细胞,于对数生长期消化细胞并计数;PBS洗涤后悬浮于PBS中,3种成纤维细胞与癌细胞分别按1∶1混合(细胞密度为1×107个/mL)备用,另取悬浮ECa109细胞5×106个/mL备用。随机将80只裸鼠分为ECa109组、NFs+ECa109组、AFs+ECa109组、CAFs+ECa109组,每组20只。ECa109组、NFs+ECa109组、AFs+ECa109组、CAFs+ECa109组分别于裸鼠右肩胛皮下接种ECa109、NFs+ECa109、AFs+ECa109和CAFs+ECa109混悬液1 mL。
1.3 相关指标观察
1.3.1 成瘤时间及瘤体体积 记录四组接种后的成瘤时间,以瘤体直径达到3 mm为成瘤标准。于接种第2、4、6周末用游标卡尺测量肿瘤长径(a)、短径(b),计算瘤体体积(V)。V=a×b2/2。
1.3.2 种植瘤形态学观察 裸鼠自然死亡或种植8周末头颈离断后,完整剥离瘤体,观察肿瘤形态。剖开瘤体,取部分肿瘤组织,甲醛固定,常规石蜡包埋,4 μm厚切片。二甲苯脱蜡,梯度乙醇脱水,蒸馏水冲洗2 min。苏木素染色5 min,自来水冲洗。盐酸乙醇分化30 s。自来水浸泡15 min或温水(约50 ℃)浸泡5 min。伊红染色2 min。常规脱水,透明,中性树胶封片。光镜下观察病理形态变化。
1.3.3 瘤组织α-SMA、PCNA表达 取上述石蜡切片,贴附于APES处理过的载玻片上,置于烤箱内60 ℃烤片10 min。二甲苯脱蜡,梯度乙醇脱水,流水冲洗。将脱蜡水化后的组织切片置于缓冲液中煮沸处理,0.3% H2O2甲醇液阻断内源性过氧化物酶活性,室温孵育10 min,滴加50 μL非免疫性动物血清,室温孵育20 min。然后滴加50 μL一抗,4 ℃冰箱过夜。PBS冲洗,滴加二抗。DAB显色,苏木素复染,乙醇脱水,二甲苯中性树胶封片,显微镜下观察。按照王立峰等[10]的标准:α-SMA阳性染色定位于间质成纤维细胞胞质,呈棕黄色颗粒。随机选取5个高倍镜(×400)视野,根据阳性染色范围:无阳性染色为-,局灶阳性(阳性染色细胞团簇状但面积不大)为+,弥漫阳性(广泛阳性染色细胞)为++。PCNA阳性染色定位于间质成纤维细胞胞质及胞膜,呈棕黄色颗粒。随机在染色均匀区域选取5个高倍镜(×400)视野,阳性细胞所占比例<1/3为阴性表达、≥1/3为阳性表达。
1.3.4 微血管密度(MVD)观察 采用链霉素抗生物素蛋白-过氧化物酶连接(SP)法。取裸鼠种植瘤组织,石蜡包埋后切片,行HE染色。石蜡切片→常规脱蜡至水→抗原修复→3% H2O2阻断内源性过氧化物酶活性→山羊血清封闭→滴加一抗、二抗及链霉素、SP复合物→DAB显色→复染封片。参照Maeda等[11]的方法,先在100倍视野下寻找CD34阳性染色的微血管高密度区,即热点区。然后在400倍视野下,计数MVD。凡与周围细胞或结缔组织成分有明显区别的单个内皮细胞或内皮细胞簇作为一个微血管;管腔直径>8个红细胞或肌层较厚的血管均不计数。记录3个高倍镜(×400)视野下的微血管数,取平均值作为每例的MVD。

2 结果
2.1 各组成瘤时间及瘤体体积比较 种植第2周,NFs+ECa109组、AFs+ECa109组、CAFs+ECa109组均种瘤成功,成瘤率为100%,以CAFs+ECa109组成瘤时间最短;种植第3周,ECa109组才见肿瘤形成,成瘤率为80%。各组癌细胞种植6周内,裸鼠生长状态良好,体质量持续增加;种植8周初,裸鼠情绪焦躁,食欲不佳,体质量不再增加,甚至会下降;种植8周末,部分裸鼠自然死亡。具体结果见表1。
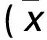
表1 各组成瘤时间及瘤体体积比较±s)
注:与ECa109组比较,*P<0.05。
2.2 各组肿瘤形态观察 肉眼观察,肿瘤形态接近于球形,外被包膜,局部可见结节,质韧,表面可见血管,肿瘤外缘为实性呈灰白色,肿瘤中间大片状出血坏死,呈暗紫红色,部分肿瘤可见脓腔。光镜下观察,ECa109组肿瘤细胞主要分布在肿瘤边缘,肿瘤中央区为大片红色絮状坏死物,在肿瘤细胞团中可见红色角化珠,在肿瘤团边缘可见少许成纤维细胞;NFs+ECa109组、AFs+ECa109组、CAFs+ECa109组在成团的肿瘤细胞间可见大量纤维组织,纤维组织呈条束状分布。
2.3 各组瘤组织α-SMA、PCNA阳性表达及肿瘤MVD比较 ECa109组α-SMA染色为局灶阳性。而NFs+ECa109组、AFs+ECa109组、CAFs+ECa109组α-SMA染色均为弥漫阳性。四组PCNA阳性表达率均为100%。ECa109组、NFs+ECa109组、AFs+ECa109组、CAFs+ECa109组MVD分别(5.3±0.31)、(15.4±0.22)、(17.1±0.42)、(20.2±0.28)条,AFs+ECa109组、CAFs+ECa109组明显多于ECa109组、NFs+ECa109组(P均<0.05),AFs+ECa109组与CAFs+ECa109组、ECa109组与NFs+ECa109组比较差异均无统计学意义(P均>0.05)。
3 讨论
食管癌的发生是一个多阶段的病理过程,历经炎症和癌前病变,再到原位癌,直至进展期癌。在这一过程中将病变阻抑至癌前病变阶段,甚至逆转,可预防食管癌的发生。以往研究发现,在食管病变不同的发展阶段,NFs、AFs和CAFs的形态及生物学特性具有明显差异[12]。但其在肿瘤发生和发展过程中的作用尚未明确。
研究证实,肿瘤间质微环境在肿瘤进展过程中具有重要作用。CAFs是肿瘤间质微环境的重要成分。有研究发现,CAFs具有强大的内分泌功能,可分泌血管内皮生长因子(VEGF)、肝细胞生长因子(HGF)、基质细胞衍生因子1等多种细胞因子和生长因子,作用于内皮细胞表面的受体,促进内皮细胞募集、增殖、迁移,参与内皮细胞活化及肿瘤血管生成等过程[13]。本研究结果显示,AFs+ECa109组和CAFs+ECa109组成瘤时间较ECa109组、NFs+ECa109组明显缩短,而AFs+ECa109组与CAFs+ECa109组、ECa109组与NFs+ECa109组成瘤时间比较均无统计学差异,说明活化的间质成纤维细胞AFs和CAFs均可促进癌细胞的分裂和增殖。NFs+ECa109组、AFs+ECa109组、CAFs+ECa109组成瘤率高于ECa109组,且这3组瘤体体积增长速度均明显快于ECa109组,尤其是在成瘤4周后。种植瘤形态学观察发现,AFs+ECa109组和CAFs+ECa109组肿瘤间质内可见较多成纤维细胞和新生血管,较NFs+ECa109组和ECa109组明显增多,说明恶变的间质成纤维细胞可促进肿瘤血管生成,在肿瘤快速生长过程中起到至关重要的作用。
在正常状态下,成纤维细胞处于非激活-静止状态,其表型为α-SMA阴性表达。而在许多肿瘤中,处于活化状态的CAFs表型为α-SMA阳性表达[14]。PCNA可反映细胞增殖活性,其阳性表达表明癌细胞为高活动期[15]。瘤体的增长离不开充足的血供,肿瘤MVD可反映肿瘤的血供情况。Micke等[16]将CAFs与肿瘤细胞混合后注射于小鼠体内,发现实验组MVD较对照组MVD明显增多,实验组成瘤时间短于对照组成瘤时间。本研究结果显示,NFs+ECa109组α-SMA染色原为阴性表达,而在肿瘤形成后,其表型转变为α-SMA阳性表达。说明在肿瘤形成过程中,食管癌细胞可作用于正常的食管间质成纤维细胞,使NFs表型发生活化而转变为α-SMA阳性表达的CAFs,这一改变可能与食管癌细胞分泌的细胞因子有关,如TGF-β。本研究四组PCNA阳性表达率均为100%,但NFs+ECa109组、AFs+ECa109组、CAFs+ECa109组PCNA染色强度是逐渐增强的,提示活化的间质成纤维细胞可能会刺激癌细胞的增殖分裂。本研究还发现,AFs+ECa109组与CAFs+ECa109组MVD较ECa109组、NFs+ECa109组明显增多,这是实验后期AFs+ECa109组、CAFs+ECa109组瘤体增长速度较ECa109组、NFs+ECa109组明显加快的原因,提示间质成纤维细胞能为癌细胞提供适宜生长的微环境,成纤维细胞旁分泌的生长因子(如TGF-β1、HGF等)在刺激肿瘤细胞分裂增殖的同时,能直接或间接刺激肿瘤细胞表达VEGF[17],从而促进微血管生成,为肿瘤细胞的生长提供氧和营养。虽然有学者提出,NFs能够抑制恶变上皮细胞的增殖,但本研究初期瘤体增长缓慢,一旦恶变的上皮细胞诱导NFs发生恶变而活化,二者之间形成正反馈促进增殖环节后,恶变的间质成纤维细胞能加速肿瘤的生长、浸润和转移。
综上所述,食管癌细胞可能通过直接接触NFs,诱导其表型发生转变而活化;活化后的间质成纤维细胞可分泌大量的细胞因子、生长因子,促进肿瘤微环境的形成,有利于肿瘤细胞增殖,直接或间接诱导肿瘤血管生成,为肿瘤的生长提供充足的营养。
[1] 房丽君,李剑.来源于间充质干细胞的CAFs促进肿瘤生长[J].基础医学与临床,2014,34(10):1442-1445.
[2] Berdiel-Acer M, Sanz-Pamplona R, Calon A, et al. Differences between CAFs and their paired NCF from adjacent colonic mucosa reveal functional heterogeneity of CAFs, providing prognostic information[J]. Mol Oncol, 2014,8(7):1290-1305.
[3] Pupo M, Vivacqua A, Perrotta I, et al. The nuclear localization signal is required for nuclear GPER translocation and function in breast cancer-associated fibroblasts (CAFs)[J]. Mol Cell Endocrinol, 2013,376(1-2):23-32.
[4] Luo H, Tu G, Liu Z, et al. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression[J]. Cancer Lett, 2015,361(2):155-163.
[5] Taddei ML, Giannoni E, Comito G, et al. Microenvironment and tumor cell plasticity: an easy way out[J]. Cancer Lett, 2013,341(1):80-96.
[6] 高海,吕常帅,王金申.CAFs在胃癌组织中的表达及与临床病理特征的关系[J].中国现代普通外科进展,2012,15(10):796-799.
[7] 李崖青,李帅,刘芳芳,等.癌相关肌纤维母细胞与乳腺癌的研究进展[J].中华病理学杂志,2012,41(2):142-144.
[8] 蔡伟,康骅,刘晨,等.CAFs对乳腺癌细胞生物学特性的影响及机制探讨[J].现代肿瘤医学,2014,22(6):1249-1253.
[9] 曾伟伟,吴明利,徐志彬,等.食管鳞状上皮癌变过程中间质纤维母细胞的平滑肌肌动蛋白α和CD34表达及意义[J].临床荟萃,2011,26(22):1955-1960.
[10] 王立峰,王瑞芬,郝兆星,等.胃癌中肿瘤相关纤维母细胞蛋白表达改变及意义[J].世界华人消化杂志,2007,15(20):2263-2267.
[11] Maeda K, Chung YS, Ogawa Y, et al. Prognostic value of vascular endothelial growth factor expression in gastric carcinoma[J]. Cancer, 1996,77(5):858-863.
[12] 徐志彬,袁丽,郑秀丽,等.食管癌前病变组织间质成纤维细胞的形态变化及生物学特征[J].山东医药,2016,56(40):32-35.
[13] 肖光,熊小亮,罗达亚,等.非小细胞肺癌中TGF-β1与肿瘤相关纤维母细胞α-SMA及CD34表达的相关性和意义[J].广东医学,2011,32(14):1866-1869.
[14] 赵晶洁,李建华,王洪,等.乳腺癌中α-SMA蛋白与MMP3蛋白的表达及其生物学行为[J].临床与实验病理学杂志,2015,31(5):584-586.
[15] Bradley WH, Lima PH, Rodgers L, et al. Endometrial carcinoma expresses an increased cathepsin B/D ratio[J]. Gynecol Oncol, 2008,108(1):84-89.
[16] Micke P, Ostman A. Tumor-stoma interaction:cancer-associated fibroblasts as novel targets in anti-cancer therapy[J]. Lung Cancer, 2004,45(Suppl 2):163-175.
[17] 徐丽南,姚志成,陈淑琴,等.肿瘤相关成纤维细胞培养液上清促进肿瘤细胞增殖和血管生成的研究[J].中华实验外科杂志,2012,29(6):1167-1169.
河北省医学科学研究重点课题计划(20160656)。
王士杰(E-mail: xzblxh@sina.com)
10.3969/j.issn.1002-266X.2017.08.010
R735.1
A
1002-266X(2017)08-0035-04
2015-11-09)
