2型糖尿病合并肝癌患者癌组织RAGE、MKK7、JNK1表达变化及意义
2017-03-13蒙丽恒黄耀徐梦婕周嘉李励秦映芬
蒙丽恒,黄耀,徐梦婕,周嘉,李励,秦映芬
(广西医科大学第一附属医院,南宁530021)
·论著·
2型糖尿病合并肝癌患者癌组织RAGE、MKK7、JNK1表达变化及意义
蒙丽恒,黄耀,徐梦婕,周嘉,李励,秦映芬
(广西医科大学第一附属医院,南宁530021)
目的 探讨晚期糖基化终末产物受体(RAGE)、丝裂原活化蛋白激酶激酶7(MKK7)及c-Jun氨基末端蛋白激酶1(JNK1)在2型糖尿病合并肝细胞癌(简称肝癌)患者癌组织中的表达及意义。方法 选择2型糖尿病合并肝癌患者18例(DMHC组)、单纯肝癌患者30例(HCC组),取两组手术切除的癌组织及相应的癌旁正常组织,采用Western blotting法检测其RAGE、MKK7及JNK1表达;分析两组癌组织RAGE、MKK7、JNK1表达与患者临床病理参数的关系,以及三者的相互关系。结果 DMHC组和HCC组癌组织RAGE、MKK7、JNK1的相对表达量均高于相应的癌旁正常组织(P均<0.05),且DMHC组癌组织MKK7、JNK1的相对表达量均高于HCC组癌组织(P均<0.05)。HCC组低分化者RAGE、MKK7、JNK1的相对表达量均高于高分化者,DMHC组低分化者MKK7、JNK1的相对表达量均高于高分化者(P均<0.05)。DMHC组和HCC组癌组织RAGE、MKK7、JNK1表达均呈正相关(P均<0.05)。结论 RAGE表达升高可能参与肝癌的发生、发展;2型糖尿病患者MKK7、JNK1表达升高可能促进肝癌的发生、发展;MKK7和JNK1可能在一定水平上受RAGE的调控。
肝癌;糖尿病,2型;晚期糖基化终末产物受体;丝裂原活化蛋白激酶激酶7;c-Jun氨基末端蛋白激酶1
既往研究表明,晚期糖基化终末产物(AGEs)及其受体(RAGE)共同参与肝脏胰岛素抵抗及糖尿病慢性并发症的发生[1]。RAGE在人肝细胞癌(简称肝癌)组织中过表达,且与肝癌的组织学分级密切相关[2]。有研究发现,糖尿病大鼠肝组织RAGE mRNA表达明显升高[3]。但目前关于2型糖尿病合并肝癌患者癌组织RAGE mRNA的表达鲜见报道。丝裂原活化蛋白激酶激酶7(MKK7)、c-Jun氨基末端蛋白激酶(JNK)在肝癌的发生、发展过程中扮演重要角色[4,5]。RAGE可激活MKK7、JNK,而MKK7是JNK的特异性活化因子,JNK1为JNK的编码基因之一。因此推测,RAGE-MKK7-JNK1信号通路系统可能参与2型糖尿病患者肝癌的发生、发展。2013年7月~2014年10月,我们观察了2型糖尿病合并肝癌患者癌组织RAGE、MKK7、JNK1表达,现分析结果,并初步探讨RAGE-MKK7-JNK1信号通路在2型糖尿病合并肝癌发生、发展中的作用。
1 资料与方法
1.1 临床资料 选择同期广西医科大学第一附属医院收治的2型糖尿病合并肝癌患者18例(DMHC组),男17例、女1例,年龄(56.80±14.08)岁。糖尿病均符合1999年WHO制定的诊断标准[6],糖尿病病程(5.59±1.39)年。18例患者均行肝癌手术治疗,术后组织病理证实为肝癌,组织分化程度(Edmondson-Steiner分级法):高分化13例、低分化5例,有远处转移倾向4例,HBsAg阳性14例。同期另选单纯肝癌患者30例(HCC组),男28例、女2例,年龄(53.4±13.22)岁,术后病理证实诊断,组织分化程度:高分化23例、低分化7例,有远处转移倾向12例,HBsAg阳性26例。排除标准:①存在丙或丁型肝炎病毒、人类免疫缺陷病毒感染,自身免疫性肝炎、原发性胆汁性肝硬化、原发性硬化性胆管炎,药物或其他毒性物质引起的肝功能损害及终末期肾功能衰竭者;②存在其他恶性肿瘤者,使用免疫调节药物及过去3个月内接受放化疗者;③重度饮酒(男性>80 g/d,女性>40 g/d)超过10年者。两组除糖尿病相关资料外,其余基本资料具有可比性。本研究经医院伦理委员会批准,患者均知情同意。
1.2 肝癌组织及癌旁正常组织RAGE、MKK7、JNK1表达检测 采用Western blotting法。取两组手术切除的肝癌组织及相应的癌旁正常组织(距肿瘤边缘>2 cm),RIPA-PMSF充分匀浆,4 ℃ 10 000 r/min离心15 min,取上清。BCA法检测蛋白浓度合格后,加入上样缓冲液,95 ℃水浴5 min;取蛋白50 μg行SDS-PAGE电泳(10%分离胶+5%浓缩胶),当蛋白跑至浓缩胶与分离胶交界时,将电压由80 mV调至100 mV;当蛋白电泳跑至分离胶底部时,停止电泳;采用半干转膜仪将蛋白转印至PVDF膜上,用5%封闭液封闭2 h;RAGE、MKK7和JNK1一抗孵育2 h,4 ℃冰箱过夜,TBST洗膜3次,每次10 min;Licor荧光二抗室温避光孵育1 h;TBST洗膜3次,每次10 min;应用Odyssey红外扫膜仪扫膜显影,以GAPDH为内参照。采用Quantity One图像分析软件对蛋白电泳条带的灰度值定量分析,计算目的蛋白的相对表达量。目的蛋白的相对表达量=目的蛋白灰度值/GADPH内参灰度值。

2 结果
2.1 两组癌组织及癌旁正常组织RAGE、MKK7、JNK1表达比较 见表1。

表1 两组癌组织及癌旁正常组织RAGE、MKK7、JNK1相对表达量比较
注:与同组癌旁正常组织比较,*P<0.01;与HCC组癌组织比较,#P<0.05。
2.2 两组RAGE、MKK7、JNK1表达与患者临床病理参数的关系 见表2、3。
2.3 两组RAGE、MKK7、JNK1表达的相关性分析 DMHC组、HCC组癌组织RAGE与MKK7表达均呈正相关(r分别为0.758、0.592,P均<0.01),RAGE与JNK1表达均呈正相关(r分别为0.566、 0.461,P均<0.05), MKK7与JNK1表达均呈正相关(r分别为0.788、0.545,P<0.01)。
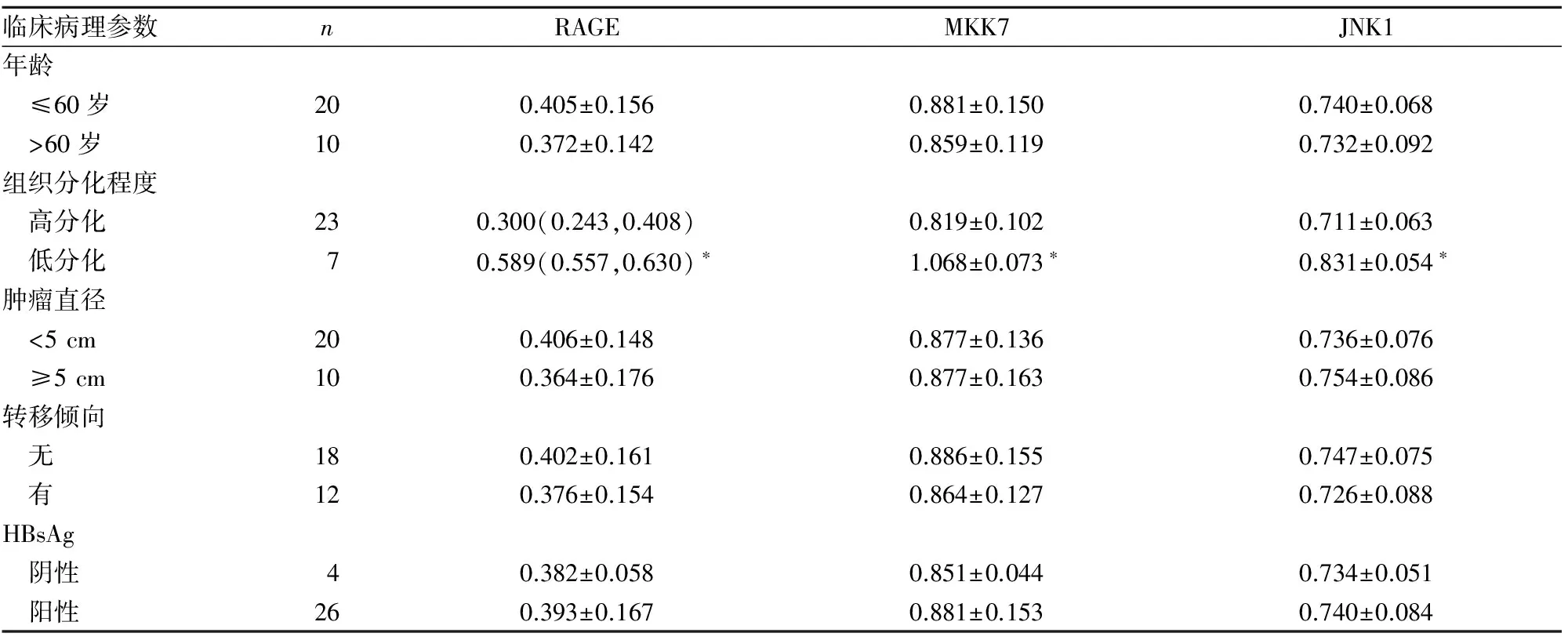
表2 HCC组癌组织RAGE、MKK7、JNK1的相对表达量与患者临床病理参数的关系
注:与高分化比较,*P<0.01。
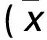
表3 DMHC组癌组织RAGE、MKK7、JNK1的相对表达量与患者临床病理参数的关系±s)
注:与高分化比较,*P<0.01。
3 讨论
近年来,糖尿病和原发性肝癌的关系成为临床研究的热点。Singh等[7]研究发现,糖尿病是原发性肝癌的独立危险因素,糖尿病合并肝癌的发生率高达32.7%[8]。2009年美国糖尿病协会和美国癌症协会《糖尿病和癌症共识报告》亦指出,2型糖尿病可增加肝癌的发病风险[9]。研究发现,糖尿病患者肝癌的发病率、复发率和病死率均高于非糖尿病患者,但其机制目前尚不十分清楚[10,11]。肝癌患者一般有慢性肝炎、肝硬化史,而慢性炎症可导致肝脏胰岛素抵抗;胰岛素抵抗反过来亦可促进肝脏炎症的发展并影响其转归[12]。有研究发现,AGEs、RAGE共同参与肝脏胰岛素抵抗及糖尿病慢性并发症的发生[1,2],而MKK7、JNK亦参与肝脏胰岛素抵抗[13]。AGEs/RAGE可触发活化促分裂原活化蛋白激酶(MAPK)信号转导通路[14],而MKK7和JNK均为MAPK家族成员,MKK7可特异性激活JNKs,其中JNK1为JNK的编码基因之一[15]。AGEs/RAGE在细胞增殖、分化、凋亡和肿瘤发生等生物学效应中扮演重要角色。有研究发现,RAGE可促进肝癌的发生、发展,而MKK7、JNK在肝癌的发生、发展中亦具有重要作用[4,5]。但RAGE-MKK7-JNK1信号通路在高血糖状态下肝癌组织中的表达目前研究甚少,且该通路蛋白的表达变化与2型糖尿病合并肝癌的关系尚不清楚。
本研究结果发现,DMHC组、HCC组肝癌组织RAGE的相对表达量均较相应癌旁正常组织明显升高,与Hiwatashi等[16]研究结果基本一致。与HCC组比较,DMHC组RAGE的相对表达量虽有上升趋势,但差异并无统计学意义。其原因可能为DMHC组均予药物控制血糖,血糖并非长期处于高值,AGEs积累量并未显著增加,因而RAGE增加不明显;高血糖可能不是促进肝癌发生、发展的主要因素,而脂代谢紊乱、非酒精性脂肪性肝病[17]、肝脏胰岛素抵抗[18]等可能亦与肝癌的发生、发展有关;样本量偏小等。
肿瘤组织分化程度与其复发、转移密切相关,组织分化程度越低,其复发及转移倾向越高,即恶性程度越高。本研究发现,HCC组低分化者RAGE的相对表达量显著高于高分化者,与Ito等[19]研究结果基本一致,提示RAGE在肝癌发生、发展过程中可能具有重要作用;而DMHC组低分化者RAGE的相对表达量虽高于高分化者,但并无统计学差异,说明RAGE在2型糖尿病患者肝癌的发生、发展中并无决定性作用。但本研究HCC组RAGE的相对表达量随肝癌组织分化程度逐渐降低而逐渐增加,故推测DMHC组RAGE表达与肝癌组织分化程度有关。但由于入组病例较少,各病理分级的分布不均衡也可能出现偏倚。
本研究DMHC组、HCC组癌组织MKK7、JNK1的相对表达量均高于相应的癌旁正常组织,且DMHC组高于HCC组,这可能是导致2型糖尿病合并肝癌生物学特性不同于单纯性肝癌的原因之一。DMHC组和HCC组低分化者MKK7、JNK1的相对表达量均高于高分化者,表明MKK7/JNK信号传导途径可能与肝癌的组织分化程度相关;而DMHC组MKK7、JNK1的相对表达量高于HCC组,提示MKK7及JNK1参与了2型糖尿病患者肝癌的发生及维持。因此,MKK7、JNK1可能是肝癌的致癌因子,其高表达可促进2型糖尿病患者肝癌的发生、发展。本研究还发现,无论是DMHC组还是HCC组,RAGE、MKK7、JNK1的相对表达量均与患者年龄、肿瘤直径、转移倾向以及HBsAg无关,说明不论肝癌患者是否处于2型糖尿病状态,其年龄、肿瘤直径、转移倾向及HBsAg不影响RAGE、NKK7及JNK1的相对表达量。本研究结果发现,两组RAGE、MKK7、JNK1的相对表达量均呈正相关,表明三者在肝癌的发生、发展中关系密切,2型糖尿病状态下MKK7、JNK1的表达可能在一定程度上受RAGE调控。Guo等[4]研究发现,RACK1通过增加MKK7活性使JNK的活性增强,继而促进肝癌的发生、发展,考虑到RAGE作为信号转导受体在细胞表面可与其他配体(如Rac1/Cdc42、NF-κB、p38MAPK)结合,参与肿瘤的生长和转移,故不排除在糖尿病状态下通过其他配体信号通路激活MKK7/JNK1,导致2型糖尿病合并肝癌的发生率、复发率和病死率升高。
综上所述,RAGE表达升高可能参与肝癌的发生、发展;2型糖尿病患者MKK7、JNK1表达升高可能促进肝癌的发生、发展;MKK7和JNK1可能在一定水平上受RAGE的调控。
[1] Wu CH, Huang HW, Huang SM, et al. AGE-induced interference of glucose uptake and transport as a possible cause of insulin resistance in adipocytes[J]. J Agric Food Chem, 2011,59(14):7978-7984.
[2] Miura K, Kitahara Y, Kajioka T, et al. Combination therapy with nateglinide and telmisartan ameliorates insulin resistance in zucker fatty rats by suppressing advanced glycation end product receptor axis[J]. Horm Metab Res, 2011,43(3):226-228.
[3] Yang Y, Zhao LH, Huang B, et al. Pioglitazone, a PPARγ agonist, inhibits growth and invasion of human hepatocellular carcinoma via blockade of the rage signaling[J]. Mol Carcinog, 2015,54(12):1584-1595.
[4] Guo Y, Wang W, Wang J, et al. Receptor for activated C kinase 1 promotes hepatocellular carcinoma growth by enhancing mitogen-activated protein kinase kinase 7 activity[J]. Hepatology, 2013,57(1):140-151.
[5] Seki E, Brenner DA, Karin M. A liver full of JNK: signaling in regulation of cell function and disease pathogenesis, and clinical approaches[J]. Gastroenterology, 2012,143(2):307-320.
[6] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J].中国糖尿病杂志,2014,30(8):26-89.
[7] Singh S, Singh PP, Singh AG, et al. Anti-diabetic medications and the risk of hepatocellular cancer: a systematic review and meta-analysis[J]. Am J Gastroenterol, 2013,108(6):881-891.
[8] Nagaoki Y, Hyogo H, Aikata H, et al. Recent trend of clinical features in patients with hepatocellular carcinoma[J]. Hepatol Res, 2012,42(4):368-375.
[9] Giovannucci E, Harlan DM, Archer MC, et al. Diabetes and cancer: a consensus report[J]. Diabetes Care, 2010,33(7):1674-1685.
[10] Ikeda Y, Shimada M, Hasegawa H, et al. Prognosis of hepatocellular carcinoma with diabetes mellitus after hepatic resection[J]. Hepatology, 1998,27(6):1567-1571.
[11] Hosokawa T, Kurosaki M, Tsuchiya K, et al. Hyperglycemia is a significant prognostic factor of hepatocellular carcinoma after curative therapy[J]. World J Gastroenterol, 2013,19(2):249-257.
[12] Lomonaco R, Ortiz-Lopez C, Orsak B, et al. Effect of adipose tissue insulin resistance on metabolic parameters and liver histology in obese patients with nonalcoholic fatty liver disease[J]. Hepatology, 2012,55(5):1389-1397.
[13] Wei Y, Wang D, Moran G, et al. Fructose-induced stress signaling in the liver involves methylglyoxal[J]. Nutr Metab (Lond), 2013,10(32):1-8.
[14] Rasheed Z, Haqqi TM. Endoplasmic reticulum stress induces the expression of COX-2 through activation of eiF2α, p38-MAPK and NF-κB in advanced glycation end products stimulated human chondrocytes[J]. Biochim Biophys Acta, 2012,1823(12):2179-2189.
[15] Tournier C. The 2 faces of JNK signaling in cancer[J]. Genes Cancer, 2013,4(9-10):397-400.
[16] Hiwatashi K, Ueno S, Abeyama K, et al. A novel function of the receptor for advanced glycation end-products (RAGE) in association with tumorigenesis and tumor differentiation of HCC[J]. Ann Surg Oncol, 2008,15(3):923-933.
[17] Rinella ME. Nonalcoholic fatty liver disease: a systematic review[J]. JAMA, 2015,313(22):2263-2273.
[18] Goossens N, Negro F. Insulin resistance, non-alcoholic fatty liver disease and hepatitis C virus infection[J]. Rev Recent Clin Trials, 2014,9(3):204-209.
[19] Ito R, Ishii Y, Wakiyama S, et al. Prognostic significance of receptor for advanced glycation end products expression in hepatocellular carcinoma after hepatectomy[J]. J Surg Res, 2014,192(2):503-508.
Expression of RAGE, MKK7 and JNK1 in patients with type 2 diabetes mellitus complicated with hepatocellular carcinoma
MENGLiheng,HUANGYao,XUMengjie,ZHOUJia,LILi,QINYingfen
(TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530031,China)
Objective To investigate the expression and significance of receptor for advanced glycation end products (RAGE), mitogen-activated protein kinase kinase 7 (MKK7) and c-Jun N-terminal protein kinase 1 (JNK1) in patients with type 2 diabetes mellitus complicated with hepatocellular carcinoma. Methods The resected cancer tissues and corresponding normal tissues were obtained from 18 patients with type 2 diabetes mellitus complicated with hepatocellular carcinoma (DMHC group) and 30 patients with simple hepatocellular carcinoma (HCC group). The expression of RAGE, MKK7 and JNK1 was detected by Western blotting. The relationships of RAGE, MKK7 and JNK1 expression in the two groups with the clinical and pathological parameters of the patients were analyzed as well as the relationship among RAGE, MKK7 and JNK1. Results The expression levels of RAGE, MKK7 and JNK1 were higher in the cancer tissues of both DMHC and HCC groups than those in their corresponding adjacent normal tissues (allP<0.05). Compared with the HCC group, MKK7 and JNK1 expression in the cancer tissues of the DMHC group was higher (allP<0.05). In the HCC group, the relative expression levels of RAGE, MKK7 and JNK1 in patients with poor differentiation were higher than those in patients with high differentiation, and in the DMHC group, the relative expression levels of MKK7 and JNK1 in patients with poor differentiation were higher than those in patients with high differentiation (allP<0.05). There was a positive correlation between the expression of RAGE, MKK7 and JNK1 in the DMHC group and HCC group (allP<0.05). Conclusions The increase of RAGE expression may be involved in the occurrence and development of hepatocellular carcinoma. The expression of MKK7 and JNK1 might promote the progress of hepatocellular carcinoma in hyperglycemic state. MKK7 and JNK1 may be regulated by RAGE to some extent.
hepatocellular carcinoma; diabetes mellitus, type 2; receptor for advanced glycation end products; mitogen-activated protein kinase kinase 7; c-Jun N-terminal protein kinase 1
中华医学会临床医学科研专项资金(12020310321);广西高等学校科研项目(201204LX042)。
蒙丽恒(1989-),女,硕士在读,研究方向为糖尿病及其慢性并发症。E-mail: downshifter@163.com
秦映芬(1968-),女,主任医师,研究方向为糖尿病及其慢性并发症。E-mail: yingfenq@126.com
10.3969/j.issn.1002-266X.2017.08.001
R735.7
A
1002-266X(2017)08-0001-04
2016-06-16)
