重叠综合征患者血浆血小板微颗粒及内皮细胞微颗粒水平变化及意义
2017-03-13黄洁李承红陈实刘敏石奕
黄洁,李承红,陈实,刘敏,石奕
(江汉大学附属医院,武汉430025)
重叠综合征患者血浆血小板微颗粒及内皮细胞微颗粒水平变化及意义
黄洁,李承红,陈实,刘敏,石奕
(江汉大学附属医院,武汉430025)
目的 探讨重叠综合征患者血浆血小板微颗粒(PMP)、内皮细胞微颗粒(EMP)水平变化及其临床意义。方法 选取重叠综合征患者58例(重叠综合征组)、单纯慢性阻塞性肺疾病患者72例(慢阻肺组)、单纯阻塞性睡眠呼吸暂停综合征患者60例(呼吸暂停综合征组)。采用流式细胞术检测各组血浆PMP、EMP,分析重叠综合征组血浆PMP、EMP与氧合指数(PO2/FiO2)、乳酸、FEV1、FEV1/FVC的关系。结果 重叠综合征组入院时血浆PMP、EMP水平均高于呼吸暂停综合征组和慢阻肺组,呼吸暂停综合征组血浆EMP水平高于慢阻肺组,组间比较P均<0.05。重叠综合征组睡眠呼吸暂停低通气指数(AHI)>30次/h者入院时血浆EMP、PMP水平均高于AHI >5~≤15次/h者和>15~≤30次/h者(P均<0.05),AHI>15~≤30次/h者血浆EMP、PMP水平均高于AHI>5~≤15次/h者(P均<0.05)。重叠综合征组治疗后血浆EMP、PMP水平均明显低于治疗前(P均<0.01)。Pearson相关分析显示,重叠综合征组血浆EMP、PMP水平与PO2/FiO2、FEV1、FEV1/FVC均呈负相关(P均<0.01),与乳酸水平均呈正相关(P均<0.01)。结论 血浆EMP、PMP水平升高可促进重叠综合征的发生、发展,二者联合检测可判断重叠综合征患者病情和治疗效果。
重叠综合征;血小板微颗粒;内皮细胞微颗粒
慢性阻塞性肺疾病(以下称慢阻肺)和阻塞性睡眠呼吸暂停综合征(以下称呼吸暂停综合征)同时存在称为重叠综合征。重叠综合征的主要症状为严重低氧血症,易引发肺动脉高压、心血管疾病、动脉粥样硬化、糖尿病等。研究表明,微颗粒具有促凝、促炎、收缩血管、调节免疫等生物学功能,与血管性疾病、癌症、糖尿病等疾病的发生、发展相关[1]。本研究探讨了重叠综合征患者血浆血小板微颗粒(PMP)和内皮细胞微颗粒(EMP)水平变化及其临床意义。
1 资料与方法
1.1 临床资料 选择2014年1月~2016年1月江汉大学附属医院收治的重叠综合征患者58例(重叠综合征组),男45例、女13例,年龄46~63(54.25±7.12)岁,睡眠呼吸暂停低通气指数(AHI)>5~≤15次/h 28例、>15~≤30次/h 20例、>30次/h 10例,氧合指数(PO2/FiO2)为(253.2±47.8)mmHg,乳酸为(1.51±1.05)mmol/L,肺功能:FEV1为(61.83±7.28)%、FEV1/FVC为(60.31±9.85)%。入院后常规给予低流量吸氧、补液、抗感染、平喘、祛痰及BiPAP呼吸机治疗3个月。同期选取我院收治的单纯慢阻肺患者72例(慢阻肺组),男53例、女19例,年龄47~62(54.90±7.18)岁。单纯呼吸暂停综合征患者60例(呼吸暂停综合征组),男44例、女16例,年龄46~64(55.64±8.06)岁。三组性别、年龄具有可比性。纳入标准:①慢阻肺诊断符合2013年中华医学会制定的《慢性阻塞性肺疾病诊治指南》中的诊断标准[2];②呼吸暂停综合征诊断符合2011年中华医学会制定的《阻塞性睡眠呼吸暂停低通气综合征诊治指南》中的诊断标准[3],其中AHI>5~≤15次/h为轻度、>15~≤30次/h为中度、>30次/h为重度;③重叠综合征同时符合慢阻肺和呼吸暂停综合征的诊断标准;④能配合完成肺功能检查。排除标准:①近3个月内使用激素治疗;②合并其他肺部疾病,如支气管哮喘、支气管扩张症、肺纤维化、肺结核和胸腔积液等;③合并心肌病、心力衰竭、急慢性肾病、高血压、肝脏疾病和代谢性疾病。本研究经医院伦理委员会审查批准,患者均知情同意。
1.2 血浆PMP、EMP检测 慢阻肺组、呼吸暂停综合征组于入院时,重叠综合征组于入院时及治疗3个月结束时分别抽取清晨空腹肘静脉血6 mL,EDTA抗凝后,分别加入前列腺素E1(PGE1)11 μL和三磷酸腺苷双磷酸酶(Apyrase,Sigma公司)5 μL,400 g离心15 min收集富血小板血浆,以1 800 g离心15 min获得无血小板血浆(PPP),吸取上层血浆置于-80 ℃冰箱冻存。冻存后的PPP在0 ℃解冻,每管加入PPP 40 μL,分别与10 μL PE标记的抗CD31抗体和抗CD41a抗体充分混合,避光孵育20 min,分别加入420 μL结合缓冲液及5 μL Annexin V抗体,充分混匀。流式细胞术测定血浆PMP、EMP。对照管选用5 μL鼠抗人IgG-PE,加入462 μL结合缓冲液、5 μL Annexin V抗体、1.5 μL 0.3 μm及1.5 μL 0.8 μm的标准微球,再加入5 μL绝对计数微球,混合后流式细胞术检测。PMP、EMP的界定直径为0.3~0.8 μm,表面标记CD41a、Annexin V双阳性或CD31、Annexin V双阳性。读取10 000个微粒数,根据标准荧光微球计数PMP、EMP水平,单位为个/μL。
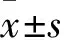
2 结果
2.1 各组血浆PMP、EMP水平比较 重叠综合征组入院时血浆PMP、EMP水平均高于呼吸暂停综合征组和慢阻肺组(P均<0.05),呼吸暂停综合征组血浆EMP水平高于慢阻肺组(P<0.05)。见表1。重叠综合征组AHI>30次/h者入院时血浆EMP、PMP水平均高于AHI>5~≤15次/h和AHI>15~≤30次/h者(P均<0.05),AHI>15~≤30次/h者血浆EMP、PMP水平均高于AHI>5~≤15次/h者(P均<0.05)。见表2。重叠综合征组治疗后血浆EMP、PMP水平均低于治疗前(P均<0.01)。见表3。
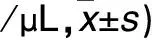
表1 三组入院时血浆PMP、EMP水平比较(个
注:与呼吸暂停综合征组比较,△P<0.05;与慢阻肺组比较,*P<0.05。
2.2 重叠综合征组血浆PMP、EMP水平与PO2/FiO2、乳酸、FEV1、FEV1/FVC的关系 Pearson相关分析显示,重叠综合征组血浆EMP、PMP水平与PO2/FiO2均呈负相关(r分别为-0.734、-0.699,P均<0.01),与乳酸水平均呈正相关(r分别为0.789、0.707,P均<0.01);血浆EMP水平与FEV1、FEV1/FVC均呈负相关(r分别为-0.812、-0.766,P均<0.01);血浆PMP水平与FEV1、FEV1/FVC均呈负相关(r分别为-0.749、-0.692,P均<0.01)。
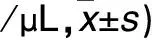
表2 重叠综合征组不同AHI者入院时血浆PMP、EMP水平比较(个
注:与AHI>5~≤15次/h者比较,*P<0.05;与AHI>15~≤30次/h者比较,△P<0.05。
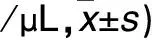
表3 重叠综合征组治疗前后血浆PMP、EMP水平比较(个
注:与治疗前比较,*P<0.01。
3 讨论
循环微颗粒是细胞受到刺激后从胞质膜表面脱落的颗粒,其含有的亲本细胞抗原可反映亲本细胞的状态和特性;还可通过调节NO和产生前列环素对血管内皮功能和炎症反应起重要作用,并通过刺激细胞因子的释放及诱导细胞因子在内皮细胞中的基因表达,来调节单核细胞趋化性与内皮细胞黏附[4]。目前认为,循环微颗粒的生物学活性(如细胞间生物信号传导、免疫调节、血管生成和组织修复等)与疾病的发生、发展密切相关[5]。EMP主要通过内皮细胞的活化或凋亡产生,其表面表达的相关分子受体使其具有不同的生物学活性,在血栓形成、血管生成、炎性反应、细胞凋亡和调节血管张力等方面具有重要作用[6]。有研究表明,注射EMP可引起大鼠急性肺损伤,其作用机制可能为促进炎症因子、过氧化物酶释放,上调IL-1β、TNF-α等表达,使中性粒细胞聚集和激活,加重炎症反应[7]。此外,在恶性肿瘤、脓毒症、动脉粥样硬化和糖尿病等患者体内均发现PMP水平显著升高[8]。研究发现,不管是血浆分离还是血小板刺激产生的PMP,均可作用于不同的细胞,促使其产生黏附分子、释放细胞因子、调节血管反应性、诱导血管生成、促进肿瘤生长,亦可促使内皮细胞及单核细胞黏附,增加环氧合酶2表达,从而加重炎症反应[9]。
研究发现,重叠综合征患者病情进展较单纯慢阻肺或呼吸暂停综合征患者更快[10]。重叠综合征与慢阻肺、呼吸暂停综合征有共同的发病诱因,如吸烟。吸烟不仅是慢阻肺发病的高危因素,亦与呼吸暂停综合征的病情严重程度有关[11]。低氧血症是慢阻肺和呼吸暂停综合征共同的病变基础,重叠综合征患者肺动脉高压、心血管疾病、动脉粥样硬化、糖尿病等并发症的发生风险较单纯慢阻肺或呼吸暂停综合征者显著增加,其主要死因为心血管疾病[12]。Li等[13]研究发现,香烟提取物不仅可诱导微粒释放,还能促使具有促微粒蛋白水解活性的MMP14从巨噬细胞释放。Gordon等[14]研究发现,烟草可增加循环微颗粒水平,吸烟的健康者循环系统EMP轻度增加,早期肺气肿可能与血浆EMP水平升高密切相关。EMP水平与肺组织破坏程度及气流受限明显相关。内皮损伤是慢阻肺重要的病理生理过程,微颗粒特别是EMP可作为慢阻肺内皮损伤的生物学标记物[15]。有研究发现,EMP与肺动脉内膜中层厚度呈正相关,二者均可作为肺动脉高压患者随访评估的非入侵性检查[16]。Maruyama等[17]报道,重度呼吸暂停综合征患者血浆PMP水平较健康者及轻中度呼吸暂停综合征者明显升高,且可能与重度呼吸暂停综合征者心血管疾病发生风险更高相关,在应用持续气道正压通气治疗后,血浆PMP水平会随之下降。本研究重叠综合征组血浆EMP、PMP水平均明显高于呼吸暂停综合征组和慢阻肺组,且呼吸暂停综合征组血浆EMP水平明显高于慢阻肺组;重叠综合征组AHI>30次/h者血浆EMP、PMP水平均高于AHI>5~≤15次/h和AHI>15~≤30次/h者;提示血浆EMP、PMP水平升高可促进重叠综合征的发生、发展。本研究重叠综合征患者治疗后血浆EMP、PMP水平明显低于治疗前,提示随着机体缺氧状态的改善,血浆EMP、PMP水平即随之下降,二者水平变化可反映机体缺氧情况。重叠综合征患者往往存在低灌注状态,严重供氧不足导致组织细胞缺氧,代谢产物乳酸浓度升高。乳酸是反映组织灌注和氧供不足的早期敏感生化指标,而PO2/FiO2可反映肺换气功能[18]。本研究重叠综合征组血浆EMP、PMP水平与乳酸水平呈正相关,与肺功能FEV1、FEV1/FVC及PO2/FiO2呈负相关,提示机体缺氧越严重,血浆EMP、PMP水平越高,即EMP、PMP水平与气流受限明显相关。
综上所述,血浆EMP、PMP水平升高可促进重叠综合征的发生、发展,二者联合检测可判断重叠综合征患者病情和治疗效果。
[1] Rautou PE, Vion AC, Amabile N, et al. Microparticles, vascular function, and atherothrombosis[J]. Circ Res, 2011,109(5):593-606.
[2] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版) [J].中华结核和呼吸杂志,2013,36(4):255-264.
[3] 中华医学会呼吸病分会睡眠呼吸学组.阻塞性睡眠呼吸暂停低通气综合征诊治指南 (2011年修订版) [J].中华结核和呼吸杂志,2011,19(8):356-362.
[4] Puddu P, Puddu GM, Cravero E, et al. The involvement of circulating microparticles in inflammation, coagulation and cardiovascular diseases[J]. Can J Cardiol, 2010,26(1):140-145.
[5] Kornek M, Lynch M, Mehta SH, et al. Circulating microparticles as disease-specific biomarkers of severity of inflammation in patients with hepatitis C or nonalcoholic steatohepatitis[J]. Gastroenterology, 2012,143(2):448-458.
[6] Martinez MC, Tual-Chalot S, Leonetti D, et al. Microparticles:targets and tools in cardiovascular disease[J]. Trends Pharmacol Sci, 2011,32(11):659-665.
[7] Buesing KL, Densmore JC, Kaul S, et al. Endothelial microparticles induce inflammation in acute lung injury[J]. J Surg Res, 2011,166(1):32-39.
[8] Jung C, Sorensson P, Saleh N, et al. Circulating endothelial and platelet derived microparticles reflect the size of myocardium at risk in patients with ST-elevation myocardial infarction[J]. Atherosclerosis, 2012,221(1):226-231.
[9] Pisetsky DS, Ullal AJ, Gauley J, et al. Microparticles as mediators and biomarkers of rheumatic disease[J]. Rheumatology (Oxford), 2012,51(10):1737-1746.
[10] 胡华.阻塞性睡眠呼吸暂停综合征合并慢性阻塞性肺疾病的研究进展[J].山东医药,2009,49(5):107-109.
[11] Mieczkowski B, Ezzie ME. Update on obstructive sleep apnea and its relation to COPD[J]. Int J Chron Obstruct Pulmon Dis, 2014,8(9):349-362.
[12] Zhang W, Si LY. Obstructive sleep apnea syndrome and hypertension: pathogenic mechanisms and possible therapeutic approaches[J]. Ups J Med Sci, 2012,117(4):370-382.
[13] Li CJ, Liu Y, Chen Y, et al. Novel proteolytic microvesicles released from human macrophages after exposure to tobacco smoke[J]. Am J Pathol, 2013,182(5):1552-1562.
[14] Gordon C, Gudi K, Krause A, et al. Circulating endothelial microparticlesas a measure of early lung destruction in cigarette smokers[J]. Am J Respir Crit Care Med, 2011,184(2)224-232.
[15] Takahashi T, Kubo H. The role of microparticles in chronic obstructive pulmonary disease[J]. Int J Chron Obstruct Pulmon Dis, 2014,27(9):303-314.
[16] van Ierssel SH, Van Craenenbroeck EM, Conraads VM, et al. Flow cytometric detection of endothelial microparticles (EMP): effects of centrifugation and storage alter with the phenotype stuided[J]. Thromb Res, 2010,125(4):332-339.
[17] Maruyama K, Morishita E, Sekiya A, et al. Plasma levels of platelet-derived microparticles in patients with obstructive sleep apnea syndrome[J]. J Atheroscler Thromb, 2012,19(1):98-104.
[18] Wang ZY,Bai Y. Extravascular lung water and pulmonary vascular permeability index may inadvertently delay the identification of acute respiratory distress syndrome[J]. Crit Care, 2013,17(2):420.
武汉市医疗卫生科研项目(WX15D57)。
李承红(E-mail: 15827636399@163.com)
10.3969/j.issn.1002-266X.2017.08.028
R563
B
1002-266X(2017)08-0086-03
2016-05-26)
