大鼠子宫角瘘管模型的建立
2017-03-13侯金龙袁超文黄欢宇王国卿
侯金龙, 袁超文, 黄欢宇,王国卿
(东北大学 生命科学与健康学院,辽宁 沈阳 110819)
研究报告
大鼠子宫角瘘管模型的建立
侯金龙, 袁超文, 黄欢宇,王国卿
(东北大学 生命科学与健康学院,辽宁 沈阳 110819)
目的 探讨在大鼠子宫角安置瘘管导管的可行性。方法 对大鼠进行麻醉后,在近子宫体端子宫角放置瘘管导管,并进行组织病理学和妊娠功能的研究。结果 大鼠子宫内膜厚度瘘管模型组内瘘管留置侧子宫角(497.68±81.64) μm与对照组(537.90±77.29)μm和瘘管模型组内对侧子宫角(503.56±76.34)μm相比差异不显著(P>0.05);大鼠胚胎植入数量瘘管模型组(9.67±1.95)个与对照组(12.15±2.06) 个相比显著减少(P<0.05);瘘管模型组内瘘管侧子宫角(5.83±3.54)个与对侧子宫角(6.17±3.67)个相比差异不显著(P>0.05)。结论 子宫角瘘管导管模型对大鼠子宫组织结构影响较小,能够满足向子宫腔内长期注射病原微生物或者化学药物等的试验要求。
大鼠;子宫角;瘘管模型
大鼠具有繁殖周期短,成年雌鼠在动情周期的不同阶段,阴道粘膜可发生典型变化的特点,是制备子宫疾病模型较为理想的实验动物之一。在子宫病理生理的研究中,有时需要向大鼠子宫腔内反复注射病原微生物或者化学药物等,目前主要通过两种途径来实现:一种是使用阴道开膣器和子宫灌注针经阴道和子宫颈进行注射[1],另一种是在背外侧或者腹中线开口暴露子宫角后进行注射[2-6]。但这两种方法都存在严重不足,经阴道和子宫颈注射,由于大鼠体型较小,子宫颈收缩较紧时容易将针头刺入腹腔,会对大鼠造成不同程度的伤害。采用反复在背外侧或者腹中线开口暴露子宫角后进行注射的方式,不宜反复进行操作,也不符合动物福利的要求,同时这种方式也会使大鼠产生应激反应,影响实验结果的准确性,通过建立大鼠子宫角瘘管模型可弥补上述不足。关于子宫角瘘管导管模型在羊[7]已有相关报道,子宫角瘘管模型可长期反复向子宫腔内注射病原微生物或者化学药物等,进行慢性实验,对子宫病理生理进行长期深入的研究。
1 材料和方法
1.1 材料
1.1.1 实验动物:SPF级Wistar大鼠,体重240~260 g,14~15周龄,购于辽宁长生生物技术有限公司[SCXK(辽)2015-0001]。实验在沈阳化工研究院进行[SYXK(辽)2012-0004]。
1.1.2 实验材料:舒泰50(法国维克有限公司)、快速瑞士-吉姆萨染液(南京建成科技有限公司)、复方泛影葡胺注射液(上海旭东海普药业有限公司)、滂胺天蓝(上海源叶生物科技有限公司)、一次性使用硬膜外麻醉导管(F3-II型,常州迈创医疗器械有限公司)、HE染色试剂盒(北京索莱宝科技有限公司)、常规手术器械等。
1.2 试验方法
1.2.1 子宫角瘘管导管的制作:将硬膜外麻醉导管剪成8 cm小段,两端剪成钝圆形,防止刺伤组织。将“Y”型导管固定翼用医用胶水固定在硬膜外麻醉导管上,距离硬膜外麻醉导管一端0.5 cm,使用前应用0.1%的新洁尔灭消毒。
1.2.2 造模方法:阴道涂片法检查具有正常动情周期的24只雌性Wistar大鼠,随机分为对照组和瘘管模型组,每组12只。各组分别做如下处理:对照组大鼠不做任何处理;瘘管模型组大鼠按50 mg/kg的体重腹腔注射舒泰50,麻醉后从腹中线开口,找到一侧子宫角,将子宫角瘘管导管放入子宫腔内,导管留置在子宫腔内的部分约0.5 cm,用6-0缝合线将导管固定翼缝合在子宫浆肌层上,注意保持子宫角原有的自然状态,将子宫角瘘管导管穿出腹壁并将其固定,经导管接头向子宫角内注射生理盐水0.1 mL,无渗漏,缝合腹腔。子宫角瘘管导管近导管接头端用医用胶水密封。瘘管模型组大鼠术后颈部套自制项圈防止其啃咬伤口及子宫角瘘管导管,待其清醒后放回笼中单独饲养。瘘管模型组大鼠每隔12 h剪掉医用胶水密封处,经导管接头注射生理盐水防止导管阻塞。
瘘管模型组大鼠于第3天麻醉后,经瘘管导管向子宫内注射76%泛影葡胺0.1 mL,在X光下进行观察,检查子宫角瘘管导管是否畅通和是否保留在子宫腔内,检查完成后继续饲养,不再向子宫内注射生理盐水,于术后第7天拆线,但不拆除自制项圈。于术后第14 天后选择间情期的对照组和瘘管模型组大鼠各6只,处死分离子宫角进行HE染色。其余大鼠于发情期与雄性大鼠按1∶1的比例进行合笼,次日清晨阴道涂片发现精子者作为妊娠第1 天,于妊娠第8 天进行麻醉,尾静脉注射1%滂胺天蓝染液2.5 mL,3 min后处死大鼠,分离子宫,观察记录各组大鼠子宫角的胚胎植入点(蓝斑区)。
1.3 统计学分析

2 结果
2.1 大鼠子宫角瘘管导管手术造模结果
子宫角瘘管导管制作完毕(图1),导管接头用于连接瘘管导管和注射器,导管固定翼用于将导管固定在大鼠子宫的浆肌层上。大鼠麻醉后经腹中线开口进行插管(图2)。瘘管模型组大鼠于第3天麻醉后,经瘘管导管向子宫内注射76%泛影葡胺0.1 mL,在X光下进行观察,可见泛影葡胺经子宫角瘘管导管注入到子宫腔内(图3),说明子宫角瘘管导管畅通并且保留在子宫腔内。
2.2 HE染色组织学观察结果
大鼠子宫从内至外可分为内膜、肌层和外膜,在发情周期中,子宫经历一系列明显的变化。子宫内膜由上皮和固有层构成。上皮为单层柱状上皮,固有层的浅层有较多的细胞成分及子宫腺导管,深层中细胞成分较少,但布满了分支管状的子宫腺及其导管。试验中选择间情期大鼠进行HE染色组织学观察(图4)。并对子宫内膜的厚度进行了测量,其中对照组大鼠的子宫内膜厚度为(537.90±77.29)μm,瘘管模型组内瘘管侧子宫角内膜厚度为(497.68±81.64)μm,对侧子宫角内膜厚度为(503.56±76.34)μm。各组大鼠的子宫内膜厚度差异不显著(P>0.05)。瘘管留置侧子宫未观察到炎性细胞浸润和上皮细胞脱落。
2.3 妊娠功能观察结果
各组大鼠于妊娠第8天注射1%滂胺天蓝染液,观察记录子宫角的胚胎植入情况,以评价瘘管对子宫妊娠功能的影响。对照组和瘘管模型组大鼠交配后均能受孕(图5),其中对照组胚胎植入数量为(12.15±2.06)个和瘘管模型组胚胎植入数量为(9.67±1.95)个。胚胎植入数量瘘管模型组与对照组相比明显减少,差异显著(P<0.05)。瘘管模型组内瘘管侧子宫角胚胎植入数量为(5.83±3.54)个,对侧子宫角胚胎植入数量为(6.17±3.67)个,瘘管侧子宫角与对侧子宫角相比胚胎植入数量差异不显著(P>0.05)。

图1 子宫角瘘管导管Fig.1 Uterine horn fistula
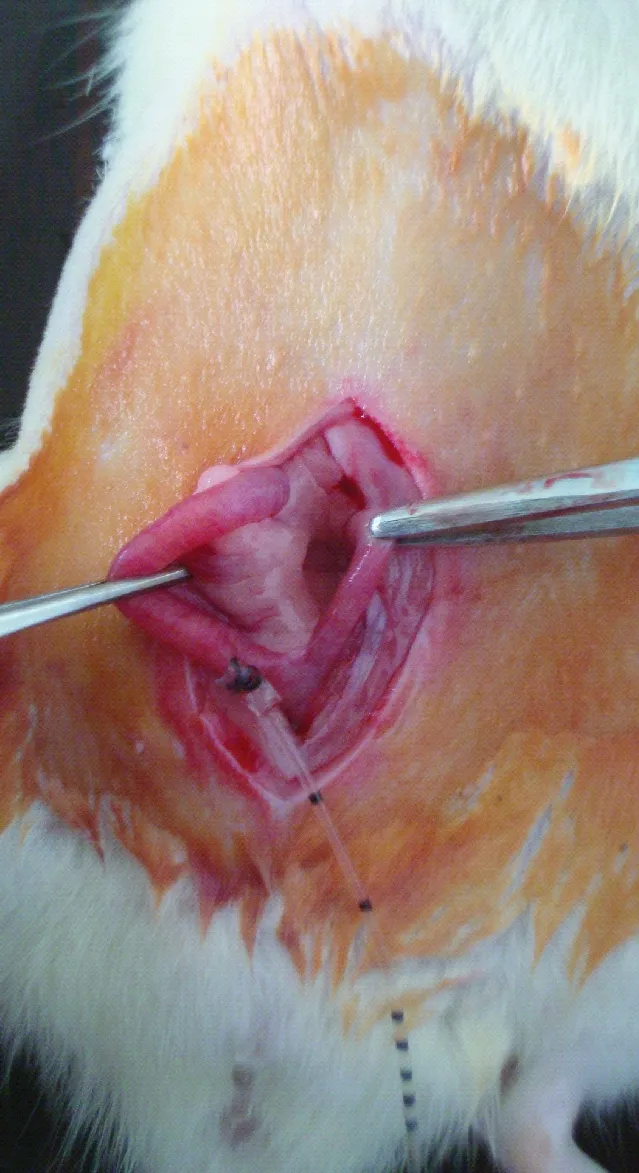
图2 子宫角瘘管模型Fig.2 Uterine horn fistula model
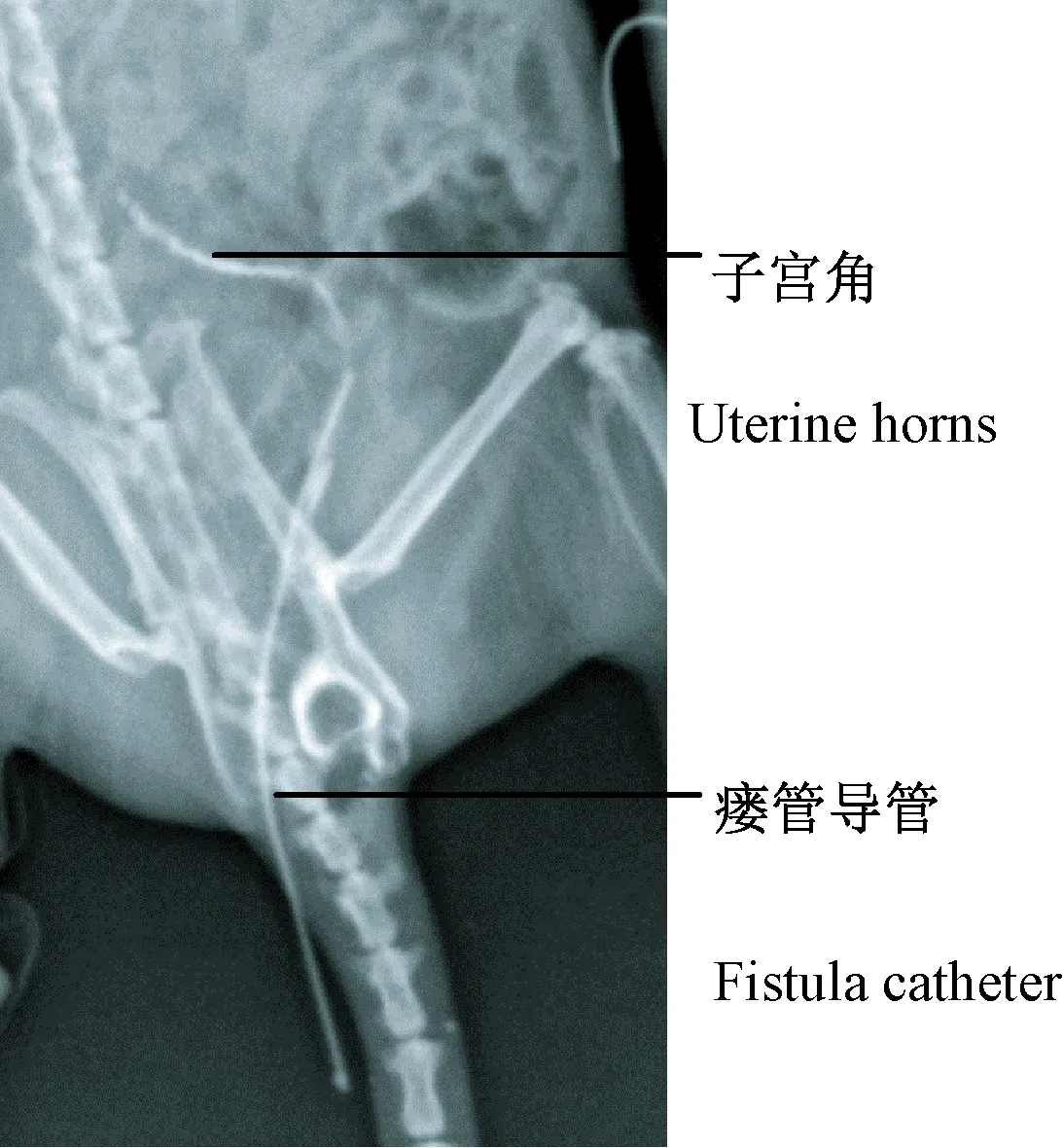
图3 大鼠瘘管模型X光片Fig.3 X-ray of the rat uterine horn fistula model
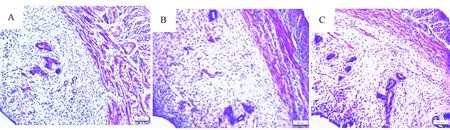
注:A对照组子宫角,B瘘管模型组瘘管留置侧子宫角,C瘘管模型组对侧子宫角图4 大鼠子宫HE染色,200×,标尺=60μmNote. A: Control group; B: Uterine horn of the fistula side; C: Uterine horn of the opposite side.Fig.4 Histology of the rat uterine tissues. HE staining, ×200,Bar=60 μm

注:A对照组,B瘘管模型组图5 图5 子宫胚胎植入点Note. A: Control group; B: Fistula model group.Fig.5 Embryo implantation site in the uterine horns
3 讨论
由于大鼠动情周期的存在,因此大鼠瘘管导管的安放存在时间的选择问题。通过预实验,在大鼠动情的不同时期(动情前期、动情期、动情后期和动情间期)进行手术安放瘘管导管,并进行妊娠功能检查,大鼠均能受孕。动情期大鼠子宫相比其他时期较粗大,容易安放,但是子宫组织较脆,对子宫的损伤较大。动情间期大鼠子宫相比其他时期韧性较强,安放瘘管导管时对组织损伤较小,因此选择动情间期安放瘘管导管相比其他时期较好。造模大鼠应选择动情周期正常,体重较大的个体,否则手术操作会带来困难。因为子宫乳的存在,可能会阻塞瘘管导管,因此应根据瘘管导管使用时间的长短,定时向导管内注射生理盐水,防止导管阻塞。
评价大鼠子宫角瘘管模型建立成功与否的一个重要指标是该模型是否影响了大鼠子宫胚胎孕育的功能。因此造模成功的关键在于:第一,子宫角瘘管导管模型应能够保持子宫腔畅通,能够允许精子自由通过并与卵子结合;第二,子宫角瘘管导管不能引起子宫内膜发生炎症反应和不影响子宫正常的血液循环;第三,子宫角瘘管导管模型要保持子宫原有的自然形态和良好的伸展性,满足胚胎发育的需要;第四,子宫内膜应对雌、孕激素应答良好,并在雌、孕激素的作用下与胚泡同步发育[8]。在本实验中,大鼠造模后14 d,利用雄性大鼠进行合笼交配,通过观察子宫的受孕情况及胚胎情况来评价大鼠子宫胚胎孕育功能。通过大体解剖观察子宫角瘘管导管侧子宫存在胚胎,说明子宫角瘘管导管对子宫腔内环境影响较小,不影响胚胎着床。但是插管部位子宫没有观察到胚胎着床,所以应选择插管部位以外的区域进行取材。瘘管模型组大鼠的胚胎数也少于对照组,其主要原因是大鼠子宫安置瘘管处至子宫体段区间的子宫角胚胎数量较少。瘘管模型组内瘘管侧子宫角胚胎植入数量与对侧子宫角胚胎植入数量相比差异不显著,这主要是由于两侧子宫角胚胎植入数量变动较大造成的。通过对处于间情期大鼠进行HE染色组织学观察,各组大鼠的子宫结构完整,内膜厚度差异不显著。说明瘘管导管对子宫结构影响较小。
本试验中的子宫角瘘管模型特别适用于向子宫腔内长期注射病原微生物或者药物等,探讨单一因素对子宫病理生理方面的影响。如在制备子宫内膜炎疾病模型时,目前多采用向子宫腔内单次注射病原微生物的方法[9-10]。病原微生物作为有生命的个体,本身或者代谢产物均有可能引起子宫内膜炎,并且病原微生物在子宫腔内的存活是一个长期的过程,因此为了研究引起子宫内膜炎的主要致病物,就需要向子宫腔内长期注射病原微生物的代谢产物,从而更好地研究子宫内膜炎的发病机理。
试验中筛选出了适宜制备子宫角瘘管的导管,并对瘘管导管动物模型进行妊娠功能和组织病理学方面的观察,大鼠子宫角瘘管模型对动物机体损伤较小,能够适用于向子宫腔内长期注射病原微生物或者药物等的试验要求。
[1] 赵红琼,简子键,姚刚,等. 建立大鼠实验性子宫内膜炎模型的探讨 [J]. 新疆农业大学学报,2008,31(3): 5-8.
[2] Aronoff DM, Hao Y, Chung J, et al. Misoprostol impairs female reproductive tract innate immunity against Clostridium sordellii [J]. J Immunol, 2008, 180(12): 8222-8230.
[3] 郝艳阳,王春江,赵宝,等. 大鼠子宫内膜炎模型的建立及其动态病理学观察 [J]. 西北农林科技大学学报,2010,38(4): 1-6.
[4] 和翀翼,武瑞,李利,等. 大鼠子宫内膜炎模型复制及其中西药复方乳剂治疗 [J]. 中国实验动物学报,2008,16(3): 214-216.
[5] Li F, Nowicki BJ, Dong YL, et al. Localized increase in nitric oxide production and the expression of nitric oxide synthase isoforms in rat uterus with experimental intrauterine infection [J]. Am J Obstet Gynecol, 1999, 181(3): 601-609.
[6] Halperin R, Shinnar N, Kronfeld-schor N, et al. Effect of intrauterine injection of casein on fetal survival in rat: a new pharmacological approach for contraception [J]. Contraception, 2006, 73(6): 641-644.
[7] 包喜君. 山羊子宫内膜炎病理模型的制备和发病机理的研究 [D]. 扬州:扬州大学,2008:17-27.
[8] 李新安. 促进大鼠子宫壁全层损伤后功能性修复的实验研究 [D]. 南京:南京大学,2012:51-53.
[9] 许腊梅,冯万宇,王岩,等. 奶牛子宫内膜炎研究进展 [J]. 动物医学进展,2008,29(8): 71-74.
[10] 孔祥峰,胡元亮,郭振环,等. 家兔子宫内膜炎模型的建立和临床病理学观察 [J]. 中国实验动物学报,2006,14(3): 213-216.
Establishment of a rat model of uterine horn fistula
HOU Jin-long, YUAN Chao-wen, HUANG Huan-yu, WANG Guo-qing
(College of Life and Health Sciences, Northeastern University, Shenyang 110819, China)
Objective To explore the feasibility of catheter implantation in a rat model of uterine horn fistula. Methods The catheter was placed into the uterine horns at one side in the rats, then histopathology and pregnancy function were studied. Results The endometrial thickness of the fistula side in the fistula model group (497.68±81.64 μm) was not significantly different compared with the control group (537.90±77.29 μm) and the opposite side (503.56±76.34 μm) (P>0.05). The number of embryo breeding in the fistula model group (9.67±1.95) was significantly decreased compared with the control group (12.15±2.06). The number of embryo breeding of the fistula side (5.83±3.54) was not significantly different compared with the opposite side (6.17±3.67 ) (P>0.05). Conclusions The effect of catheter on uterine tissue and pregnancy function is minimal, and the model of uterine horn fistula applies to the requirement of long term injection of pathogenic microorganisms or drugs.
Rat, Uterine horn, Fistula model
教育部中央高校基本科研业务费(N130420001)。
侯金龙(1986-),男,助理实验师,研究方向:实验动物疾病模型。
王国卿,副教授,E-mail: wangguoqing@mail.neu.edu.cn。
R-33
A
1671-7856(2017) 02-0029-05
10.3969.j.issn.1671-7856. 2017.02.006
2016-10-30
