微量元素锶改善大鼠非酒精性脂肪肝的机制研究
2017-03-13姜慧玲关桥伟肖业伟冯志强盘强文
姜慧玲,关桥伟,龚 林,肖业伟,余 广,冯志强,盘强文
(1.西南医科大学生理学教研室,泸州,四川 646000;2. 西南医科大学形态学实验中心,泸州,四川 646000)
研究报告
微量元素锶改善大鼠非酒精性脂肪肝的机制研究
姜慧玲1,关桥伟1,龚 林2,肖业伟1,余 广1,冯志强1,盘强文1
(1.西南医科大学生理学教研室,泸州,四川 646000;2. 西南医科大学形态学实验中心,泸州,四川 646000)
目的 探讨微量元素锶改善大鼠非酒精性脂肪肝的机制。方法 50只SD大鼠随机分为对照组、模型组、18 mg/L锶组、36 mg/L锶组和辛伐他汀组。对照组进食普通饲料,其余4组进食高脂饲料,第6周起给予18 mg/L和36 mg/L锶组浓度分别为18 mg/L和36 mg/L含锶饮用水,第11周起进行灌胃,18 mg/L和36 mg/L锶组分别灌浓度为18 mg/L和36 mg/L含锶水3 mL/kg体重,辛伐他汀组灌辛伐他汀10 mg/kg体重,对照组与模型组灌生理盐水3 mL/kg 体重。第14周末处死大鼠,检测血清TG、TC、LDL-C和肝组织TG、TC含量,并行肝组织油红O染色观察脂肪变性情况,免疫组化检测肝组织GRP78、SREBP2、HMGCR和LDLr蛋白表达水平。结果 与对照组比较,模型组的血清TC、LDL-C和肝TC、TG均升高(P<0.05),与模型组比较,36 mg/L锶组血清TC、LDL-C和肝TC、TG均降低(P<0.05)。油红O染色显示模型组肝组织含大量的红染脂质颗粒,18 mg/L锶组、36 mg/L锶组及辛伐他汀组红染颗粒均较模型组不同程度减少(P<0.05)。免疫组化结果显示:模型组大鼠肝组织GRP78、SREBP2、HMGCR和LDLr蛋白表达水平,18mg/L锶组大鼠肝组织GRP78、SREBP2和LDLr蛋白表达水平,36 mg/L锶组大鼠肝组织LDLr蛋白表达水平及辛伐他汀组大鼠肝组织SREBP2和LDLr蛋白表达水平均明显高于对照组(P<0.05)。36 mg/L锶组大鼠肝组织GRP78、SREBP2和HMGCR蛋白表达水平明显低于模型组,而LDLr蛋白表达水平明显高于模型组;辛伐他汀组大鼠肝组织GRP78和HMGCR蛋白表达水平明显低于模型组(P<0.05);而18 mg/L锶组大鼠肝组织GRP78、SREBP2、HMGCR和LDLr蛋白表达水平较模型组无显著差异(P>0.05)。结论 长期较高浓度锶摄入可改善脂代谢紊乱,减轻NAFLD,其作用机制可能与调节内质网应激、HMGCR活性和LDLr的功能等有关。
锶;非酒精性脂肪肝;内质网应激;羟甲基戊二酸单酰辅酶A还原酶;低密度脂蛋白受体
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是由非酒精因素引起的以肝细胞脂肪变性和脂肪贮积为特征的慢性代谢紊乱性疾病,其可在短期内发展为严重肝损害,其中肝纤维化率达25%,约1.5%~8%患者可进展为肝硬化,更甚者为肝癌。随着人们生活水平的提高及饮食结构的改变,NAFLD的发病率和早期诊断率逐年上升,发病年龄日趋年轻化。由于NAFLD形成原因复杂多样,因而其发病机制至今尚未明确。随着研究的深入,不断有研究提示通过调控固醇调节元件(sterol regulatory element binding protein, SREBPs)通路和羟甲基戊二酸单酰辅酶A还原酶(hydroxymethyl glutaryl coenzyme A reductase, HMGCR)蛋白降解通路,可减少胆固醇的合成[1],而通过低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)介导的LDL的内吞是体内清除血浆中胆固醇的重要途径,从而改善脂质代谢。也有研究发现以葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)作为标志蛋白的内质网应激(endoplasmic reticulum stress, ERS)与NAFLD的发生紧密相关[2-4]。本室与合作者前期研究发现饮用含锶(strontium,Sr)水可降低动物血脂[5],并推测锶可能有助于预防和治疗脂肪肝,但相关研究国内外尚未见报道。鉴于此,本文拟通过建立NAFLD大鼠模型并以摄入高浓度锶为干预,研究脂代谢相关信号通路及其标志性蛋白在NAFLD发展过程中的变化,以期阐明锶改善NAFLD的机制,为锶作为饮料/食品添加剂在防治NAFLD中的应用提供实验性理论依据。
1 材料和方法
1.1 实验动物
50只SD健康雄性大鼠,清洁级,体重(150±20) g,5~6周龄,由西南医科大学动物实验中心提供,动物许可证号[SCXK(川)2013-0028],经西南医科大学伦理委员会批准(20160120),所有实验在西南医科大学基础医学院实验中心进行[SYXK(川)2013-0065]。
1.2 仪器及试剂
仪器:电子天平(Mettler Toledo),脱色摇床(江苏麒麟医用仪器厂),冰冻切片机(莱卡),石蜡切片机(莱卡),电热恒温鼓风干燥箱(上海齐欣科学仪器公司),台式低速离心机(北京京立公司),倒置显微镜(Olympus),吸收光酶标仪(Biotek)。
试剂:辛伐他汀(simvastatin, SIMVA)(广济药业),氯化锶(Sigma),胆固醇和丙基硫氧嘧啶(上海蓝季科技公司),脱氧胆酸钠、油红O及HE染色试剂盒(Solarbio),总胆固醇(T-CHO)与甘油三酯(TG)测定试剂盒(汇力生物技术公司),免疫组化染色试剂盒(SP-0023)、GRP78抗体、HMGCR抗体、LDLr抗体和SREBP-2抗体(博奥森生物技术公司);DAB显色试剂盒(20×)(迈新生物技术公司)。
1.3 实验方法
1.3.1 实验分组: 50只SD健康雄性大鼠,基础饲料适应性饲养1周后进行分组饲养。随机分为对照组(control)、模型组(NAFLD)、18 mg/L锶组(Sr18)、36 mg/L锶组(Sr36)和辛伐他汀组(SIMVA),10只/组。对照组继续进食基础饲料,其余4组进食高脂饲料。高脂饲料配方为:77.6%基础饲料、10%猪油、5%蛋黄粉、5%蔗糖、2%胆固醇、0.2%脱氧胆酸钠和0.2%丙基硫氧嘧啶。第6周起给予Sr18组和Sr36组浓度分别为18 mg/L和36 mg/L的含锶饮用水。第11周起,给予灌胃,Sr18组和Sr36组分别灌浓度为18 mg/L和36 mg/L含锶水3 mL/kg 体重,SIMVA组灌辛伐他汀10 mg/kg 体重,Control组与NAFLD组灌生理盐水3 mL/kg 体重。
1.3.2 标本采集及指标测定: 实验第14周末,用2%的戊巴妥钠溶液(1mL/kg体重)腹腔注射麻醉, 取腹主动脉血,血清分离后送往西南医科大学附属医院检验科测定血清胆固醇(total cholesterol, TC)、甘油三脂(triglyceride,TG)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)含量;迅速取出肝脏,用1∶1的氯仿-甲醇混合液将500 mg同部位肝右叶制成10%匀浆液,静置过夜后离心,按相应试剂盒说明书检测上清中TC和TG含量;部分肝组织OCT包埋,-80℃冷冻作15 μm冰冻切片,油红O染色观察肝组织中脂质沉积情况。其余肝组织作免疫组化检测GRP78、SREBP2、HMGCR和LDLr蛋白的表达:标本用甲醛固定,石蜡包埋后作4 μm切片,按免疫组化试剂盒说明行免疫组化染色(SP法),GRP78、SREBP2、HMGCR及LDLr蛋白主要表达为胞质棕黄色颗粒。光镜下每张切片随机选取10个不重叠视野(10×10),采用美国 Media Cybernetics公司的Image-Pro Plus图像分析软件(Version 6.0)测定平均光密度(AIOD)值。
1.3.3 统计学方法: 数据采用SPSS 17.0作统计分析,首先进行正态性检验及方差齐性检验,然后进行单因素方差分析(one-way ANOVA)检验总体均数差异性,组间比较采用LSD法,否则采用非参数检验,P<0.05示差异具有统计学意义。
2 结果
2.1 血清TC、TG、LDL-C和肝TC、TG的含量变化
模型组与18 mg/L锶组血清TC、LDL-C和肝TC、TG水平明显高于对照组,而血清TG水平明显低于对照组(P<0.05);36 mg/L锶组和辛伐他汀组血清TC、LDL-C水平明显高于对照组,而血清TG水平明显低于对照组(P<0.05)。18 mg/L锶组血清TC、LDL-C水平,36 mg/L锶组血清TC、TG、LDL-C和肝TC、TG水平,辛伐他汀组血清TG和肝TC、TG水平均明显低于模型组(P<0.05,见表1)。
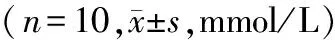
表1 锶对NAFLD大鼠血清TC、TG、LDL-C和肝TC、TG含量的影响
注:*与对照组比较,P<0.05;#与模型组比较,P<0.05
Note. Compared with the control group,*P<0.05; Compared with the NAFLD group,#P<0.05
2.2 肝组织油红O染色
与对照组比较,油红O染色结果显示模型组、18 mg/L锶组及36 mg/L锶组肝脏中均含有较多的红染脂质颗粒,尤以模型组为甚(P<0.01),而对照组肝脏中未见明显红染颗粒;与模型组比较,18 mg/L锶组、36 mg/L锶组及辛伐他汀组肝细胞的红染脂质颗粒含量较模型组均有不同程度减少(P<0.01)(图1)。
2.3 肝组织中GRP78和SREBP2蛋白表达变化
与对照组比较,模型组和18 mg/L锶组大鼠肝组织GRP78和SREBP2及辛伐他汀组大鼠肝组织SREBP2蛋白表达水平均明显高于对照组(P<0.05),36 mg/L锶组大鼠肝组织GRP78和SREBP2及辛伐他汀组大鼠肝组织GRP78蛋白表达水平与对照组差异无统计学意义(P>0.05)。与模型组比较,36 mg/L锶组大鼠肝组织GRP78和SREBP2及辛伐他汀组大鼠肝组织GRP78蛋白表达水平明显低于模型组(P<0.05),而18 mg/L锶组大鼠肝组织GRP78和SREBP2及辛伐他汀组大鼠肝组织SREBP2蛋白表达水平与模型组无统计学差异(P>0.05)。18 mg/L锶组、36 mg/L锶组和辛伐他汀组大鼠肝组织GRP78和SREBP2蛋白表达水平,各组间差异无统计学意义(P>0.05)(图2、3)。
2.4 肝组织中HMGCR蛋白表达变化
与对照组比较,模型组大鼠肝组织HMGCR蛋白表达水平高于对照组(P<0.05),而18 mg/L锶组,36 mg/L锶组和辛伐他汀组大鼠肝组织HMGCR蛋白表达水平与对照组无显著性差异(P>0.05)。与模型组比较,36 mg/L锶组及辛伐他汀组大鼠肝组织HMGCR蛋白表达水平均低于模型组(P<0.05),而18 mg/L锶组大鼠肝组织HMGCR蛋白表达水平与模型组无统计学差异(P>0.05)。18 mg/L锶组、36 mg/L锶组和辛伐他汀组大鼠肝组织HMGCR蛋白表达水平,各组间差异无统计学意义(P>0.05)(图4)。2.5 肝组织中LDLr蛋白表达变化
与对照组比较,模型组、18 mg/L锶组、36 mg/L锶组和辛伐他汀组大鼠肝组织LDLr蛋白表达水平均高于对照组(P<0.05)。与模型组比较,36 mg/L锶组大鼠肝组织LDLr蛋白表达水平明显高于模型组(P<0.01),而18 mg/L锶组和辛伐他汀组大鼠肝组织LDLr蛋白表达水平与模型组无统计学差异(P>0.05)。与18 mg/L锶组比较,36 mg/L锶组和辛伐他汀组大鼠肝组织LDLr蛋白表达水平与18 mg/L锶组无统计学差异(P>0.05)。与36 mg/L锶组比较,辛伐他汀组大鼠肝组织LDLr蛋白表达水平低于36 mg/L锶组(P<0.05)(图5)。

注:A:对照组;B:模型组;C:18 mg/L锶组;D:36 mg/L锶组;E:辛伐他汀组;F:组间比较柱状图(*:P<0.05;**:P<0.01)红色颗粒:油红O示脂肪滴沉积图1 肝组织脂肪沉积及形态学改变(油红O染色,标尺=50 μm)Note. A: Control group; B: NAFLD group; C: Sr 18 mg/L group; D: Sr 36 mg/L group; E: SIMVA group; F: Histogram compared the differences between groups (*:P<0.05;**:P<0.01). Red particles: Oil red O staining showed fat droplet accumulation in the liver tissues. Fig.1 Lipid accumulation in liver tissue and morphological changes (Oil red O staining, Bar=50 μm)

注:A:对照组;B:模型组;C:18 mg/L锶组;D:36 mg/L锶组;E:辛伐他汀组;F:组间比较柱状图 (*:P<0.05;**:P<0.01)棕黄色颗粒:蛋白表达量图2 肝组织GRP78蛋白的表达(标尺=50 μm)Note. A: Control group; B: NAFLD group; C: Sr 18 mg/L group; D: Sr 36 mg/L group; E: SIMVA group; F: Histogram compared the differences between goups (*: P<0.05;**: P<0.01). Claybank particles: protein expressionFig.2 Expression of GRP78 protein in the liver tissue (Bar=50 μm)

注:A:对照组;B:模型组;C:18 mg/L锶组;D:36 mg/L锶组;E:辛伐他汀组; F:组间比较柱状图(*:P<0.05;**:P<0.01)棕黄色颗粒:蛋白表达量图3 肝组织SREBP2蛋白的表达(标尺=50 μm)Note.A: Control group; B: NAFLD group; C: Sr 18 mg/L group; D: Sr 36 mg/L group; E: SIMVA group; F: Histogram compared the differences between groups (*: P<0.05;**: P<0.01). Claybank particles: protein expressionFig.3 Expression of SREBP2 protein in the liver tissue (Bar=50 μm)
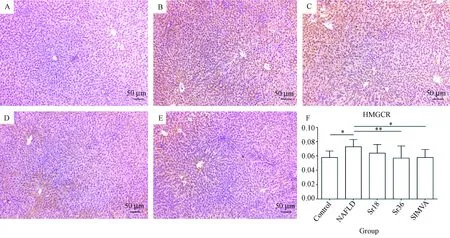
注:A:对照组;B:模型组;C:18 mg/L锶组;D:36 mg/L锶组;E:辛伐他汀组;F:组间比较柱状图(*:P<0.05;**:P<0.01)棕黄色颗粒:蛋白表达量图4 肝组织HMGCR蛋白的表达(标尺=50 μm)Note.A: Control group; B: NAFLD group; C: Sr 18 mg/L group; D: Sr 36 mg/L group; E: SIMVA group; F: Histogram compared the differences between groups (*: P<0.05; **: P<0.01). Claybank particles: protein expressionFig.4 Expression of HMGCR protein in the liver tissues (Bar=50 μm)

注:A:对照组;B:模型组;C:18mg/L锶组;D:36mg/L锶组;E:辛伐他汀组;F:组间比较柱状图(*:P<0.05;**:P<0.01)棕黄色颗粒:蛋白表达量图5 肝组织LDLr蛋白的表达(标尺=50μm)Note.A: Control group; B: NAFLD group; C: Sr 18 mg/L group; D: Sr 36 mg/L group; E: SIMVA group; F: Histogram compared the differences between groups (*: P<0.05;**: P<0.01). Claybank particles: protein expressionFig.5 Expression of LDLr protein in the liver tissues (Bar=50 μm)
3 讨论
目前NAFLD的动物模型制备方法很多,本实验以微调高脂配方饲料[6]饲养SD大鼠来制备NAFLD模型。实验结果显示模型组大鼠血清TC、LDL-C和肝TC、TG水平均升高,且油红O染色显示肝脏中有大量红染脂肪滴,由此证实NAFLD动物模型建立成功。但实验所得NAFLD大鼠的血清TG水平降低,与临床NAFLD患者的血清学改变不一致,这可能与饲料配方有关,其具体机制有待进一步探究。也正因此,本文对于微量元素锶改善大鼠非酒精性脂肪肝机制的探讨主要集中于胆固醇代谢。
锶是人体必需的微量元素,有研究[7]指出饮用一定含量的锶水对人体有益。目前,锶在临床上的应用及研究主要集中于骨转移瘤和骨质疏松的治疗[8-10]。李牧等[11]证实锶可延缓动脉粥样硬化的进程, 汪澍等[5]指出锶矿泉水可降低II型糖尿病大鼠的TC与TG水平,可见锶的摄入可以影响脂代谢。然而,锶是否能够预防和治疗NAFLD,其机制如何,国内外尚未见报道。本研究结果显示18 mg/L锶组大鼠血清TC、LDL-C和肝TC、TG均降低;而36 mg/L锶组血清TC、LDL-C和肝TC、TG均显著降低。由此可见,长期较高浓度地摄入锶可有效改善脂代谢,减轻NAFLD。目前,治疗NAFLD最有效的药物是他汀类,本文的阳性对照辛伐他汀组的脂代谢改善情况最为显著,也进一步证实此类药物治疗NAFLD的有效性,然而,随着他汀的广泛应用,其不良反应也日益显现,主要有肝毒性、肌毒性和肾损害等,因此,寻找新的疗效显著且不良反应少的NAFLD防治手段迫在眉睫。人体必须的微量元素锶可作为饮料和/或食品添加剂而被人体摄入,因此其有可能会成为一种更易被患者接受且更经济、安全和有效的NAFLD的防治方式。
NAFLD的发病机制非常复杂,目前公认度最高的是“二次打击学说”,一次打击以胰岛素抵抗引起肝脂质沉积为主,二次打击则主要包括氧化应激、线粒体功能障碍、脂质过氧化、内质网应激、肝细胞大量炎症坏死及肝纤维化[12],其中脂质代谢紊乱引起肝脂沉积是NAFLD发生的关键环节[13]。曾翠玲等[14]发现Slit2过表达可以减轻肝脏脂肪变性,降低血脂水平,其机制可能是抑制LXR-α—SREBP-1c—FAS信号轴,抑制脂肪酸的合成。锶又是如何改善脂代谢紊乱减轻NAFLD的呢?GRP78是内质网上的一种应激蛋白,在低糖、低氧和低Ca2+等应激状态下大量表达以维持内质网稳定。ERS首先激活UPR,活化分子伴侣GRP78,使错误折叠的蛋白进行正确折叠,并激活下游的信号分子,引起ERS相关蛋白的表达,对不能逆转和修复的细胞执行凋亡诱导程序以维持细胞内的稳态[15]。与此同时,SREBP被激活,其作为NAFLD形成过程中的关键转录调控因子,可调控胆固醇、脂肪酸和甘油三酯的合成以及脂肪细胞的分化过程[16]。肝有3种SREBP,其中SREBP-2主要参与胆固醇的合成[17]。本研究结果显示模型组GRP78和SREBP-2蛋白表达水平较高,而18 mg/L锶和36 mg/L锶组GRP78与SREBP-2蛋白表达水平降低,这表明在NAFLD动物模型存在较强的内质网应激,致使脂肪在肝脏蓄积;而在锶的作用下,GRP78和SREBP-2蛋白都出现下调表达,提示其内质网应激有所缓解,减轻肝细胞脂质沉积,改善细胞生理,从而减轻NAFLD。HMGCR是催化胆固醇合成的关键酶,其活性受多种因素调控。本研究中18 mg/L锶组、36 mg/L锶组及辛伐他汀组HMGCR蛋白表达量降低提示在锶和辛伐他汀的作用下胆固醇合成减少。辛伐他汀是很明确的HMG-CoA还原酶抑制剂[18],通过抑制体内羟甲戊二酰辅酶A还原酶活性,以阻断胆固醇的合成,也可促进LDL-C的降解。因此,我们推测锶很可能也具有与辛伐他汀类似的抑制HMG-CoA还原酶活性的作用,但具体机制有待进一步阐明。LDLr是一种位于细胞表面的单链糖蛋白膜受体,肝脏最为丰富。LDLr介导血浆中富含胆固醇酯的LDL进入胞内代谢分解,清除多余脂质,其功能异常将导致体内脂代谢紊乱。Shimano和Shimomura研究[19]发现SREBP-2在调节LDLr时起主要作用。SREBP与其裂解激活蛋白形成SCAP-SREBP复合物后被分解释放出的活性片段(nSREBP)增加LDLr与HMGCR的转录,从而调节胆固醇[20]。本研究中18 mg/L锶和36 mg/L锶组LDLr蛋白表达量均比对照组和模型组高,可见锶可通过增强LDL内吞途径促进血中TC进入胞内代谢分解,减轻脂质沉积,从而改善脂质代谢。
综上所述,较高浓度锶摄入可以改善脂代谢紊乱,减轻NAFLD,其机制可能与改善肝ERS,抑制HMGCR活性,以及增强LDLr内吞加速胆固醇的分解有关,至于锶影响NAFLD发生时的甘油三酯代谢的机制则有待进一步研究。
[1] 柳童斐,宋保亮. 胆固醇合成途径的负反馈调控机制 [J]. 中国细胞生物学学报2013,35(4): 401-409.
[2] Lewis JR, Mohanty SR. Nonalcoholic fatty liver disease: a review and update [J]. Dig Dis Sci, 2010, 55(3): 560-578.
[3] Pettinelli P, Obreqon AM, Videla LA. Molecular mechanisms of steatosis in nonalcoholic fatty liver disease [J]. Nutr Hosp, 2011, 26(3): 441-450.
[4] Rutkovski DT, Kaufman RJ. A trip to the ER: coping with stress [J]. Trends in Cell Bio1, 2004, 14(1): 20-28.
[5] 汪澍,弓慧杰,李著华. 锶矿泉水联合格列美脲对2型糖尿病大鼠血脂的影响 [J]. 黑龙江医学,2013, 37(1): 4-7.
[6] 张亚辉,周伏喜,卢放根. 大黄素对大鼠非酒精性脂肪肝及其糖脂代谢紊乱的防治作用 [J].海南医学,2013, 24(5): 636-638.
[7] 刘菲,徐源廷,任大伟,等.掺锶聚磷酸钙对成骨细胞分泌血管内皮生长因子的影响 [J].中国组织工程研究与临床康复,2009.13(47): 9269-9272.
[8] 殷健. 89锶治疗前列腺癌、乳腺癌、肺癌骨转移的临床疗效 [J]. 吉林医学,2013,34(25): 5178-5179.
[9] Pemmer B, Hofstaetter JG, Meirer F, et al.Increased strontium uptake in trabecular bone of ovariectomized calcium-deficient rats treated with strontium ranelate or strontium chloride[J].J Synchrotron Radiat,2011, 18(6): 835-841.
[10] 蔡波,张建军.氯化锶治疗骨质疏松的疗效观察 [J]. 现代中西医结合杂志 2014, 23(31): 3464-3465.
[11] 李牧, 杨佳琳, 杨庭树, 等. 微量元素锶对实验性兔动脉粥样硬化斑块形成的影响 [J]. 中国医学导报, 2012, 9(12): 17-22.
[12] Day CP. Non-alcoholic fatty liver disease: a massive problem [J]. Clin Med, 2011. 11(2): 176-178.
[13] Takahashi Y, Sugimoto K, Inui H, et al.Current pharmacological therapies for nonalcoholic fatty liver disease/nonalcoholic steatohepatitis [J].World J Gastroenterol, 2015, 21(13): 3777- 3785.
[14] 曾翠玲, 郑凌云, 邢丽英, 等. Slit2在非酒精性脂肪肝中的作用 [J]. 中国比较医学杂志, 2016, 26(5): 19-24.
[15] Adachi Y, Yamamoto K, Okada T ,et al. ATF6 is a transcription factor specializing in the regulation of quality control proteins in the endoplasmic reticulum [J]. Cell Struct Funct, 2008, 33(1): 75-89.
[16] Chen YX, Huang AL, Ruan XZ. Nuclear transcription factors and lipid homeostasis in liver [J].Chin Med J, 2007, 120(24): 2290-2296.
[17] Shimano H. SREBPs: physiology and pathophysiology of the SREBP family [J]. FEBS J, 2009, 276(3): 616-621.
[18] 徐叔云. 临床药理学(第3版) [M]. 北京:人民卫生出版社,2006:279.
[19] Shimano H, Shimomura I, Hammer RE, et al. Elevated levels of SREBP-2 and cholesterol synthesis in livers of mice homozygous for a targeted disruption of the SREBP-1 gene [J]. J Clin Invest, 1997, 100(8): 2115-2124.
[20] 范丽娟,李仲. LDL受体介导的血浆低密度脂蛋白胆固醇的内吞 [J]. 生命的化学, 2014, 34(3): 329-336.
Mechanism of the trace element strontium on alleviating non-alcoholic fatty liver disease in rats
JIANG Hui-ling1, GUAN Qiao-wei1, GONG Lin2, XIAO Ye-wei1, YU Guang1, FENG Zhi-qiang1, PAN Qiang-wen1
(1.Department of physiology, Southwest Medical University, Sichuan Luzhou, 646000 China; 2. Morphology Experimental Center, Southwest Medical University, Sichuan Luzhou, 646000)
Objective To investigate the mechanism of trace element strontium on alleviating non-alcoholic fatty liver disease (NAFLD) in rats. Methods Fifty SD rats were randomly divided into five groups. The control group was fed with ordinary diet and the other four groups were fed with a high fat diet. From the 6th week, rats in the strontium 18 mg/L and 36 mg/L groups were fed with water with strontium in concentration of 18 mg/L and 36 mg/L respectively. These two groups were separately given strontium water (3 mL/kg b.w.) by gavage from the 11th week, while the Simvastatin group was given simvastatin (10 mg/kg b.w.) by gavage from the 11th week. Rats in other groups were given matching normal saline by gavage at the same period. The rats were killed and the TG, TC, LDL-C levels in their serum and the TG, TC levels in the liver were detected at the end of the 14th week. The lipid accumulation in the liver tissue was observed using oil red O staining. The protein expression levels of GRP78, SREBP2, HMGCR and LDLr in the liver tissue were assessed with immunohistochemical staining. Results The levels of serum TC, LDL-C and liver TC, TG in the NAFLD group were significantly higher than that of the control group (P<0.05). The levels of serum TC, LDL-C and liver TC, TG in the strontium 36 mg/L group were significantly lower than that of the NAFLD group (P<0.05). ORO staining showed that lipid accumulation in liver increased abnormally in the NAFLD group compared with the control group, while the lipids accumulation in the liver decreased obviously in the strontium 18 mg/L group, 36 mg/L group and simvastatin group compared with the NAFLD group to a different degree. Immunohistochemical staining showed that the protein expression levels of GRP78, SREBP2, HMGCR and LDLr in the NAFLD group, those of GRP78, SREBP2 and LDLr in the strontium 18 mg/L group, those of LDLr in the strontium 36 mg/L group and those of SREBP2 and LDLr in the Simvastation group significantly increased compared with those of the control group (P<0.05). The protein expression levels of GRP78, SREBP2 and HMGCR in the strontium 36 mg/L group decreased obviously compared with those of the NAFLD group, while those of LDLr in the strontium 36 mg/L group increased compared with those of the NAFLD group (P<0.05). The protein expression levels of GRP78 and HMGCR in the simvastatin group decreased compared with the NAFLD group(P<0.05). The protein expression levels of GRP78, SREBP2, HMGCR and LDLr in the strontium 18 mg/L group had no significant difference compared with the NAFLD group (P>0.05). Conclusions Intake of trace element strontium at high concentration for long time can alleviate the disorder of lipid metabolism and non-alcoholic fatty acid liver disease (NAFLD) in rats. Its mechanism is probably related to its adjusting of endoplasmic reticulum stress, the activity of HMGCR and the function of LDLr.
Strontium; Non-alcoholic fatty liver disease; Endoplasmic reticulum stress; Hydroxymethyl glutaryl CoA reductase; Low-density lipoprotein receptor
四川省教育厅(16ZB0198)。
姜慧玲(1991-),女,硕士研究生,从事代谢紊乱与器官损害研究,E-mail: 569135645@qq.com。
盘强文(1971-),男,教授,从事代谢紊乱与器官损害研究,E-mail: qwpan@swmu.edu.cn。
R-33
A
1671-7856(2017) 02-0007-08
10.3969.j.issn.1671-7856. 2017.02.002
2016-06-18
