小鼠脾脏间充质干细胞调节T淋巴细胞的增殖与活化
2017-03-13张海宏韩冬梅王志东郑晓丽闫洪敏郭子宽王恒湘
丁 丽,朱 恒,张海宏,杨 洋,韩冬梅,王志东,郑晓丽,董 磊, 闫洪敏,刘 静,朱 玲,薛 梅,郭子宽,王恒湘
(1. 中国人民解放军空军总医院血液科,北京 100142;2. 军事医学科学院基础医学研究所,北京 100850;3. 中国人民解放军空军总医院普外科,北京 100142; 4. 军事医学科学院放射与辐射医学研究所,北京 100850)
研究报告
小鼠脾脏间充质干细胞调节T淋巴细胞的增殖与活化
丁 丽1,朱 恒2,张海宏3,杨 洋1,韩冬梅1,王志东1,郑晓丽1,董 磊1, 闫洪敏1,刘 静1,朱 玲1,薛 梅1,郭子宽4,王恒湘1
(1. 中国人民解放军空军总医院血液科,北京 100142;2. 军事医学科学院基础医学研究所,北京 100850;3. 中国人民解放军空军总医院普外科,北京 100142; 4. 军事医学科学院放射与辐射医学研究所,北京 100850)
目的 研究小鼠脾脏间充质干细胞(Sp-MSCs)对T淋巴细胞增殖与活化的调节作用。方法 采用组织块法从小鼠脾脏中分离培养出Sp-MSCs,并做多向诱导分化实验。分离小鼠T淋巴细胞,开展淋巴细胞转化试验和混合淋巴细胞反应,分别检测Sp-MSCs对于非特异抗原和同种异体抗原活化的T淋巴细胞的影响。以CFSE流式法检测Sp-MSCs对活化的T淋巴细胞增殖的影响。采用定量PCR分析Sp-MSCs对T淋巴细胞表达的炎性细胞因子的影响。结果 流式检测结果显示Sp-MSsC可以抑制非特异抗原和同种异体抗原引起的T淋巴细胞增殖。Sp-MSCs能够有效抑制淋巴细胞转化试验和混合淋巴细胞反应引起的细胞活化。进一步分析发现,Sp-MSCs抑制T淋巴细胞表达干扰素γ,肿瘤坏死因子α和白细胞介素17A。结论 Sp-MSCs能够抑制T淋巴细胞增殖与活化,抑制T淋巴细胞表达多种炎性细胞因子。
脾脏间充质干细胞;T淋巴细胞;增殖;活化;炎性细胞因子
间充质干细胞(mesenchymal stem cells, MSCs)是一种最早在骨髓中发现的非造血谱系的干细胞[1,2],随后亦在骨、脐带和脂肪等组织中有发现。MSCs不仅具有干细胞的共性,同时也具有自身的特性。MSCs像大多数干细胞一样,具有多向分化和自我更新能力。更重要的是,MSCs是目前已知的多种干细胞中,较为确定地具有免疫调节能力的一类干细胞[3]。相关研究表明, MSCs可以调节多种免疫细胞如巨噬细胞、T淋巴细胞、B淋巴细胞、树突状细胞和中性粒细胞等发育分化和凋亡,有助于维持机体免疫反应和免疫稳态[3]。此外,MSCs还调节多种免疫细胞的功能,避免过度的机体免疫应答[3]。目前的研究结果表明,MSCs主要通过表达细胞间粘附分子(如细胞间粘附分子1和内皮细胞粘附分子1)、释放一些重要的细胞因子和活性物质以及释放膜微粒等形式来发挥免疫调控作用。
脾脏是人和动物体内最大的外周免疫器官[4,5]。脾脏内含有多种免疫细胞如巨噬细胞、T淋巴细胞、B淋巴细胞、树突状细胞和中性粒细胞等,是免疫细胞发育和成熟的重要器官之一,更是机体的体液免疫中心和细胞免疫。脾脏内免疫细胞的发育功能要受到脾脏微环境的调控。多种基质细胞混合组成的脾脏基质组织既为免疫细胞发育提供了空间依托,又表达多种活性分子调节免疫细胞功能,是脾脏微环境的重要组成部分[4,5]。因此,脾脏基质组织内细胞对于免疫细胞发育和功能的调控一直是免疫学研究的热点之一[6,7]。但是,以往的研究多关注于脾脏内皮源性基质细胞和成纤维细胞等成体细胞的作用,对于处于发育源头的脾脏间充质干细胞(spleen mesenchymal stem cells, Sp-MSCs)是否参与免疫调控,国内外文献报道不多。基于此,我们依靠前期工作建立的胶原酶消化联合组织块培养法(待发表数据),分离获得了大量细胞纯净度较高的小鼠Sp-MSCs。在此可靠的细胞模型基础之上,本研究着重关注了Sp-MSCs对非特异抗原和同种异体抗原活化的T淋巴细胞增殖和活化的影响。
1 材料和方法
1.1 实验动物
健康BALB/cl和C57BL/6 小鼠,雌雄不限,6~8周龄,购自维通利华实验动物技术有限公司(北京)(动物生产许可证号SCXK: 京2012-0001)。
1.2 主要试剂与仪器
干细胞培养专用胎牛血清,磷酸盐缓冲液(PBS),高糖DMEM培养基以及α-MEM 培养基均为美国Gibco公司产品;II型胶原酶,胰酶,磷酸化维生素C,β-磷酸甘油,地塞米松,3-异丁基-1-甲基黄嘌呤(IBMX),胰岛素,碱性磷酸酶试剂盒,油红O 染液,荧光染料CFSE,刀豆蛋白A(Con A),定量PCR试剂盒为美国Sigma 公司产品;RNA提取和逆转录试剂购自大连宝生物公司;尼龙毛,细胞培养板和培养瓶为美国康宁公司产品;流式细胞仪为美国Becton Dickinson 公司产品;细胞培养箱为英国 Thermo 公司产品;倒置显微镜为日本Olympus 公司产品。
1.3 Sp-MSCs的分离培养
无菌条件下以注射器柄将脾脏碾碎,以0.1%的II型胶原酶液消化获得的基质组织1 h,将消化后的基质组织种入Sp-MSCs培养体系内(含有10%血清的α-MEM),3 d首次换液。待Sp-MSCs 爬满培养瓶后,以胰酶消化传代,取第3~6 代细胞用于相关实验。
1.4 Sp-MSCs的分化能力鉴定
参照以往建立的方法进行[8]。取第4 代Sp-MSCs,种于24孔培养板中(5× 104/cm2),加入成骨诱导体系:含有10%胎牛血清的高糖DMEM培养基,地塞米松( 10-7mol /L),β 磷酸甘油( 10 mmol /L)和维生素C 磷酸盐( 50 μmol /L)。诱导7 d进行碱性磷酸酶染色。取第4 代Sp-MSCs,种于24孔培养板中(3× 104/cm2),加入成脂肪诱导体系:含有10%胎牛血清的高糖DMEM培养基,IBMX ( 0.5 μmol /L),地塞米松( 10- 6mol /L)和胰岛素( 10 ng/mL)。诱导7 d后进行油红染色。
1.5 小鼠T淋巴细胞分离
参照以往发表的方法进行[9]。无菌条件下以注射器柄碾磨鼠脾脏,将获得的粗制细胞悬液过200目钢筛去除团块,再以Ficoll分离液以800 g离心20 min,从而得到混合的脾脏免疫细胞;以PBS洗净,将脾脏免疫细胞过填充有尼龙毛的50 mL注射器,收获的不贴附的细胞即为T淋巴细胞,流式检测CD3细胞比例高于于80%后用于下一步实验。
1.6 CSFE法标记T淋巴细胞
用于流式分析的T淋巴细胞需要用荧光染料CFSE标记。简言之,小鼠T淋巴细胞以含有2%胎牛血清的PBS调整为1× 107mL,加入CFSE (10 μM),避光染色20分钟,以大量含有血清的PBS重悬,洗涤,终止染色。 标记过的T淋巴细胞用于后继实验。1.7 淋巴细胞转化实验(lymphocyte transformation test,LTT)和混合淋巴细胞反应(mixed lymphocyte reaction,MLR)
进行流式分析的T淋巴细胞需预先进行CFSE标记。LTT参照以往的方法开展[2]。T淋巴细胞的密度调整为1 × 106ml,加入Con A (2 μg/mL),不同的实验组添加或者不添加Sp-MSCs共培养,48 h后拍照。收集悬浮的T淋巴细胞上流式分析。MLR则是把小鼠T淋巴细胞加入照射过的同种异基因的小鼠T淋巴细胞混合培养(如BALB/cl小鼠和C57BL/6小鼠的T淋巴细胞),比例为10:1。不同的实验组加入或者不加入Sp-MSCs共培养,48 h后拍照,收集悬浮的T淋巴细胞上流式分析。
1.8 T淋巴细胞表达的免疫因子检测
进行定量PCR分析的T淋巴细胞无需进行CFSE标记。简言之,收集LTT和MLT实验中的各组T淋巴细胞,以PBS洗涤,以氯仿法提取RNA,逆转录后用做定量PCR的模板。引物序列为:小鼠干扰素γ(IFN-γ):上游序列- 5′-CTCATGGCTGT TTCTGGCTGTTA-3′,下游序列5′-GACGCTTATGTT GTTGCTGATGG-3′;小鼠肿瘤坏死因子α(TNF-α): 上游序列5′-CACTTGGTGGTTTGCTACGA-3,下游序列5′-GCCTCCCTCTCATCAGTTCTA-3′;小鼠白细胞介素17A(IL-17A):上游序列5′-TCCAGAAGGCCC TCAGACTA-3′,下游序列5′- AGCATCTTCTCGACC CTGAA-3′, 内参GADPH上游序列5′-AAACCCATC ACCATCTTCCA-3′,下游序列5′-GTGGTTCACACC CATCACAA-3′。
1.9 统计学方法
实验结果以SPSS 16.0软件分析,数据以均值方差表示,以Studentttest 分析,P值小于0.05为统计学意义,P< 0.05 ,P< 0.01。
2 结果
2.1 小鼠Sp-MSCs 抑制T淋巴细胞增殖
如图1A和1B所示,组织块法分离获得的小鼠Sp-MSCs具有经典的MSCs成纤维状细胞的形态特点,成骨诱导分化后磷酸酶染色阳性,提示其具有成骨分化能力(图1C),成脂肪诱导后油红O染色后可见脂肪滴被染料染为红色(图1D)。以上结果表明本研究所用的干细胞的确为MSCs。
CFSE是一种可以掺入细胞的荧光染料,随着细胞增殖分裂,细胞所携带的荧光强度逐渐降低[2]。细胞增殖的速度越快,其荧光强度衰减地越快[2]。在LTT中,T淋巴细胞受到Con A刺激之后,增殖迅速,荧光强度衰减明显,而Sp-MSCs存在时,T淋巴细胞衰减的速度明显减慢,表明T淋巴细胞增殖受到了抑制(图2A)。在MLR中,同种异基因抗原也促使T淋巴细胞显著增殖。与LTT结果相似,Sp-MSCs表现出了抑制T淋巴细胞增殖能力(图2B)。
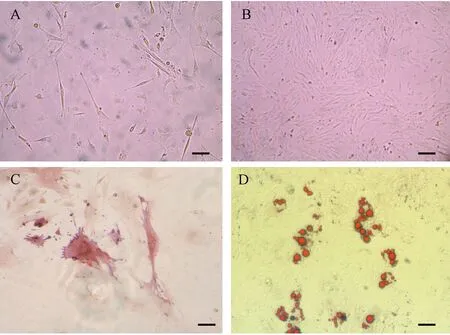
A为原代Sp-MSCs,B为快速增殖的Sp-MSCs, C为Sp-MSCs成骨分化后碱性磷酸酶染色阳性,D为Sp-MSCs成脂肪分化后油红O染色阳性(标尺=200 μm)图1 Sp-MSCs及其成骨和成脂肪分化(A) primary Sp-MSCs; (B) Highly proliferating Sp-MSCs; (C) ALP-staining for osteogenically differentiated Sp-MSCs; (D)Oil-red-O staining for adipogenically differentiated Sp-MSCs (Bar=200 μm)Fig.1 Primary culture and the osteogenic and adipogenic differentiation of Sp-MSCs
2.2 小鼠Sp-MSCs 抑制非特异性抗原诱导的T淋巴细胞活化
Con A是一种非特异抗原,具有强大的活化T淋巴细胞能力[9]。如图3A所示,Con A刺激后, T淋巴细胞显著活化,聚集成巨大的细胞团块,而有Sp-MSCs存在时,这种活化作用受到显著抑制,大多数T淋巴细胞为松散的单个细胞或者小细胞团(图3B),以上结果表明小鼠Sp-MSC 可抑制非特异性抗原诱导的T淋巴细胞活化。
2.3 小鼠Sp-MSCs 抑制同种异基因抗原诱导的T淋巴细胞活化
除了非特异性抗原之外,同种异基因抗原同样可以活化T淋巴细胞。如图4A所示,同种异基因的T淋巴细胞混合在一起之后,T淋巴细胞显著活化,培养皿中可见多个巨大的细胞团块,而 Sp-MSCs则可以显著抑制这种活化作用。培养皿中的T淋巴细胞无法聚合为大细胞团块,更多地变现为为松散小细胞团(图4B)。此结果表明小鼠Sp-MSCs 可抑制同种异基因抗原诱导的T淋巴细胞活化。
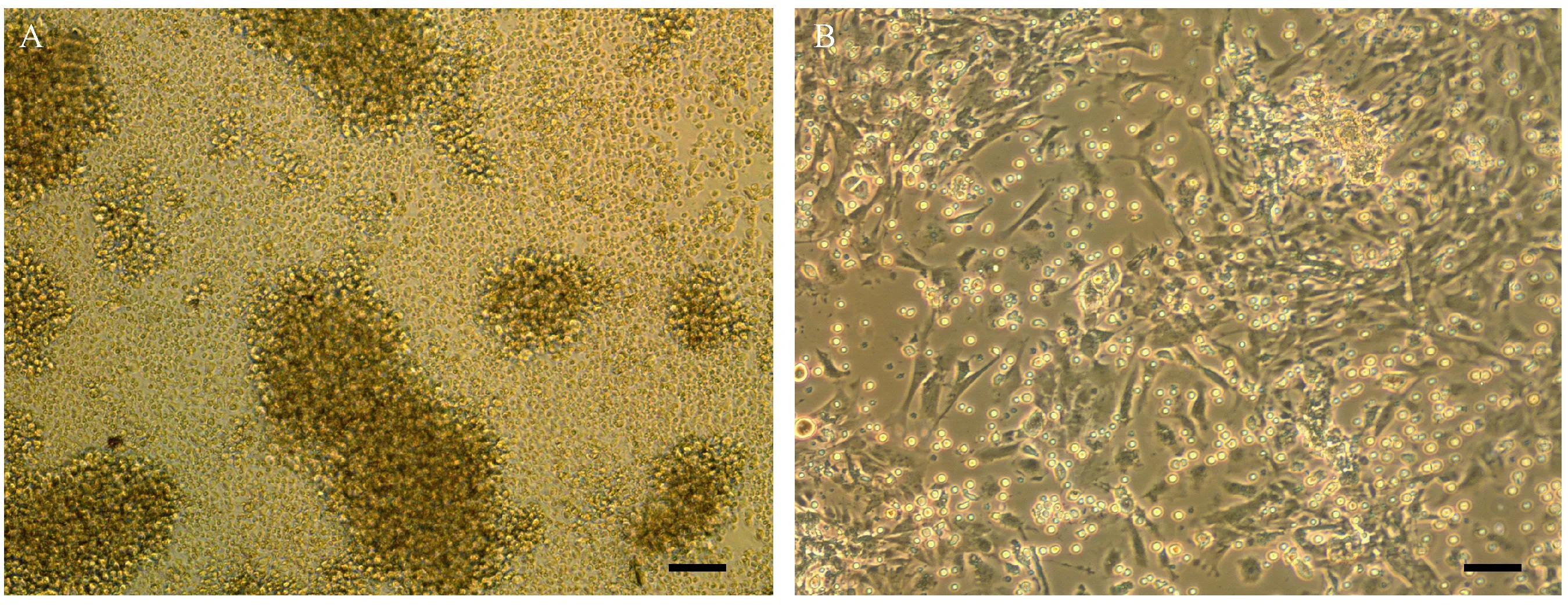
A为Con A刺激引发T淋巴细胞活化,B为Sp-MSCs抑制CoA诱导的T淋巴细胞活化(标尺=200μm)图3 Sp-MSCs抑制非特异抗原诱导的T淋巴细胞活化(A) Con A-induced T lymphocyte activation; (B) Sp-MSCs suppressed Con A-induced T lymphocyte activation. Bar=200 μm.Fig.3 Sp-MSCs suppressed non-specific antigen-induced T lymphocyte activation
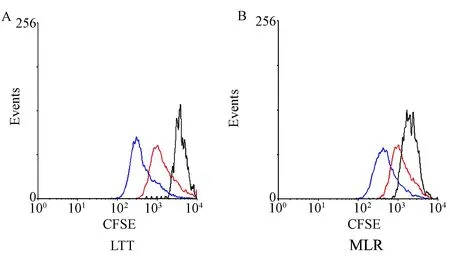
A为Sp-MSCs抑制LTT实验,B为Sp-MSCs抑制MLR反应。黑色峰代表的是未增殖的T淋巴细胞,蓝色峰代表的是加入了Con A或者异基因抗原的刺激后,显著增殖的T淋巴细胞,红色峰代表的是Sp-MSCs抑制相应的T淋巴细胞增殖。图2 Sp-MSCs抑制T淋巴细胞增殖(A) Sp-MSCs suppressing LTT. (B) Sp-MSCs suppressing MLR. The black empty flags represent low proliferative T lymphocytes. The blue empty flags represent high proliferative T lymphocytes, and the red empty flags indicate that the proliferation of T lymphocytes, suppressed by Sp-MSCs, respectively.Fig.2 Sp-MSCs suppressed the proliferation of T lymphocytes
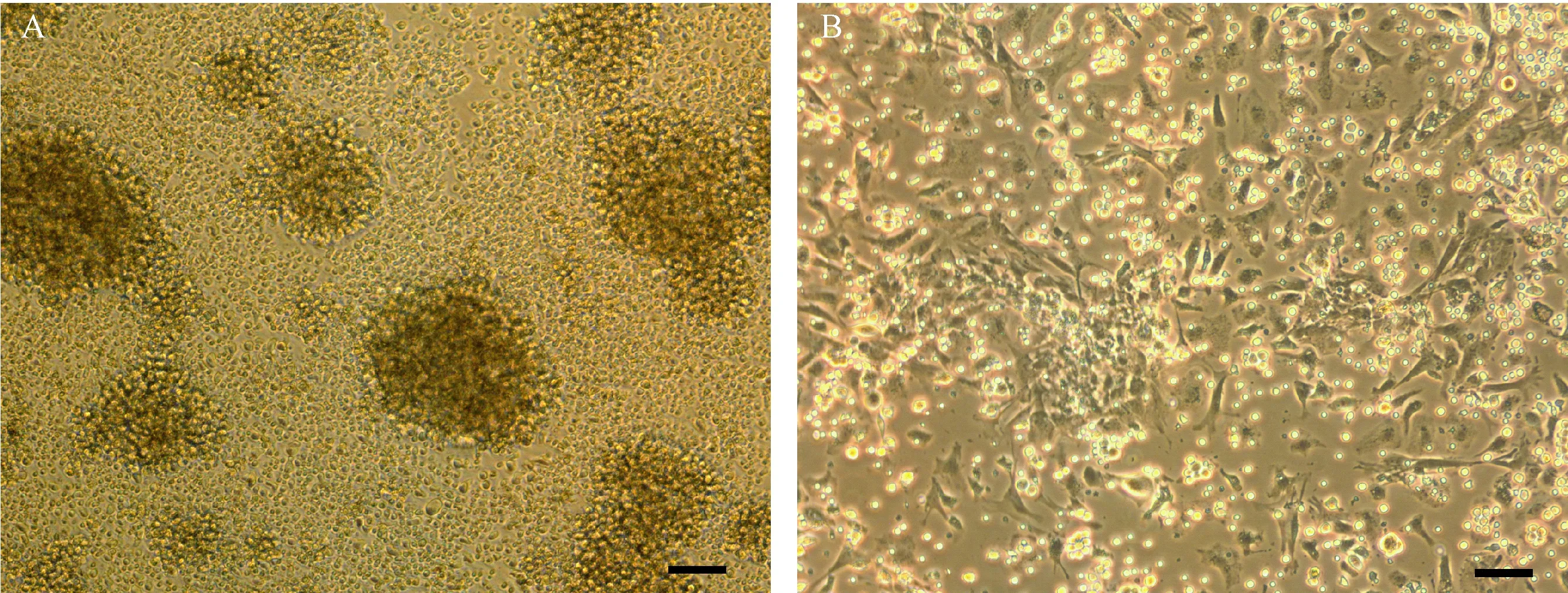
A为同种异基因的抗原刺激引发T淋巴细胞活化,B为Sp-MSCs抑制同种异基因抗原诱导的T淋巴细胞活化(标尺=200μm)。图4 Sp-MSCs抑制同种异基因抗原诱导的T淋巴细胞活化(A) Allogeneic antigen-induced T lymphocyte activation; (B) Sp-MSCs suppressed allogeneic antigen-induced T lymphocyte activation. Bar=200 μm.Fig.4 Sp-MSCs suppressed allogeneic antigen-induced T lymphocyte activation
2.4 小鼠Sp-MSCs抑制T淋巴细胞表达炎性细胞因子
为进一步观察Sp-MSCs对T淋巴细胞的免疫功能影响,我们用定量PCR检测了各组T淋巴细胞表达的炎性细胞因子的水平。如图5和图6所示,加入Sp-MSCs上可显著抑制LTT和MLR实验中T淋巴细胞内IFN-γ和TNF-α的表达。有意义的是,与LTT相比,Sp-MSCs抑制MLR中IL-17A的作用更强(图5和图6)(*P<0.05 ,**P<0.01.)。该结果提示,Sp-MSCs对于不同抗原活化的T细胞调节能力可能存在差异。
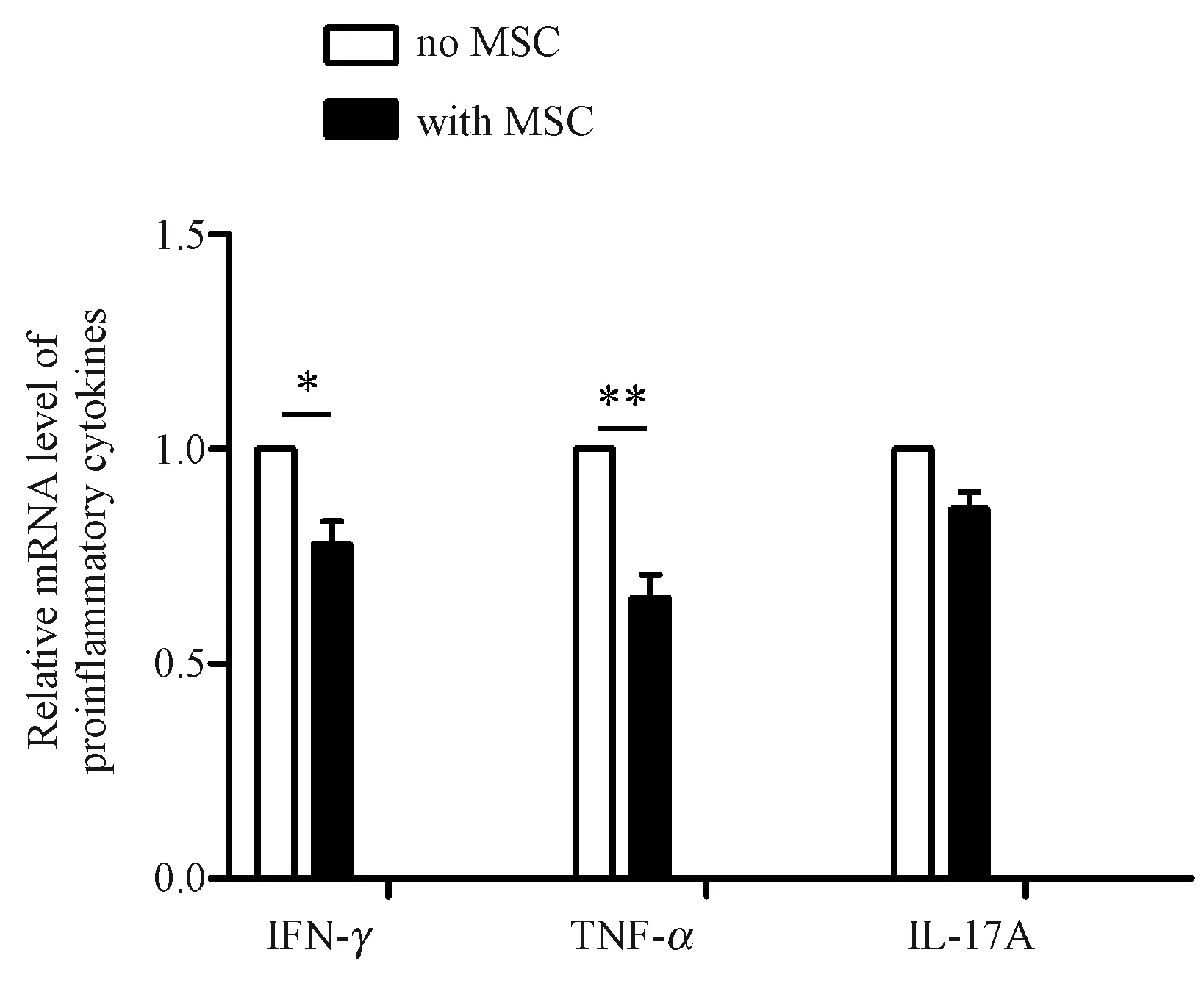
图5 Sp-MSCs抑制非特异抗原活化的T淋巴 细胞表达炎性细胞因子Fig.5 Sp-MSCs suppressed the expression of non-specific antigen-induced proinflammatory cytokines.
3 讨论
Friedenstein等[1]研究骨髓造血时,意外地发现骨髓中除了造血干细胞之外还存在有另外一类非造血干细胞,随后这种类似成纤维细胞样的干细胞被命名为MSCs[3]。后继的研究表明,MSCs并不仅存在骨髓中,骨、脂肪、脐带等多种组织也存在着MSCs。近年来,MSCs被发现可以调控多种免疫细胞的发育和功能。
基于此,MSC已经被应用于治疗移植物抗宿主病、类风湿性关节炎和系统性红斑狼疮等疾病,并取得了满意的效果[3]。

图6 Sp-MSCs抑制同种异基因抗原活化的T淋巴细胞表达炎性细胞因子Fig.6 Sp-MSCs suppressed the expression of allogeneic antigen-induced proinflammatory cytokines.
Sp-MSCs是脾脏微环境的重要组成部分,其在空间结构上与多种免疫细胞紧密相邻,但是目前有关其免疫调节能力的报道却不多。T淋巴细胞是免疫细胞的重要组成部分,既参与细胞免疫,又连接体液免疫,其发育和功能的改变对于维持机体免疫功能极为重要[10]。本研究基于前期建立的可靠细胞模型开展了Sp-MSCs调节T淋巴细胞相关研究。我们发现,Sp-MSCs可以显著抑制T淋巴细胞的增殖和活化。这种抑制作用具有广谱性,即Sp-MSCs不仅抑制非特异抗原引起的T淋巴细胞增殖与活化,而且抑制同种异基因引起的T淋巴细胞增殖与活化。 但是,我们同时注意到,Sp-MSCs对于不同抗原活化后的T淋巴细胞分泌功能具有差异性调节作用。一般认为,IFN-γ和TNF-α多由Th1调节亚群的T淋巴细胞分泌。IL-17A是IL-17家族的重要一员,多有Th17调节亚群分泌,与慢性aGVHD和类风湿性关节炎等自身免疫性疾病密切相关。本研究中, Sp-MSCs对于非特异抗原和同种异基因抗原诱导的IFN-γ和TNF-α表达均具有强大的抑制作用,提示其抑制Th1调节亚群的活化和功能。有趣的是,Sp-MSCs对于同种异基因抗原诱导的IL-17A表达具有良好的抑制作用,而对于非特异抗原诱导的IL-17A表达虽然具有抑制作用,但是没有统计学差异,提示其调节相应T淋巴细胞中T h17 亚群的能力较弱。其内在的机制不明,仍有待于进一步的研究[11]。此外,本研究主要基于体外实验开展,相关发现亦需在体内和不同的动物模型水平进一步验证。
通过本研究,我们发现了小鼠Sp-MSCs能够抑制T淋巴细胞增殖与活化,抑制T淋巴细胞表达多种炎性细胞因子,并且这种调节能力存在差异性。
[1] Friedenstein AJ, Chailakhyan RK, Latsinik NV, et al. Stromal cells responsible for transferring the microenvironment of the hemopoietic tissues. Cloning in vitro and retransplantation in vivo [J]. Transplantation, 1974;17(4): 331-340.
[2] Ding L, Zhu H, Yang Y, et al. Functional mesenchymal stem cells remain present in bone marrow microenvironment of patients with leukemia post-allogeneic hematopoietic stem cell transplant [J]. Leuk Lymphoma, 2014; 55(7): 1635-1644.
[3] Uccelli A, Moretta L, Pistoia V. Mesenchymal stem cells in health and disease [J]. Nat Rev Immunol, 2008; 8(9): 726-736.
[4] McGaha TL, Karlsson MC. Apoptotic cell responses in the splenic marginal zone: a paradigm for immunologic reactions to apoptotic antigens with implications for autoimmunity [J]. Immunol Rev. 2016, 269(1): 26-43.
[5] Tan JK, O’Neill HC. Concise review: Dendritic cell development in the context of the spleen microenvironment [J]. Stem Cells. 2007, 25(9): 2139-2145.
[6] Zhang M, Tang H, Guo Z, et al. Splenic stroma drives mature dendritic cells to differentiate into regulatory dendritic cells [J]. Nat Immunol. 2004, 5(11): 1124-1133.
[7] Tang H, Guo Z, Zhang M, Wang J, et al. Endothelial stroma programs hematopoietic stem cells to differentiate into regulatory dendtritic cells through IL-10 [J]. Blood. 2006, 108(4): 1189-1197.
[8] Zhu H, Guo ZK, Jiang XX, et al. A protocol for isolation and culture of mesenchymal stem cells from mouse compact bone [J]. Nat Protoc, 2010, 5(3): 550-560.
[9] Guo ZK, Li H, Li XS, et al. In vitro characteristics and in vivo immunosuppressive activity of compact bone-derived murine mesenchymal progenitor cells [J]. Stem Cells, 2006, 24(4): 992-1000.
[10] Liu Z, Fan H, Jiang S. CD4(+) T-cell subsets in transplantation [J]. Immunol Rev 2013, 252: 183e91.
[11] Wang Y, Chen X, Cao W, Shi Y. Plasticity of mesenchymal stem cells in immunomodulation: pathological and therapeutic implications [J]. Nat Immunol. 2014, 15(11): 1009-1016.
Modulatory effects of mouse spleen-derived mesenchymal stem cells on the proliferation and activation of T lymphocytes
DING Li1, ZHU Heng2, ZHANG Hai-hong3, YANG Yang1, HAN Dong-mei1, WANG Zhi-dong1, ZHENG Xiao-li1, DONG Lei1, YAN Hong-min1, LIU Jing1, ZHU Ling1, XUE Mei1, GUO Zi-kuan4, WANG Heng-xiang1
(1. Department of Hematology, Air Force General Hospital of Chinese PLA, Beijing 100142, China; 2. Institute of BasicMedical Sciences, Beijing 100850; 3. Department of General Surgery, Air Force General Hospital of Chinese PLA, Beijing 100142; 4. Institute of Radiation Medicine, Beijing 100850)
Objective To investigate the modulatory effects of mouse spleen-derived mesenchymal stem cells (Sp-MSCs) on the proliferation and activation of T lymphocytes. Methods The mouse Sp-MSCs were isolated from mouse spleens by using explant tissue culture protocol and the cells were induced to differentiate into osteoblasts and adipocytes. The effects of Sp-MSCs on proliferation of activated T lymphocytes were determined by carboxyfluorescein succinimidyl ester (CFSE) staining assay. Furthermore, the effects of Sp-MSCs on lymphocyte transformation test (LTT) and mixed lymphocytes reaction (MLR) were observed, respectively. In addition, the mRNA expression of T cell derived proinflammatory cytokines by Sp-MSCs was detected by quantitative PCR. Results The results of CFSE assay demonstrated that Sp-MSCs suppressed ConA and allogeneic lymphocyte-induced T cell proliferation. Moreover, the Sp-MSCs were capable of suppressing LLT and MLR. Additionally, the results of quantitative PCR revealed that Sp-MSCs significantly suppressed the T cells expressing interferon-γ, tumor necrosis factor-α and interleukine-17A. Conclusions Sp-MSCs are capable of suppressing the proliferation and activation of T lymphocytes as well as the expression of T cell-derived proinflammatory cytokines.
Spleen-derived mesenchymal stem cells; T lymphocytes; Proliferation, Activation; Proinflammatory cytokines; Mouse
国家自然科学基金项目(81500083, 81371945, 81572159, 81101342);空军总医院院级课题( KZ2014023);北京市自然科学基金项目(7132133)。
丁丽 (1975-),女,博士,研究方向:干细胞与血液病学。E-mail: dingli7578@163.com。
王恒湘,硕士,主任医师,从事血液系统疾病的研究与治疗,E-mail: wanghengxiang123@aliyun.com;郭子宽,博士,研究员,主要从事转化医学研究E-mail: guozk@bmi.ac.cn;朱恒,博士,副研究员,主要从事干细胞与再生医学研究,E-mail: zhudingdingabc@163.com。
R-33
A
1671-7856(2017) 02-0015-06
10.3969.j.issn.1671-7856. 2017.02.003
2016-06-30
