神经电信号记录与刺激系统在深部脑电刺激治疗中的应用
2017-03-13李潇然仲顺安
李潇然,仲顺安
(1.北京理工大学 信息与电子学院,北京 100081)
综述与专论
神经电信号记录与刺激系统在深部脑电刺激治疗中的应用
李潇然,仲顺安
(1.北京理工大学 信息与电子学院,北京 100081)
深部脑电刺激是通过对脑部相应区域进行刺激,并记录分析神经电信号,有效分析并治疗多种神经精神障碍疾病。神经刺激器和电信号记录器是该疗法应用设备的核心。本文综述了神经电信号、刺激和记录系统的特点,介绍了系统的架构和基本单元模块,分析了深部脑电刺激在神经疾病中的应用,并对未来发展趋势做了总结。
深部脑电刺激;神经刺激器;神经信号记录器;可植入式;治疗
1 引言
通过外部电刺激对疾病进行治疗、对神经电信号的采集、并检测神经对于外部刺激的反馈,研制神经电信号的刺激、接收、采集、传输以及相应的信号分析设备是临床医学、生物医学和电子技术的热点交叉课题。神经电刺激、神经电信号分析的成果广泛应用于疾病的分析、治疗和监测等临床医学领域,对相关刺激与信号检测模块的性能要求也日益提升。
深部脑电刺激(deep brain stimulation,DBS)是多种神经精神障碍的有效治疗手段,包括药物治疗难以治愈的帕金森病(Parkinson’s disease,PD)、原发性震颤(essential tremor)、原发性肌张力障碍(primary dystonia)等[1-3]。1987年,A. Benabid发现,通过高频电刺激传递虽然毁损丘脑腹中间核(VIM),却可以使得类似震颤的情况得到改善。这种创新的治疗方法很快流行起来,因为电刺激是可逆的、可编程的,并且可以在大脑的两侧进行。这就是脑电刺激疗法的起源,即深部脑电刺激[4-5]。
DBS治疗方法主要是将电极通过立体定向技术、微电极记录技术插入大脑中特定核团,用持续的高频脉冲电刺激抑制不正常的脑核团放电,进而达到治疗效果[6];同时可通过微电极记录神经电信号,神经信号调理与刺激系统的示意图如图1所示。
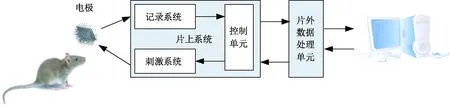
图1 神经信号调理与刺激系统示意图Fig.1 Schematic diagram of the neural signal recording and stimulation system
2 神经电信号及系统特点
2.1 神经电信号的基本特性
神经电信号主要分为局部场电位(local field potential,LFP)和动作电位(action potential,AP)或称之为“尖峰”[7-9]。 动作电位是单个神经元的放电,描述了神经系统中信息的触发。动作电位的尖峰的振幅通常低于500 μV,频率约为100 Hz~10 000 Hz。局部场电位是当神经元组织被刺激时产生一组神经元的反射和放电,这种电信号的频率较低,通常在100 Hz以下,幅度低于5 mV[10]。
2.2 系统设计特点
在实际应用中,系统需要满足的几个关键需求,比如功耗低、体积小、耐久性长、可靠性高以及尽量减少外部设备等[11-13]。为了减小在电极与组织界面处的损伤,皮质中的最大温度增加量需要小于1℃,这相当于暴露的神经组织区域的最大功率密度为0.8 mW/mm2[14];同时,低功耗也可以延长的电池寿命,增加设备使用时间。体积小、集成度高的神经接口芯片便于植入同时能降低成本。
神经刺激系统是通过在脑深部埋置刺激电极,将电刺激施加于与疾病相关的脑区内,使得神经元膜电位兴奋,并产生相应的信号响应[13]。刺激的频率、强度、脉冲宽度、波形的形状等参数可以由脑外的控制器进行控制和调整[15-16]。刺激神经组织的信号通常在几微安到几毫安的电流范围,将刺激电流注入高阻抗电极,需要较大的电压工作范围。由于长时间的直流电流和电荷积累可组织损伤,神经刺激器安全性设计的主要问题是正负电荷放电的平衡。
对于神经电信号记录应用来说,芯片在设计制作过程中,主要考虑以下几个关键问题。(1)神经电信号可以看作在较强环境噪声中的一个低频微弱的脉冲信号,摆幅大约是微伏特级,频率范围通常是从几赫兹到几千赫兹。(2)通常从电极检测到的神经电信号中混合无法消除的噪声,包括高频电磁干扰、极化电压干扰、50 Hz工频干扰、周围神经活动的干扰,以及微电极和大脑皮层接触中产生的干扰[11]。(3)微电极的阻抗高,可以达到从几千欧到几兆欧,通常Pt/PtSi电极可以达到150 kΩ到300 kΩ[9]。(4)因为电极将被植入到脑组织,大功率消耗会产生强烈的热辐射,这可能会导致永久性组织损伤[13],安全问题也是系统关键要素,很多设计都针对低功耗进行改进[17-18]。
3 系统基本架构
植入式神经电信号记录器和刺激器可分别作为一个独立的芯片,也可以组合成一个整体系统,多采用多通道设计,基本系统框图如图2所示。
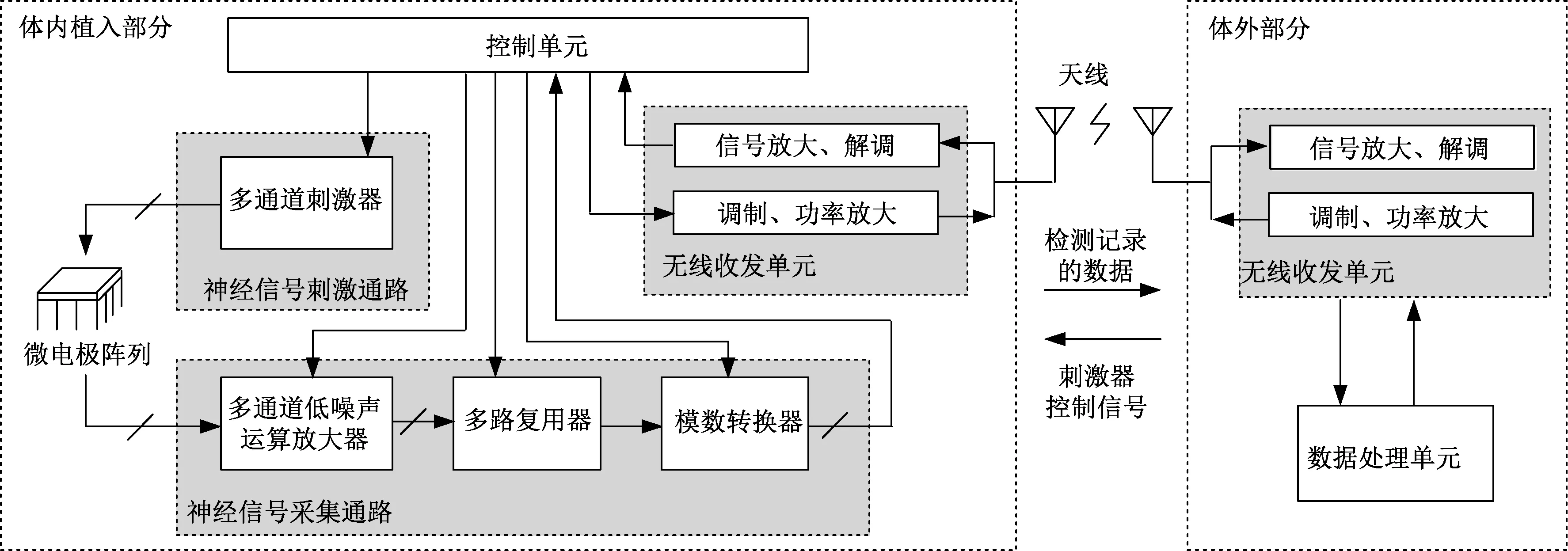
图2 植入式神经刺激器和电信号记录器系统框图Fig.2 Block diagram of the implantable neural stimulator and electrical signal recording system
刺激器主要有电流型刺激和电压型刺激两种方法。电压型刺激器是控制电极上的电压,能量效率较高,但缺点是当神经组织的阻抗发生变化时,难以准确控制放电电荷量。电流型刺激器可直接控制电极间的电流,虽然功耗相比电压刺激方法较高,由于向神经组织中放电的电荷量可直接正比于电流值,因此更方便于控制,安全性高,应用更广泛[19-21]。
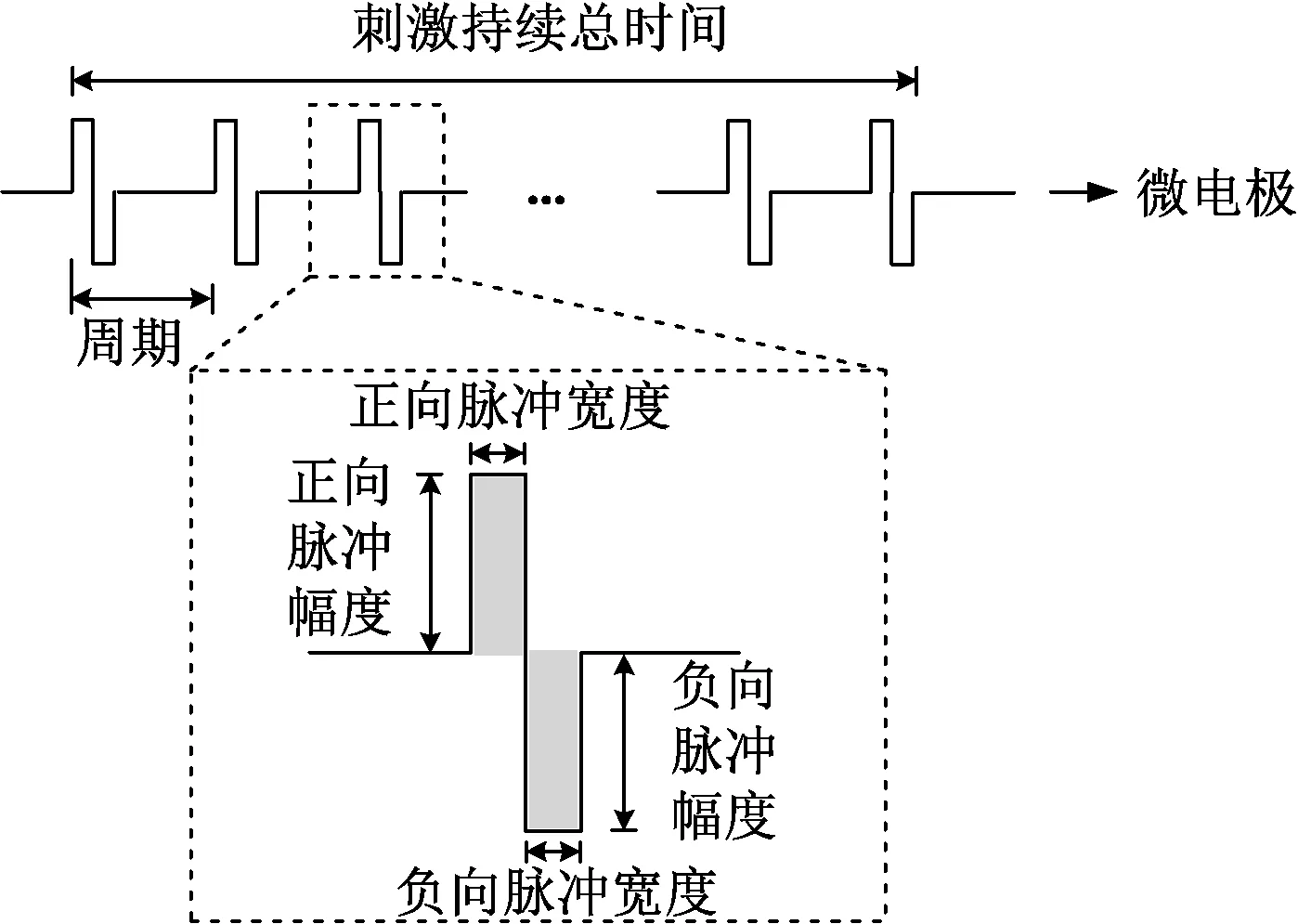
图3 双向电流刺激器脉冲示意图Fig.3 Diagram of the biphasic current stimulation pulse divice
电流型的刺激器主要由多位的电流数模转换器(digital to analog converter,DAC)构成,通过控制不同支路开关来调节放电的大小。很多刺激器设计都采用双向(biphasic)的电流刺激[13,-22-24],即一个正向脉冲放电后紧接着是等量电荷的负向脉冲,其示意图如图3所示。
神经信号记录器主要由前端的低噪声运算放大器、模数转换器(analog to digital converter,ADC)等模块构成,由于接收到的神经电信号比较微弱,需要放大器先将有用信号进行放大,避免有用信号淹没在噪声中,为了检测和处理低振幅的神经信号,高信噪比是神经记录电路的一个重要的考虑因素。然后将放大后的信号输入至后级进行处理。ADC用于将模拟信号转换为数字信号,便于信号处理电路进行分析。
为了灵活运用,减少体内植入部分和外部的连线,植入体内的部分与体外部分通常采用无线通信的方式[24-25],因此还需要无线信号收发模块对待发送的信号进行调制与放大,对接收的信号进行放大和相应模式的解调。
4 深部脑电刺激的应用
4.1 治疗帕金森病
帕金森病是常见的神经系统退行性疾病,其发病率仅次于阿尔茨海默病 60岁以上的患病率为1%~2%[1]。帕金森病的常见症状有静止性震颤、运动迟缓、姿势步态障碍、平衡困难等。病理生理学研究表明由于基底节电路的异常,导致了神经放电的速度和模式变化异常[26]。目前,除了在丘脑VIM核,治疗帕金森病主要是针对丘脑底核和苍白球进行运动症状的控制[1]。DBS用于难治性帕金森病治疗取得初步进展后,又在许多大型国际多中心临床试验中展开研究,包括美国的退伍军人管理局[27]、德国的生活质量研究[28]、英国的PD Surge实验[29],以及荷兰的NSTAPS[30]。这些试验表明,在特定情况下,DBS的治疗结果要优于药物治疗。
通过DBS控制帕金森病人的机体运动,主要是指运动症状恶化时,特别是在口服下一次剂量左旋多巴之前或有过多的运动障碍的出现。DBS治疗使得帕金森病人开关现象(on-time和off-time)的“on-time”显着增加,“off-time”减少,并使得左旋多巴诱导的运动障碍得到缓解。平均而言,运动障碍改善50%~80%,“off-time”减少约50%[1]。
4.2 治疗原发性震颤
原发性震颤是最常见的运动障碍之一,其主要表现为双臂颤抖,严重患者的日常生活。,通常采用口服药物治疗。然而大约50%的原发性震颤患者并不能通过药物改善[31]。DBS在针对VIM核丘脑的基础性震颤中成功地控制了手臂震颤,使部分患者的症状得到完全缓解[32]。在术后10~15年的长期随访中,DBS对双臂震颤的改善仍达到60%~80%[33]。
4.3 治疗肌张力障碍
肌张力障碍具有不自主性和持续性的特点,可分为原发性和继发性。药物疗法对于原发性全身性肌张力障碍功效有限[34],抗胆碱能药物、苯二氮卓类药物、巴氯芬和肉毒杆菌毒素注射是首选的治疗药物,然而症状缓解并不充分[1]。曾采用损毁术(丘脑腹外侧核和苍白球腹后部)治疗某些肌张力障碍性疾病,并取得一定疗效,但远期效果不佳。而深部脑电刺激术克服了损毁术的诸多不良反应,已成为治疗肌张力障碍的首选方案。原发性肌张力障碍患者手术效果较好,改善率可达到50%~60%。对于由外伤和药物引起的肌张力障碍(也称迟发性肌张力障碍)患者的改善也十分显著[35]。DBS方法对运动过度性肌张力障碍、肌张力障碍性震颤、舞蹈病以及某些情况下的肌阵挛(例如肌阵挛肌张力障碍综合征)效果更加明显。而对于肌张力障碍继发的关节方面的疾病似乎不能用DBS治疗改善[36]。
4.3 治疗药物难治性癫痫
癫痫在人群中的发病率约为0.5-1%,其中约1/3的患者症状不能被抗癫痫药物所控制,发展为难治性癫痫,在颞叶癫痫中难治性癫痫大于60%~70%。目前对于此部分患者主要采取手术切除癫痫灶的方案,但有40%的难治性癫痫患者为多发病灶,并不适合手术治疗,且手术常会损伤正常脑功能,有些术后还有复发可能。难治性癫痫一直是临床治疗的一个难题[15]。1978年开始将DBS应用在癫痫治疗,电刺激癫痫灶点及与癫痫密切相关的结构,如丘脑、尾状核、下丘脑后部、Papez环路的结构和小脑等部位均可抑制癫痫发作。DBS的疗效与刺激的部位、癫痫的类型以及刺激的参数密切相关。确定不同类型的癫痫所需要的最优化刺激参数和刺激靶点及刺激模式,尚需要大规模、多中心的随机双盲临床试验和Meta分析结果[15]。
此外,DBS还可用于顽固性疼痛、抽动秽语综合征、重度抑郁症等疾病的治疗。
5 结束语
DBS是治疗神经系统疾病的一个有效手段,在相关领域具有很广泛的应用前景。进一步研究方向重点为阐明作用机理、拓宽适应症、减小副作用,同时寻找更多刺激靶点;对于硬件开发工作者也提出了更加严格的性能要求,制备体积更小、功耗更低、精确度更高的神经刺激和神经电信号记录设备,从而提高临床治疗效果。
[1] Shukla AW, Okun MS. State of the art for deep brain stimulation therapy in movement disorders: A clinical and technological perspective [J]. IEEE Rev Biomed Eng, 2016, 9: 219-233.
[2] Xiao YZ, Pena E, Johnson MD. Theoretical optimization of stimulation strategies for a directionally segmented deep brain stimulation electrode array [J], IEEE Trans Biomed Eng, 2016, 63(2): 359-371.
[3] Johnson MD, Lim HH, Netoff TI, et al. Neuromodulation for brain disorders: Challenges and opportunities [J]. IEEE Trans Biomed Eng. 2013, 60(2): 610-624.
[4] Benabid AL, Pollak P, Louveau A, et al., Combined (thalamotomy and stimulation) stereotactic surgery of the VIM thalamic nucleus for bilateral Parkinson disease [J]. Appl Neurophysiol. 1987, 50: 1-6.
[5] Okun MS. Deep-brain stimulation for Parkinson’s disease [J]. New Engl J Med. 2012, 367(16): 1529-1538.
[6] 王江,伊国胜,边洪瑞, 等. 深度脑刺激的精确闭环去同步控制 [J]. 天津大学学报(自然科学与工程技术版), 2013, 46(11): 969-975.
[7] Schmale S, Knoop B, Hoeffmann B, et al. Joint compression of neural action potentials and local field potentials [C]. Asilomar Conference on Signals, Systems and Computers, 2013, 1823-1827.
[8] Venkatraman S, Elkabany K, Long JD, et al. A system for neural recording and closed-loop intracortical microstimulation in awake rodents [J], IEEE Trans Biomed Eng. 2009, 56(1): 15-22.
[9] Patterson WR, Song Y, Bull CW, et al., A microelectrode/microelectronic hybrid device for brain implantable neuroprosthesis applications [J]. IEEE Trans Biomed Eng. 2004, 51(10): 1845-1853.
[10] Perelman Y, Ginosar R. An integrated system for multichannel neuronal recording with spike/LFP separation, integrated A/D conversion and threshold detection [J]. IEEE Trans Biomed Eng. 2007, 54(1): 130-137.
[11] Wise K, Anderson DJ, Hetke JF et al. Wireless implantable microsystems: High-density electronic interfaces to the nervous system [J]. 2004, 92(1): 76-97.
[12] Bai Q, Wise KD. Single-unit neural recording with active microelectrode arrays [J]. IEEE Trans Biomed Eng. 2001, 48(8): 911-920.
[13] Ortmanns M, Rocke A, Gehrke M, et al. A 232-channel epiretinal stimulator ASIC [J]. J Solid-State Circuits, 2007, 42(12): 2946-2959.
[14] Shulyzki RS, Abdelhalim K, Bagheri A, et al. 320-channel active probe for high-resolution neuromonitoring and responsive neurostimulation [J]. IEEE Trans Biomed Circuits Syst, 2015, 9(1): 34-49.
[15] 陈忠,张世红. 深部脑刺激在神经精神疾病治疗中的应用研究进展 [J]. 浙江大学学报(医学版), 2009, 38(6): 549-558.
[16] Merrill DR, Bikson M, Jefferys JGR. Electrical stimulation of excitable tissue: Design of efficacious and safe protocols [J]. J Neurosci Meth. 2005, 141: 171-198.
[17] Mollazadeh M, Murari K, Cauwenberghs G, et al. Micropower CMOS integrated low-noise amplification, filtering, and digitization of multimodal neuropotentials [J]. IEEE Trans Biomed Circuits Syst, 2009, 3(1): 1-10.
[18] Yan L, Harpe P, Pamula VR, et al. A 680 nA ECG acquisition IC for leadless pacemaker applications [J]. IEEE Trans Biomed Circuits Syst. 2014, 8(6): 779-786.
[19] Monge M, Raj M, Nazari MH, et al. A fully intraocular high-density self-calibrating epiretinal prosthesis [J]. IEEE Trans Biomed Circuits Syst. 2013, 7(6): 747-760.
[20] Arfin SK, Sarpeshkar R. An energy-efficient, a diabatic electrode stimulator with inductive energy recycling and feedback current regulation [J], IEEE Trans Biomed Circuits Syst. 2012, 6(1): 1-14.
[21] Abdelhalim A, Jafari HM, Kokarovtseva L, et al. 64-Channel UWB wireless neural vector analyzer SOC with a closed-loop phase synchrony-triggered neurostimulator [J]. J Solid-State Circuits, 2013, 48(10): 2494-2510.
[22] Jiang D, Demosthenous A, Perkins TA, et al. A stimulator ASIC featuring versatile management for vestibular prostheses [J]. IEEE Trans. Biomed Circuits Syst. 2011, 5(2): 147-159.
[23] Sit JJ, Sarpeshkar R. A low-power blocking-capacitor-free charge-balanced electrode-stimulator chip with less than 6nA dc error for 1-mA full-scale stimulation [J]. IEEE Trans Biomed Circuits Syst. 2007, 1(3): 172-183.
[24] Lin YP, Yeh CY, Huang PY, et al., A battery-less, implantable neuro-electronic interface for studying the mechanisms of deep brain stimulation in rat models [J]. IEEE Trans Biomed Circuits Syst. 2016, 10(1): 98-112.
[25] Kiani M, Ghovanloo M, Perkins TA, et al. A 13.56-Mbps pulse delay modulation based transceiver for simultaneous near-field data and power transmission [J]. IEEE Trans Biomed Circuits Syst. 2015, 9(1): 1-11.
[26] Kopell BH, Rezai AR, Chang JW, et al. Anatomy and physiology of the basal ganglia: Implications for deep brain stimulation for Parkinson’s disease [J]. Movement Disorder, 2006, 21: S238-S246.
[27] Follett K, Weaver F, Stem M, et al. Multisite randomized trial of deep brain stimulation [J], Arch Neurol, 2005, 62(10): 1643-1644.
[28] Deuschl G, Schade-brittinger C, Krack P, et al. A randomized trial of deep-brain stimulation for Parkinson’s disease [J]. New Engl J Med. 2006, 355(9): 896-908.
[29] Williams A, Gill S, Varma T, et al. Deep brain stimulation plus best medical therapy versus best medical therapy alone for advanced Parkinson’s disease (PD SURG trial): A randomised, open-label trial [J]. Lancet Neurol. 2010, 9(6): 581-591.
[30] Odekerken VJ, Laar TV, Staal MJ, et al. Subthalamic nucleus versus globus pallidus bilateral deep brain stimulation for advanced Parkinson’s disease (NSTAPS study): A randomised controlled trial [J], Lancet Neurol., 2013, 12(1): 37-44.
[31] Lyons KE, Pahwa DR, Comella CL, et al. Benefits and risks of pharmacological treatments for essential tremor [J], Drug Safety, 2003, 26(7): 461.
[32] Favilla CG, Ullman D, Shukla AW, et al. Worsening essential tremor following deep brain stimulation: Disease progression versus tolerance [J]. Brain, 2012, 135: 1455-1462.
[33] Baizabal-Carvallo JF, Kagnoff MN, Jimenez-Shahed J, et al. The safety and efficacy of thalamic deep brain stimulation in essential tremor: 10 years and beyond [J]. J Neurol Neurosurg Psychiatry, 2014, 85(5): 567-572.
[34] Jinnah HA, Delong MR, and Hallett M, The dystonias: Past, present, and future [J], Movement Disorder, 2013, 28(7): 849-850.
[35] 张建国,马羽,胡文瀚. 帕金森病及运动障碍性疾病的脑深部电刺激术治疗研究现状 [J]. 中国现代神经疾病杂志, 2007, 7(1): 22-24.
[36] Starr PA, Turner RS, Rau G, et al. Microelectrode-guided implantation of deep brain stimulators into the globus pallidus internus for dystonia: Techniques, electrode locations, and outcomes [J]. J Neurosurg, 2006, 104(4): 488-501.
专家问答
问1: 尾静脉注射时的注意事项
答:尾静脉注射是动物试验常用的操作方法,但啮齿类动物因其体积小,尾静脉细,尾静脉注射时难度大。在操作时,应注意以下几点:
(1)动物固定:尾巴拉直,防止尾巴摆动,动物固定好是注射成功的关键。
(2)尾部静脉扩张:可以用酒精棉球擦拭尾巴,或者将尾巴泡在热水中。
(3)注射位置:一般选择啮齿类动物尾部两边的静脉,比较清楚并便于操作。
(4)注射点:注射时血管从远端向近端注射,如果太远血管太细,不好操作。
(5)避免静脉栓塞:在静脉注射时,如果有气泡产生,或在注射细胞时细胞成团,可以引起静脉栓塞,严重者可引起动物死亡。
(6)注射量:小鼠单次最大注射量为0.6 mL/只,大鼠单次最大注射量为4 mL/只,静脉推注时速度不宜过快,否则会引起动物心脏负荷增加,给动物造成伤害。
问2:动物实验中灌胃与将受试物添加到饲料中哪个更好一些?
答:在动物实验时,常需要将受试物口服给予动物。可采用动物灌胃、添加到饲料中或饮水中。对于不溶于水的受试物,常采用动物灌胃和添加到饲料中,这两种方法各有利弊。
动物灌胃:给药剂量和给药时间准确,可以保证动物在规定时间内全部服下。对操作人员技术要求高,操作不当可以造成动物窒息死亡。捉拿动物和灌胃操作时会对动物造成不适,严重时动物会抓伤咬伤操作人员。
添加到饲料中:动物自由进食,符合生理过程,没有灌胃对动物造成的不良刺激,但不能准确掌握给药剂量和给药时间,不同动物之间易造成食用差异。对照动物与给药动物可能因食物中药物存在而造成摄食量的差异。
在选择口服方法时,要综合考虑以下因素:
(1)受试物的种类:如果是药物,要准确确定给药剂量和给药时间,应采用灌胃法;如果是食品(含保健食品),尽量模拟自然界人类食用的方法,最好采用添加到饲料中。
(2)受试物的味道:如果有特殊味道,动物不愿意接受,味道影响食欲,多采用灌胃法;如果无特殊异味或味道芳香,动物喜食,可采用添加到饲料中。
(3)受试物的保存条件:如果不能常温保存,应现用现配,在规定时间内服用,只能采用灌胃法。
(4)受试物的体积:如果体积太大,不能一次灌胃,短期内可采用分次灌胃;长期服用只能添加到饲料中。
(感谢中国医学科学院医学实验动物研究所高虹研究员的解答)
Application of neuroelectrical signal recording and neural stimulation system in deep brain stimulation therapy
LI Xiao-ran, ZHONG Shun-an
(School of Information and Electronics, Beijing Institute of Technology, Beijing 100081, China)
Deep brain stimulation is a therapy that stimulates the corresponding areas of the brain, records and analyzes neural signals, and to effectively treat a variety of neuropsychiatric disorders. Neural stimulator and electrical signal recording system is the key device of this therapy. This paper reviews the characteristics of neuroelectrical signals, stimulation and recording systems, introduces the architecture and basic module of the system, analyzes the application of deep brain electrical stimulation in neurological diseases, and summarizes the future trend.
Deep brain stimulation; Neural stimulation; Neural signal recording; implantable; Therapy
李潇然(1989-),女,博士生,集成电路设计,E-mail: xiaoran.li@aliyun.com。
仲顺安(1957-),教授,博士生导师,电子科学与技术,E-mail: zhongsa@bit.edu.cn。
R-33
A
1671-7856(2017) 02-0093-05
10.3969.j.issn.1671-7856. 2017.02.017
2016-10-10
