种子或带菌土壤传播稻曲病菌的可能性研究
2017-03-10胡茂林罗来鑫李志强陈竹锋唐晓艳李华平李健强
胡茂林,罗来鑫,李志强,陈竹锋,温 凯,唐晓艳,李华平,李健强
(1.华南农业大学农学院,广东 广州 510642;2. 中国农业大学植物保护学院,北京 100193;3. 深圳市作物分子设计育种研究院,广东 深圳 518107;4. 深圳市农业科技促进中心,广东 深圳 518055)
稻曲病是由稻绿核菌(Ustilaginoidea virens)引起的水稻穗部真菌性病害[1-2],在全世界不同稻作区均有发生,且呈加重趋势[3-5]。该病害不仅降低水稻的产量,而且所产生的病菌毒素对人畜均有毒副作用,使其成为近年来备受关注的水稻病害之一[6-7]。虽然国内外学者围绕稻曲病已开展了大量的研究工作,但由于该病菌主要危害水稻穗部[8-10],自然条件下在水稻穗部呈零星、不规律发生,现有的病菌分离培养周期较长等致使研究难度相对较大。稻曲病的初侵染来源至今尚不明确,其在自然条件下如何造成穗期侵染仍无合理的解释,深入探究稻曲病菌侵染途径对于有效防控该病害具有重要意义。
早在20世纪60年代,Ikegami就对稻曲病菌的苗期侵染进行了组织学研究,结果发现,稻曲病菌可以成功侵染水稻萌发初期的幼嫩胚芽鞘,并沿着韧皮部中的筛管外表面进行扩展直至分蘖的中晚期。该研究表明稻曲菌侵染的潜在部位并不局限于花器内,且其并不像黑粉菌那样能够抵达植株茎尖部的穗原基[12-13]。Ditmore等通过细胞学观察发现,稻曲病菌可侵染水稻幼嫩的胚根,但对是否最终引发病害并无完整结论[14]。郑大伟等通过对移栽后35 d的水稻苗期样品和灌浆期病株不同组织进行检测发现,在苗期水稻的根和叶鞘组织以及灌浆期发病植株的茎组织中,均可检测到稻曲病菌[15],但由于其所采集的水稻样品生长在病圃中,其检测结果是否受到样品表面稻曲病菌残留有待进一步论证。
本研究在前期调查中发现,水稻收获脱粒时健康谷粒和稻曲病侵染的病粒常混杂在一起,稻曲球上的厚垣孢子能够污染到健康的谷粒;同时,还发现四川的水稻种子冈优188调运到河南信阳地区后稻曲病田间危害明显加重;此外,在实际生产中,发病田亦存在隔年发病的现象。基于此,我们提出“水稻种子带菌或土壤带菌是稻曲病初侵染来源”的假设。本研究通过人工接种处理土壤、水稻种子,基于稻曲病菌EGFP标记和借助超微结构观察以及激光共聚焦显微观察,以期系统探究稻曲病病菌在种子、秧苗或植株及新形成的花器、籽粒中的侵染和扩展行为,分析水稻种子、土壤带菌传播稻曲病的可能性,旨在为进一步明确稻曲病的初侵染来源及病害综合防治提供科学依据。
1 材料与方法
1.1 试验材料
增强型绿色荧光蛋白标记的稻曲病菌菌株EGFP-P3由江苏省农科院刘永锋研究员提供,其中该病菌菌丝-分生孢子混合液由室内扩繁培养获得,厚垣孢子由温室人工接种发病后收集获得;供试水稻品种甬优9号(YY9)由浙江大学胡东维教授提供,晚籼98(WX98)由湖北省远安县植保站杨守利提供;取普通稻田土,使用压力蒸汽灭菌器湿热灭菌(136℃、1 h),取样分离培养确认无稻曲病菌后作为本试验土壤。
1.2 试验方法
1.2.1 病菌培养与接种体制备 将保存于4℃冰箱的菌株取出,置于装有马铃薯蔗糖琼脂培养基(PSA)的直径9 cm培养皿上,于培养箱中28℃黑暗培养15 d,随后从稻曲病菌菌落边缘用打孔器(直径5 mm)打取菌饼6块,置于含50 mL马铃薯蔗糖液体培养基(PS)的三角瓶中,于摇床上震荡培养(120 r/min,28℃)。
1.2.2 菌丝-分生孢子混合液制备 培养7 d后分别过滤收集菌丝、分生孢子。将菌丝重新悬浮于培养滤液中,利用JYL-C022型自动搅拌机将菌丝均匀打碎,随后将分生孢子混合到菌丝片段中,利用血球计数板计算分生孢子浓度,并将菌丝-分生孢子混合液中分生孢子浓度分别调节至 4×106、2×106个 /mL,备用。
1.2.3 种子、土壤带菌处理 种子及土壤带菌处理流程见图1(封二),具体方法如下:
(1)灭菌土壤接种和水稻播种:无菌土壤接种稻曲病菌菌丝-分生孢子混合液:取灭菌土壤,将扩大培养的EGFP-P3菌丝-分生孢子混合液接种到无菌土壤中,混匀后制备为接种土壤。设置3个接种浓度处理,分别将100、400、800 mL分生孢子浓度为4.0×106个分生孢子/mL的菌丝-分生孢子混合液均匀添加到对应土样中,均匀混合制备为接种土壤。每个处理用一次性纸杯取12杯无菌土样。3个处理中,经检测1 g土样中所含分生孢子量分别为3.17×105、1.27×106、2.54×106个。另取无菌土壤添加到直径30 cm的桶中适度镇压,桶中央部位钻取出直径5 cm、深度4 cm的土柱获得空穴5个,即桶中央1个穴位点,周围4个穴位点,位点均匀分布,相互间隔约3~5 cm。将接种土样添加到该空穴中,适度镇压与花盆无菌土壤齐平后,接种土壤中央部位使用钢勺一次性挖取整勺接种土壤,形成倒锥字型深度2 cm的接种土壤播种穴位点。将经处理的无菌种子分别播种于各个穴位点,随后在其上覆盖约2 cm的接种土壤。每处理每品种种植水稻两桶,每穴5粒,共播种50粒水稻种子,试验设3个生育期重复。
无菌土壤接种厚垣孢子:人工穗期接种病菌EGFP-P3,收集稻曲球并研磨获得厚垣孢子。依据预试验结果,按照每穴均匀混合1、4、8粒稻曲球所含的厚垣孢子量接种到无菌土壤中,混匀后制备为接种土壤。设置3个接种浓度处理,每个处理使用一次性纸杯取12杯无菌土样,分别将0.75、3、6 g厚垣孢子粉添加到对应土样中制备为接种土壤。定量计算结果为:1 g稻曲病菌厚垣孢子粉包含约4.23×109个厚垣孢子,对应3个处理中1 g土壤中所含厚垣孢子量分别为 2.52×106、1.01×107、2.02×107个。将无病菌种子播种到接种土壤穴位点内,其上覆盖约2 cm的接种土壤。每处理每品种种植水稻两桶,每穴5粒,共播种50粒水稻种子,试验设3个生育期重复。
(2)水稻种子接菌与播种:接种稻曲病菌菌丝-分生孢子混合液:利用JYL-C022型自动搅拌机将液体培养7 d扩繁获得的菌丝打碎均匀,随后制备分生孢子浓度为4.0×106个/mL的菌丝-分生孢子混合液作为接种体。取适量水稻种子,浸泡在病菌混合液中,置于摇床振荡1 h(120 r/min)后取出,于无菌操作台中滤纸晾干,HITACHI S-3400N型扫描电子显微镜(Japan)观察确证表面粘附病菌后,将上述处理的水稻种子分别播种于包含无菌土壤桶中。每个水稻品种种植两桶,每穴5粒,共播种水稻种子50粒,试验设3个生育期重复。
接种稻曲病菌厚垣孢子:按照一粒稻曲球所含厚垣孢子量均匀拌1 g水稻种子,置于摇床上振荡10 min(120 r/min),使厚垣孢子粘附于种表,于无菌超净台晾干。采用土壤穴点法播种(同上),每个水稻品种种植两桶,每穴5粒,共播种水稻种子50粒,试验设3个生育期重复。
2012—2014 年接菌试验在中国农业大学可控温室进行。经上述接菌处理的水稻种子播种后,全生育期不施用任何杀菌剂,杂草、虫害防治及水肥管理均按照水稻常规栽培进行。
1.2.4 穗期接种 选择水稻破口前7 d稻穗中部接种菌丝-分生孢子混合液,其中分生孢子浓度为2×106个/mL,每穗接种量2 mL,以含50 mL马铃薯蔗糖液体培养基(PS)接种为对照。接种后温度控制在25~36℃、水稻破口前后湿度保持在90%左右。
1.2.5 扫描电镜样品制备 随机选取稻曲病菌拌种及培养滤液浸种处理的水稻种子置于含2.5%戊二醛磷酸缓冲液(50 mmol/L,pH 7.2)中固定6~8 h,随后于磷酸缓冲液中浸泡2 h,再用1%锇酸于室温条件下固定2 h,用双蒸水清洗3~4次,随后依次用梯度浓度的乙醇溶液(50%,70%,80%,90%,95%)对样品进行脱水处理,每步20 min,最后用100%的乙醇脱水处理3次,每次20 min。用乙醇与醋酸异戊酯的混合液(V/V=l/1)浸提样品30 min,再换纯醋酸异戊酯处理1.5 h,于Hitachi HCP-2上进行CO2临界点干燥,然后将样品粘在样品台上,用Eiko IB-3型离子溅射仪上进行离子溅射镀金,置于HITACHI S-3400N型扫描电子显微镜上进行扫描观察。
1.2.6 激光共聚焦荧光显微镜样品制备 于水稻发芽期(种植后5 d)、幼苗期(种植后20 d)、分蘖期、孕穗期分别选取上述不同接种处理的材料,不同阶段分别对根系、茎秆部位生长锥、孕穗期花器部位进行共聚焦荧光显微观察,观察方法如下:
(1)水稻根和茎秆部位生长锥观察:采用冰冻切片法进行,具体方法为:将适量的OCT包埋剂滴入冷冻机铝合金组织标本台上,随后将固定好的新鲜组织放置于包埋剂中心部分,一起放在徕卡CM1520型切片机操作室里的速冻台上,快速冷冻 3~5 min;利用电动马达前进刀片进行粗切,当接近组织样品时进行人工手动切片,切片厚度为 15~25 μm;使用毛笔将完整的片子平展后快速放置在干净的载玻片上待观察。每处理选取3株水稻分别对其根、茎部位生长锥进行切片,每株水稻的根、茎部位有效切片数6个。
(2)小穗花器观察:于水稻孕穗期取样,每处理选取3株稻穗,每株稻穗上随机选取6个小穗,每个小穗表面使用无菌水冲洗3次,用镊子将两片颖壳分开后,轻轻取出小穗内花器,均匀铺展于载玻片上,利用0.25%的琼脂糖封片。借助激光共聚焦扫描显微镜(Nikon D-eclipse C1,Japan),调节激发光波长至488 nm,观察组织中有无稻曲病菌存在。
1.2.7 调查统计 于稻穗成熟期,调查各处理发病状况,并统计发病率。运用SPSS软件(版本 V17.0,SPSS Inc.,Chicago,IL,USA),采用邓肯新复极差检验(DMRT,P= 0.05)与方差分析的方法进行数据分析,以综合评估不同接种处理病害发生情况。
1.2.8 PCR分子检测 于水稻成熟期取样,各处理分别随机选取水稻3株,每穗随机取10粒稻谷进行DNA提取,参照胡茂林建立的稻曲病菌检测方法[16],利用特异性引物UV279-F/UV693-R对上述提取的DNA样品进行PCR扩增和电泳分析。
2 结果与分析
2.1 接种体制备及其处理效果验证
荧光显微镜观察结果(图2,封三)显示,人工穗期接种病菌EGFP-P3,收集获得的厚垣孢子和该菌株液体扩繁培养获得的菌丝-分生孢子均发绿色荧光,说明所制备的初始接种体是具有活力的。扫描电镜观察结果(图3,封三)显示,经厚垣孢子、菌丝-分生孢子混合液拌种后,种子表面粘附大量菌体。共聚焦显微镜观察结果(图4,封三)表明,土壤及种子拌菌后,在水稻发芽期均能观察到大量菌体粘附在其根部表面,说明上述种子及土壤拌菌的方法是可行的。
2.2 稻曲病菌在水稻不同发育阶段的侵染情况分析
为探究种子及土壤带菌能否引起侵染,于水稻发芽期、苗期、分蘖期、孕穗期及抽穗期分别取样,利用激光共聚焦荧光显微观察。种子拌菌和土壤接种病菌后于发芽期取样,CLSM观察可见水稻根部有较强的绿色荧光(图4,封三),表明有大量菌体存在,但根部切片未观察到有病菌侵入寄主根部的现象。
为进一步探究在水稻生长期地上部位是否存在病菌侵染,于苗期、分蘖期分别取水稻植株生长点部位,孕穗期、抽穗期取小穗花器进行激光共聚焦荧光显微观察,结果表明,各处理均未观察到有病菌侵入。以菌丝-分生孢子拌种后水稻苗期至抽穗期观察为例(图5A,封三),苗期茎部生长点观察结果表明,接种处理(图5Aa,封三)及对照(图5Ac,封三)外侧植物自发荧光现象较强,内侧相对较少;分蘖期(图5Ab、d,封三)取样观察,除气孔边缘部位之外,其他部位无荧光现象。孕穗期、抽穗期取水稻小穗,用镊子将穗部颖壳分开,观察结果表明(图5Ae、f,封三),小穗内部及灌浆子粒纵切面均无绿色荧光。然而,孕穗至破口期对稻穗部位进行人工注射接种,在小穗花器及小穗灌浆期纵切面观察均有大量荧光(图5Ag、h,封三)。为进一步验证激光共聚焦观察结果,对各时期对应观察部位的组织器官取样,提取DNA,利用稻曲病菌基因组DNA特异引物进行PCR分析,结果表明(图5B,封三),除人工穗部接种样品扩增出阳性条带之外,其他处理均未扩增出阳性条带。
2.3 成熟期病症调查统计分析
于灌浆至成熟期对各个处理进行症状观察与结果统计。结果(表1,图6,封三)表明,水稻种子和土壤拌菌播种,成熟期穗部无典型稻曲球形成(图6A,封三)。针对晚籼98、甬优9号两个品种分别进行种子拌菌、土壤接种试验,三次生育期重复试验均未观察到典型发病症状。然而,在水稻孕穗至破口期分别进行人工穗部接种,则2个品种的穗部形成大量稻曲球(图6B,封三)。
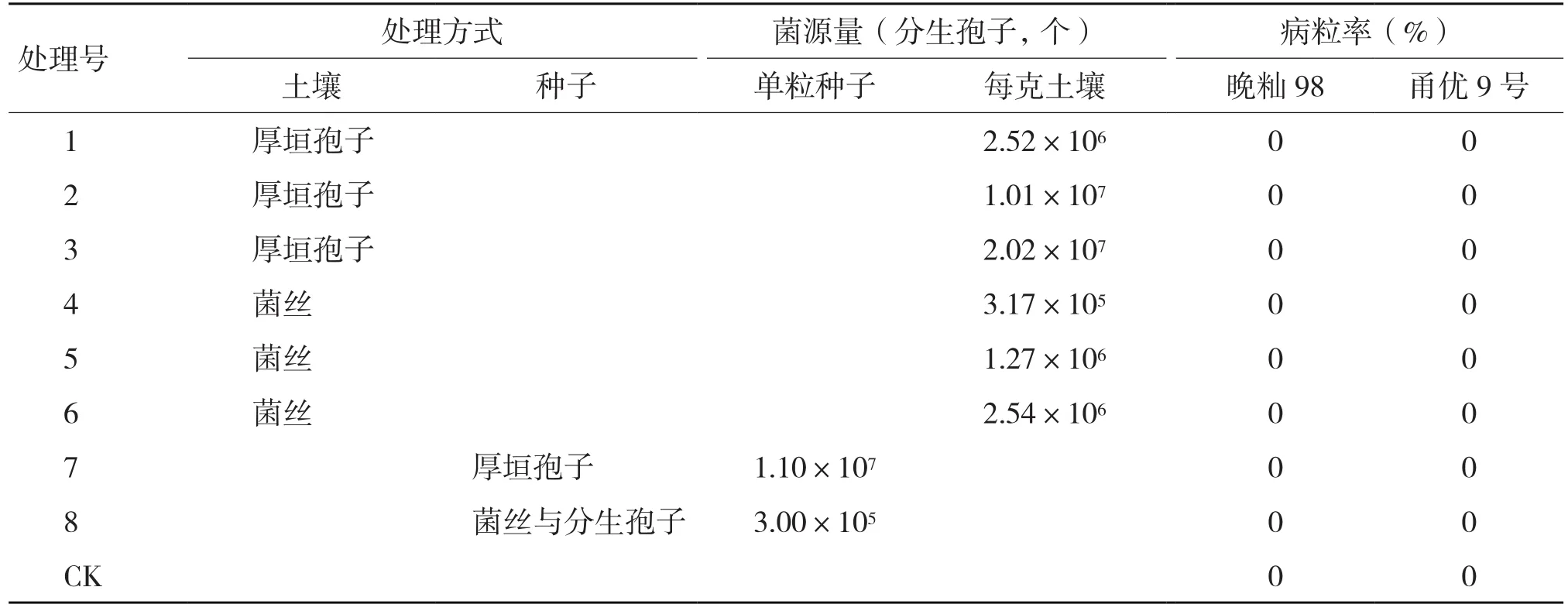
表1 不同处理水稻成熟期症状调查结果
2.4 水稻成熟期种子带菌检测验证
于水稻成熟期分别取样,用PCR方法进行种子带菌检测分析。结果表明,水稻品种甬优9号经种子拌菌及土壤接种处理后,成熟期谷粒均未检测到有病菌存在,3个生育期重复试验结果一致(图7);水稻品种晚籼98经种子拌菌及土壤接种处理后,成熟期谷粒分子检测结果与甬优9号结果相同(未显示)。

图7 对应表1中各处理成熟期种子带菌PCR检测
3 结论与讨论
本研究利用稻曲病菌不同菌体对种子及土壤进行接种,激光共聚焦观察结果显示,各处理在水稻不同生长期均未观察到有病菌侵入现象,各处理水稻成熟期均未出现症状,PCR检测亦未扩增出阳性条带,综合分析现有试验结果认为,尚不能证实稻曲病菌经由水稻幼嫩组织部位侵入并引起穗期花器发病,该结论与Li和Tang等已有研究结果一致[17-18]。尽管有报道,稻曲病能够偶发性侵染水稻幼嫩组织[12,19],但均无导致穗期发病的直接证据。
病菌初侵染来源研究是系统探究寄主与病原菌互作的关键之一。不少研究者认为,通过厚垣孢子、子囊孢子及薄壁分生孢子都可以成功接种水稻稻穗并引起发病。而厚垣孢子、子囊孢子萌发都可以产生薄壁分生孢子,因此推测,越冬后的厚垣孢子或子囊孢子萌发产生的分生孢子是稻曲病菌初侵染的主要来源。其中,厚垣孢子萌发及萌发率的高低是探究其能否作为初侵染来源的关键因素。Ikegami用稻曲病菌厚垣孢子在水稻孕穗期接种获得成功[20]。Ou认为越冬菌源产生的子囊孢子是主要的初侵染菌体来源[21]。大烟等报道,菌核可在土壤中越冬,来年夏季长出子实体,子囊壳中形成的子囊孢子则随气流及雨水飞散,落至孕穗期水稻叶鞘内而引起发病[22]。Yotsuya等报道,在低温高湿条件下,利用分生孢子在水稻孕穗期喷雾接种能够引起水稻发病[23]。张君成等通过对分生孢子的研究,推测稻田里的厚垣孢子可在水里萌发产生分生孢子并传到穗部侵染水稻[24]。尽管国内外学者对于引起稻曲病初次侵染的病菌菌体形态已有诸多报道,但对于造成稻曲病菌初次侵染的菌体来源尚无确切的实验证据。黎毓干等研究认为带菌种子是引起稻曲病发生的重要初侵染源[25]。刘见平等通过田间试验结果表明,稻曲病初侵染源主要为种子带菌,其次是土壤中越冬的病菌,但相关结果缺乏室内实验验证[26]。Ashizawa等通过检测土壤中携带稻曲病菌菌源量,推测土壤带菌可能与病害发生存在相关性[8]。自然条件下,稻曲病菌侵染主要在穗部有症状表现,同一田块零星发病,同一稻穗上形成的稻曲球在分布上亦无明显规律性,常出现稻穗的基部、上部有稻曲球形成,而中部形成健康谷粒的现象,这为人工可控条件下系统研究其侵染行为增加了难度。人工穗期接种观察表明,病菌侵入小穗内部后最初在花丝基部定殖,随后形成一些特殊的侵染结构如菌丝基座和侵染菌丝,直至侵染整个小穗[9,18]。与镰刀菌引起的小麦病害类似[27-28],水稻穗期花器的发育生长可能为稻曲病菌穗期侵染提供足够的营养,由此推测,稻曲病菌侵染具有器官专化性。
本研究在已有报道基础上,利用厚垣孢子、分生孢子及菌丝体作为接种体,通过对种子拌菌、土壤接菌设置不同浓度梯度,首次综合应用超微结构观察法、激光共聚焦显微观察法、PCR分子检测法和常规统计法,以期获得种子带菌或土壤带菌作为初侵染来源的直接证据。人工处理后,尽管种子表面或土壤中有大量稻曲病菌菌体存在,但因温室气候条件与田间实际发病条件存在一定差异以及孢子萌发率低等因素可能导致病原菌无法侵入寄主的现象,有待进一步在可控的环境下综合模拟田间适宜发病的各因素气候条件;在水稻生长期取样进行共聚焦显微观察,植物组织本身有自发荧光现象,在实际观察过程中需进行有效鉴别比较;本研究所取样品部位、取样时间及取样量均会影响观察检测结果;同时,各处理中病菌在种子表面及土壤的存活状况是否与后期侵染直接相关等,均需进一步优化并改进现有试验方法,综合考虑引起稻曲病发生的影响因素,探索适宜于厚垣孢子萌发的最佳条件,动态监测土壤中孢子萌发及病菌的存活状态,以深入探究稻曲病菌在水稻不同生育期侵染的可能性。另外,据报道,稻曲病菌菌核可安全越冬并在来年萌发产生子囊孢子,可作为来年的初侵染源[29-31]。由于本试验在温室条件下,人工接种未收集到经绿色荧光蛋白标记的菌核,难以进行土壤处理并开展水稻生育期示踪观察,因此仍需探究菌核能否作为病菌初侵染源最为直接的证据。
[1]胡东维,王疏. 稻曲病菌侵染机制研究现状与展望[J]. 中国农业科学,2012,45(22):4604-4611.
[2]Wang F,Zhang S,Liu M G,et al. Genetic diversity analysis reveals that geographical environment plays a more important role than rice cultivar inVillosiclava virenspopulation selection[J]. Applied and Environmental Microbiology,2014,80(9):2811-2820.
[3]Atia M MM. Rice false smut(Ustilaginoidea virens)in Egypt[J]. Zeitschrift fur Pflanzen kran kheiten und Pflanzenschutz,2004,111(1):71-82.
[4]Brooks S A,Anders M M,Yeater K M. Effect of cultural management practices on the severity of false smut and kernel smut of rice[J]. Plant Disease,2009,93(11):1202-1208.
[5]Sun X,Kang S,Zhang Y,et al. Genetic diversity and population structure of rice pathogenUstilaginoidea virensin China[J]. PLoS One,2013,8(9):e76879.
[6]Zhou L,Lu S,Shan T,et al. Chemistry and biology of mycotoxins from rice false smut pathogen[J]. Mycotoxins:Properties,Applications and Hazards,2012:109-130.
[7]Wang X,Fu X,Lin F,et al. The contents of ustiloxins A and B along with their distribution in rice false smut balls[J]. Toxins,2016,8(9):262.
[8]Ashizawa T,Takahashi M,Arai M,et al. Rice false smut pathogen,Ustilaginoidea virens,invades through small gap at the apex of a rice spikelet before heading[J]. Journal of General Plant Pathology,2012,78(4):255-259.
[9]Hu M,Luo L,Wang S,et al. Infection processes ofUstilaginoidea virensduring artificial inoculation of rice panicles[J]. European Journal of Plant Pathology,2014,139(1):67-77.
[10]Tang Y X,Jin J,Hu D W,et al. Elucidation of the infection process ofUstilaginoidea virens(teleomorph:Villosicla vavirens)in rice spikelets[J]. Plant Pathology,2013,62(1):1-8.
[11]Chao J,Jin J,Wang D,et al. Cytological and transcriptional dynamics analysis of host plant revealed stage-specific biological processes related to compatible rice-Ustilaginoidea virensinteraction[J]. PLoS One,2014,9(3):e91391.
[12]Ikegami H. Seedling inoculation with the chlamydospores of the false smut fungus[J].Annals Phytopathological Society of Japan,1962,27:16–23.
[13]Ikegami H. Studies on the false smut of rice X.Invasion of chlamydospores and hyphae of the false smut fungus into rice plants[J]. Res Bull FacAgric Gifu University,1963,18:54-60.
[14]Ditmore M,Moore J W,TeBeest D O.Infection of plants of selected rice cultivars by the false smut fungus,Ustilaginoidea virens,in Arkansas[J]. Arkansas Agricultural Experiment Station Research Series,2006,550:132-138.
[15]郑大伟,张艺美,尹涛,等.Ustilaginoidea virens在自然发病水稻植株体内分布情况的检测[J]. 植物病理学报,2016,46(2):145-150.
[16]胡茂林.稻曲病菌侵染水稻的行为研究[D]. 北京:中国农业大学,2014.
[17]Li H,Ni D H,Duan Y B,et al. Quantitative detection of the rice false smut pathogenUstilaginoidea virensby real-time PCR[J].Genetics and Molecular Research,2013,12(4):6433-6441.
[18]Tang Y X,Jin J,Hu D W,et al. Elucidation of the infection process ofUstilaginoidea virens(teleomorph:Villosiclava virens)in rice spikelets[J]. Plant Pathology,2013,62(1):1-8.
[19]Schroud P,TeBeest D O. Germination and infection of rice roots by spores ofUstilaginoidea virens[J]. AAES,2005,540:143-151.
[20]Ikegami H. Infection of the false smut due to inoculation with chlamydospores and ascospores at the booting stage of rice plants(studies on the false smut of rice. IV)[J]. Res Bull ForAgric Gifu University,1960,12:45-51.
[21]Ou S H. False Smut(Green Smut)//Ou SH. Rice disease[M].2nd ed. Common wealth Mycology Institute,Farnham Royal,UK,1985:307-309.
[22]大烟,贯一.稻«É じ病,作物病害事典[M].1986:22.
[23]Yotsuya,Omagari. Inoculation with conidiospores of false smut fungus to rice panicles at the booting stage[J]. Annals of the Phytopathological Society of Japan,1989,55(5):629-634.
[24]张君成,张炳欣,陈志谊,等.稻曲病菌分生孢子的生物学研究[J]. 植物病理报,2003,33(1):44-47.
[25]黎毓干.稻曲病研究测报[J]. 广东农业科学,1986 (4):45-47.
[26]刘见平,唐涛,张松柏,等.稻曲病初侵染源及病菌侵染适期初步研究[J].杂交水稻,2009,24(1):74-77.
[27]Brown N A,Urban M,Van de Meene A M L,et al. The infection biology ofFusarium graminearum:Defining the pathways of spikelet to spikelet colonisation in wheat ears[J]. Fungal biology,2010,114(7):555-571.
[28]Sella L,Gazzetti K,Faoro F,et al. A Fusar iumgraminearumxylanase expressed during wheat infection is a necrotizing factor but is not essential for virulence[J]. Plant Physiology and Biochemistry,2013,64:1-10.
[29]Sakurai M. On the causal fungus of rice false smut[J]. Annals of the Phytopathological Society of Japan,1934,3(1):70-71.
[30]Singh R A,Dubey K S. Sclerotial germination and ascospore formation of Clavicepsoryzae-sativae in India[J]. Indian Phytopathology,1984,37(2):168-170.
[31]邓启得. 菌核在稻曲病菌生活史中的作用研究[D]. 杭州:浙江大学,2015.
