德宏水牛乳饼中乳酸菌的分离鉴定及发酵性能研究
2017-03-08王昱敬黄艾祥刘雪英王馨聆
王昱敬,黄艾祥,*,刘雪英,王馨聆,郭 洁
(1.云南农业大学食品科学技术学院,云南昆明 650201;2.云南农业大学龙润普洱茶学院,云南昆明 650201)
德宏水牛乳饼中乳酸菌的分离鉴定及发酵性能研究
王昱敬1,黄艾祥1,*,刘雪英1,王馨聆1,郭 洁2
(1.云南农业大学食品科学技术学院,云南昆明 650201;2.云南农业大学龙润普洱茶学院,云南昆明 650201)
德宏水牛奶乳饼是云南特有的乳制品,微生物资源丰富,是乳酸菌的重要来源,也是分离筛选优良发酵剂的天然基础。本文采用16S rRNA基因序列分析法和纯培养法对15份水牛奶乳饼中乳酸菌种属进行分离鉴定,通过对菌株产酸、产香、发酵乳活菌计数等比较,以筛选出具有优良发酵特性的乳酸菌。结果表明:15份水牛奶乳饼样品中共分离鉴定出57株乳酸菌(3个属,6个种和1个亚种),其中Lactobacillusfermentum和Lactobacillusoris为优势菌属,占总菌属的36.84%和24.56%。57株乳酸菌发酵特性比较后得到两株优势菌株MGR3-1和MBR1-1。此研究为后续开发和应用优良发酵剂提供理论基础。
乳酸菌,分离鉴定,16S rRNA基因序列,发酵性能
乳饼是云南传统乳制品之一,以发酵乳清水为凝乳剂制作而成,其乳酸菌资源丰富。然而,这些研究中,乳饼一般以羊奶为原料,不同地域的自然环境和气候以及不同的原料奶与加工工艺,造成了不同乳饼中乳酸菌菌种的差异,不乏具有优良益生特性和生产特性的菌株。吴少雄等[1]研究表明云南撒尼地区乳饼中乳酸菌资源丰富,共分离鉴定出46株乳杆菌和27株乳球菌,并筛选出具有优良发酵特性的菌株。因此探索德宏水牛奶乳饼中的优良乳酸菌,有助于丰富乳业发酵菌种。
乳酸菌分离鉴定多采用传统微生物分离、培养和鉴定方法,此方法耗时、耗力、鉴定结果较不稳定。运用16S rRNA基因序列分析技术结合传统培养法,使得实验结果更加科学、客观和可信。这两种方法在传统发酵乳的乳酸菌多样性分析中已有成功报道[2]。研究表明,乳制品中的乳酸菌具有产酸、产香等优良生产性能[3],其中徐成勇等[4]以酸度筛选出优良的乳酸菌菌株。乳酸菌产酸是生产优质酸奶的关键,李延华等[5]通过对发酵乳的风味成分分析,筛选出了发酵特性优良的乳酸菌株。乙醛和双乙酰是构成酸奶风味的主要成分,使得酸奶口感独特。
本实验运用16S rRNA基因序列分析法和传统纯培养法对德宏水牛奶乳饼中的乳酸菌进行分离鉴定,并对菌株产酸、后酸化、产乙醛、产双乙酰等发酵特性进行研究,为食品发酵剂的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
云南省德宏州芒市15份水牛乳饼 勐旺村3份,芒丙村3份,拉怀村4份,芒岗村5份,4 ℃低温环境下带回实验室;丙三醇、乙醇、3%过氧化氢水溶液等 均为分析纯,购自天津市风船化学试剂科技有限公司;MRS肉汤、MRS培养基 购自北京陆桥技术有限责任公司;革兰氏染色试剂盒 购自北京索莱宝科技有限公司;DNA抽提试剂盒 购自北京全式金生物技术有限公司;PCR扩增引物 购自上海美吉生物技术有限公司。
SW-CJ-LF超净工作台 苏州安泰空气技术有限责任公司;DW-86L290澳柯玛超低温冰箱 青岛澳柯玛超低温冷冻设备有限公司;TGL20M冷冻离心机 湖南湘立科学仪器有限公司;DPH-9052恒温培养箱 上海恒科学仪器有限公司;YXQ-LS-70A高压灭菌器 上海博讯实业医疗设备厂;BH200光学显微镜 宁波舜宇仪器有限公司;ST320pH计 奥豪斯仪器有限公司。
1.2 实验方法
1.2.1 样品稀释液pH的测定 对乳饼样品,从其表面和内部各取12.5 g,置于同一研钵内研碎,加入225 mL 0.9% NaCl溶液灭菌,充分混匀,配制成样品10倍稀释液,用pH计测定其pH。
1.2.2 样品中乳酸菌落计数 无菌条件下,取1 mL样品10倍稀释液于9 mL NaCl溶液(质量分数0.9%)中,充分混匀,以10倍稀释法对其进行梯度稀释后,吸取1 mL稀释度为10-7、10-8、10-9的稀释液于无菌培养皿中(每个稀释梯度做2个平行),倒入已灭菌并处于保温状态的MRS培养基中,向每个平皿中倾注20~25 mL,混合样品稀释液与培养基。待平板中培养基冷却凝固后,倒置平皿放入恒温培养箱,并置于30 ℃培养48 h。菌落形成后,选择菌落数在30~300之间的平板,进行计数[6]。
1.2.3 样品的分离、纯化与生理生化鉴定 根据菌落形态特征,划线分离纯化2~3次后,挑取单菌落于MRS培养液中(36±1) ℃的条件下培养24 h。经革兰氏染色后镜检,同时进行过氧化氢酶实验,将纯种、革兰氏阳性、过氧化氢酶阴性的菌株置于-80 ℃超低温冰箱中保藏[7-14]。
1.2.4 乳酸菌16S rRNA基因的PCR扩增 将单克隆菌株用试剂盒法提取基因组DNA,PCR扩增16S rRNA基因引物为细菌通用引物,正向引物为FA-27F(5′-GCAGAGTTCTCGGAGTCACGAAGAGTTTGA TCCTGGCTCAG-3′);反向引物为RA-1495R(5′-AGCGGATCACTTCACACAGGACTACGGCTACCTTGT TACGA-3′)[15]。16S rRNA基因的PCR扩增体系:2.5 μL Tap Buffer;2.0 μL MgCl2;1.0 μL引物FA-27F(10 mmol/L);1.0 μL引物RA-1495R(10 mmol/L);0.5 μL dNTP mix(2.5 mmol/L);0.5 μL Tap DNA Polymerase(5 U/μL);2.0 μL DNA模板(100 mg/L);15.5 μL ddH2O。扩增反应条件为:94 ℃预变性3 min;94 ℃变性1 min;56 ℃退火1 min;72 ℃延伸2 min;30次循环;72 ℃末端延伸10 min[16]。扩增反应完毕后,取约 2 μL的PCR扩增产物用1.0%的琼脂糖凝胶电泳检测,若在1500 bp处有清晰的扩增条带且无拖尾、弥散现象,则PCR扩增成功。
1.2.5 乳酸菌16S rRNA序列测定 PCR产物送到上海美吉生物技术有限公司进行双向测序,每株菌获得两条16S rRNA基因的序列,用Seq Man软件拼接,获得约1500 bp的有效序列[17-18]。登陆网站http://www.ncbi.nlm.nih.gov/进行序列比对,结合形态学特征和理化特性确定与比对的目的基因序列同源性最高的已知分类的菌种。
1.2.6 系统发育树的构建 从GenBank数据库中下载与所测菌株相对应的16S rRNA基因序列,利用ClustalX 2.0.12进行多重比对,得到同源性。利用MEGA 4.0软件构建系统发育树,采用Neighbor-Joining法进行系统发育分析,并进行1000次重复的Boot-straps统计学检验[19]。
1.2.7 发酵性能测定
1.2.7.1 菌株产酸活性测定 将活化好的菌株按体积分数以2%的比例接种到全脂复原乳中发酵,初始pH为6.6,37 ℃厌氧培养,分别于6 h和24 h取样测可滴定酸,用0.1 mol/L NaOH滴定,酚酞作为指示剂,以乳酸的百分比表示结果[20]。
1.2.7.2 活菌数的测定 称取5 mL发酵乳样品于45 mL PBS缓冲液中,振荡均匀,取0.5 mL混合液加入4.5 mL PBS缓冲液中,选择10-7、10-8、10-9的发酵乳稀释液,利用平皿计数法测定发酵乳在4 ℃冷藏期间1、3、5、7 d乳酸菌的活菌数。
1.2.7.3 产香能力的测定 测定pH达到4.5,并于4 ℃冷藏1、3、5、7 d的发酵乳中的乙醛和丁二酮含量[21]。
1.2.8 数据统计 每组实验做3个平行,利用Excel软件、SPSS19.0 软件对数据进行分析处理。
2 结果与分析
2.1 乳饼的pH和乳酸菌的计数
由表1可知,15份水牛乳饼样品的10倍稀释液的pH均<7.0,呈酸性;样品10倍稀释液在(36±1) ℃培养24 h后pH最大值已达到4.47±0.09,表明样品中可能潜在大量产酸微生物;样品中乳酸菌数最高为(9.40±0.01)×108cfu/mL,最低为(2.00±0.04)×108cfu/mL,由乳酸菌活菌计数结果可知,所有乳饼样品活菌数均大于108cfu/mL。结果表明德宏水牛乳饼中乳酸菌产酸能力强,菌株存活率高,有利于下一步的分离鉴定。
2.2 菌株理化特性及初步鉴定
由表2可以看出,MRS培养基中菌斑有白色圆点或圆斑、白色三角锥形、乳白色梭状,且表面湿润、边缘整齐或褶皱等不同形态以及长在培养基的不同位置。通过在显微镜下观察到的形态为长杆状、短杆状,彼此排列成假分枝状、圆球状、单生或成对等,与吴少雄等[1]从云南撒尼乳饼中分离得到的菌株形态描述较为一致。将分离得到的单菌株分别进行革兰氏染色和过氧化氢酶实验,发现57株菌均为革兰氏阳性,过氧化氢酶阴性;根据菌株的形态学结果结合乳酸菌的理化特性,初步鉴定57株菌为疑似乳酸菌。

表2 菌株形态特征Table 2 Morphological characteristics strain
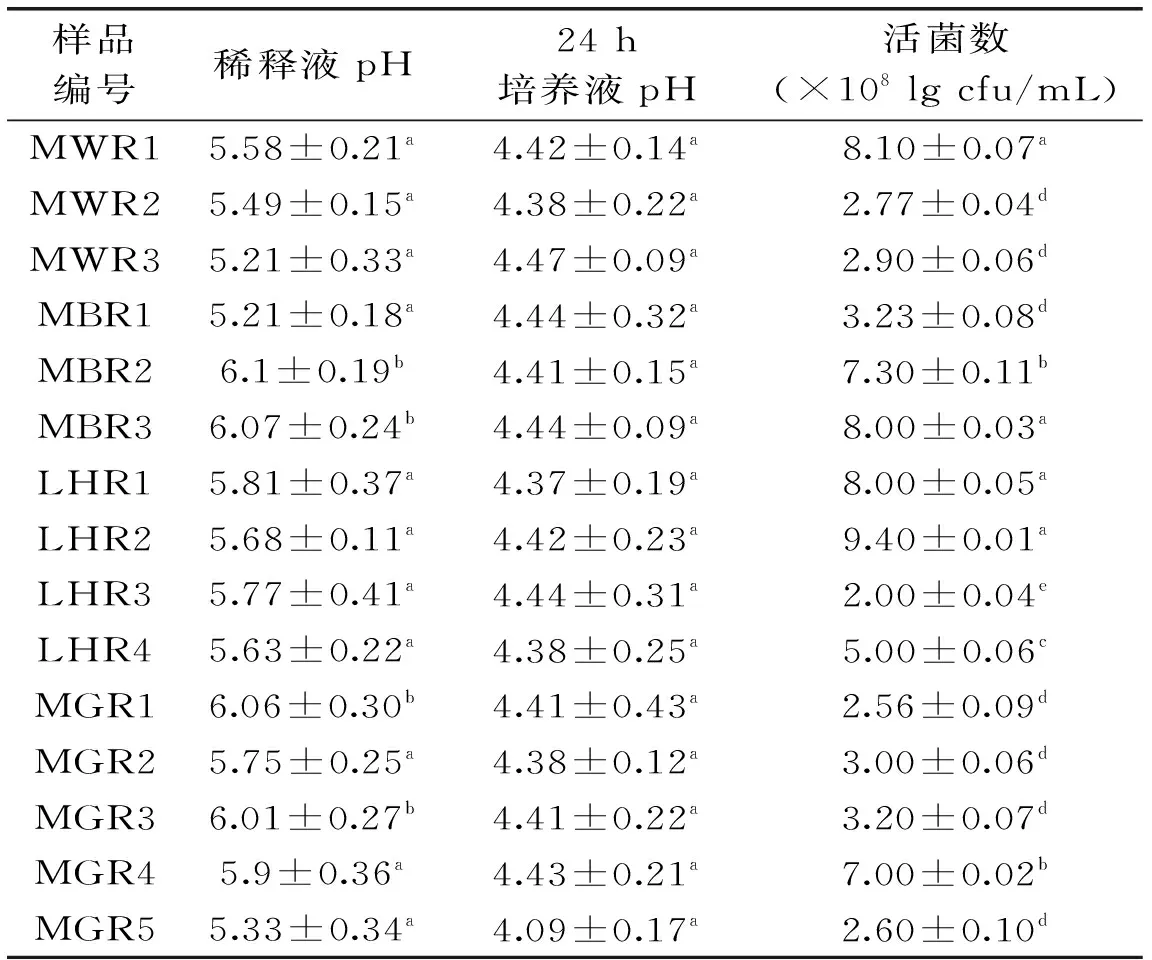
表1 pH和乳酸菌计数Table 1 pH value and lactic acid bacteria counts
注:角标含有不同字母的每列数据之间差异显著(p<0.05)。
2.3 乳酸菌系统发育树
由图1得出,菌株MBR1-3、MGR2-3、MGR1-4、MBR1-4、MBR1-1和LactobacillusorisX94229聚为一类,且同源性为98%,将其鉴定为Lactobacillusoris;菌株MWR1-3、MWR3-1、MWR3-2和LactobacillusreuteriiJCM1112聚为一类,且同源性为96%,将其鉴定为Lactobacillusreuterii;菌株MGR2-2、MGR5-3、MBR1-2、MWR1-1、MWR1-2与LactobacillusfermentumJN175331聚为一类,同源性为99%,将其鉴定为Lactobacillusfermentum;菌株MGR1-2和LactobacillusplantarumAJ965482聚为一类,同源性为98%,将其鉴定为鉴定为Lactobacillusplantarum;菌株MGR3-2、MGR1-1、MGR4-1与WeissellaconfusaAB023241聚为一类,同源性为93%,将其鉴定为Weissellaconfusa;菌株MBR2-2和EnterococcusduransAJ276354聚为一类,故将其鉴定为Enterococcusdurans;菌株MGR5-2、MGR3-1与Lactobacillusdelbrueckiisubsp. CR954253聚为一类,因此将其鉴定为Lactobacillusdelbrueckiisubsp。

图1 部分乳酸菌的16S rRNA基因序列系统发育树Fig.1 Phylogenetic tree of 16S rRNA sequences of lactic acid bacteria
2.4 乳酸菌16S rRNA同源性分析

表3 水牛乳饼中乳酸菌的分布结果Table 3 Distribution of lactic acid bacteria in buffalo milk cake

续表
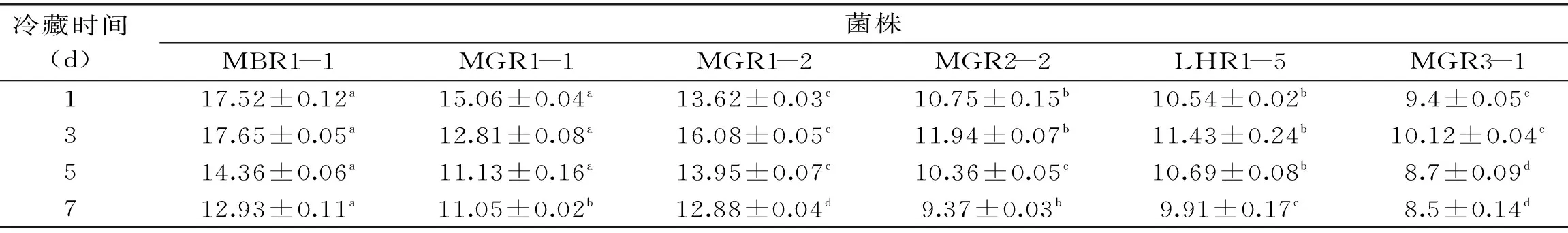
表4 冷藏期间乳酸菌活菌计数(lgCFU/mL)Table 4 During cold storage viable count of lactic acid bacteria(lgCFU/mL)
注:数据以±s表示(n=3);每一列中具有相同字母的数值差异不显著(p>0.05),具有不同字母的数值之间差异显著(p<0.05),表5~6同。

表5 酸奶冷藏过程中乙醛含量测定结果(Lg/mL)Table 5 Acetaldehyde assay results during refrigerated yogurt(Lg/mL)

表6 酸奶冷藏过程中双乙酰含量测定结果(mg/L)Table 6 Frozen yogurt during diacetyl assay results(mg/L)
由表3可知,经16S rRNA序列测定和同源性分析57株乳酸菌菌株归为3个属(Lactobacillus、Weissella、Enteroccoccus)中的6个种,包括21株Lactobacillusfermentum、14株Lactobacillusoris、12株Weissellaconfusa、6株Lactobacillusreuterii、1株Enterococcusdurans、1株Lactobacillusplantarum和1个亚种(Lactobacillusdelbrueckiisubsp.),其中Lactobacillusfermentum和Lactobacillusoris为优势菌属,占总菌属的36.84%和24.56%。
2.5 发酵性能
2.5.1 乳酸菌的产酸活性 由图2可知,利用57株菌在全脂粉11.5%、蔗糖6.5%的100 mL脱脂牛奶中培养6 h和24 h时的可滴定酸含量分析乳酸菌的产酸活性。培养6 h时,可滴定酸的范围是0.28%~1.45%,培养24 h时的范围是0.55%~2.49%,产酸活性最强的是MBR1-1(L.oris)。NANDA D K等[22]将6 h可滴定酸值大于0.6%作为筛选产酸能力强的乳酸菌标准,组间差异不显著(p>0.05),本实验中有6株菌满足这一条件,产酸能力强弱依次为:MBR1-1>MGR1-1>MGR1-2>MGR2-2>LHR1-5>MGR3-1。
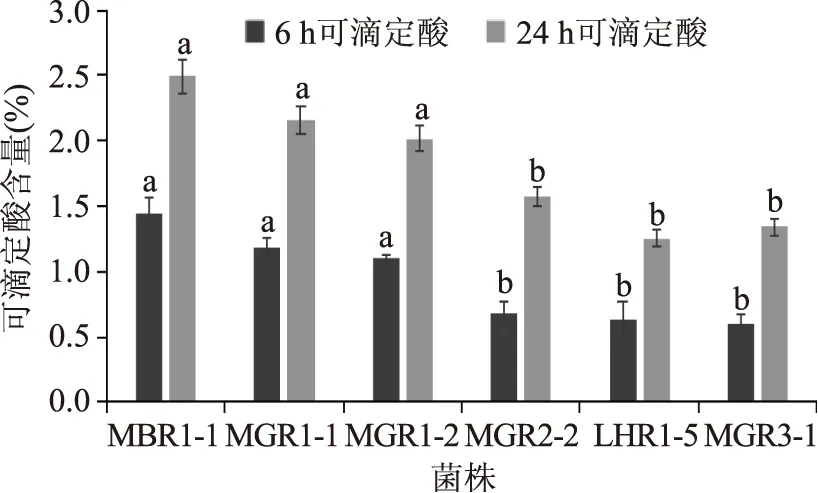
图2 菌株培养6 h和24 h后的可滴定酸Fig.2 Strains were cultured 6 h and 24 h after titratable acidity
2.5.2 发酵乳的活菌数 由表4可知,6株菌在4 ℃贮藏过程中,酸奶具有良好的活性,活菌数保持较为稳定,在贮存3 d 时的活菌数比发酵终点时的活菌数还略高。根据GB19302-2010的要求,对发酵乳中乳酸菌的数量不低于6 lgCFU/mL[23],本实验筛选的6株菌在发酵乳7 d后活菌数均大于国家标准,符合发酵剂的标准。菌株MBR1-1(L.oris)的发酵乳7 d后活菌数仍达到12.93 lgCFU/mL,可见菌株MBR1-1是一株具有良好活性的菌株。
2.5.3 菌株产香性能 由表5可知,菌株MGR1-2、MGR2-2、MGR3-1在贮藏7 d中乙醛含量变化在5~14 mg/L之内,是风味较好的菌株,菌株MBR1-1乙醛含量变化在9.13~19.81 mg/L之间,是良好的产乙醛特性的菌株,菌株LHR1-5乙醛含量7 d中都低于5 mg/L,是极弱风味菌种,不适合做发酵剂。由表6可知,菌株MBR1-1、MGR1-2、MGR2-2在贮存期间的双乙酰含量较为稳定,均达到10 mg/L以上,而菌株MGR3-1在贮存期间双乙酰最高含量为(13.83±0.52)mg/L,组间差异显著(p<0.05),是良好产香特性的菌株。
3 结论
运用16S rRNA基因序列分析技术和纯培养法对德宏水牛乳饼中的乳酸菌进行了分离和鉴定。共鉴定出57株乳酸菌,包括乳杆菌属、肠球菌属、魏斯氏菌属,共3个属7个种或亚种,其中Lactobacillusfermentum和Lactobacillusoris为优势乳酸菌。对57株菌发酵特性比较,筛选出菌株MBR1-1、MGR1-1、MGR1-2、MGR2-2、LHR1-5、MGR3-1,具有较强的产酸能力;菌株MBR1-1(L.oris)在发酵乳冷藏7 d后活菌数为12.93 lgCFU/mL,乙醛含量变化在9.13~19.81 mg/L之间,是一株活力高且产香性能良好的菌株。菌株MGR3-1(L.delbrueckiisubsp.)在贮存期间双乙酰最高,具有良好的产香性能。因而筛选出具有优良发酵特性的菌株MBR1-1和MGR3-1可以为今后乳制品发酵剂提供支持。
[1]杨希良,陈少迁,殷建忠,等. 云南撒尼地区乳饼中乳酸菌的分离及生物学形态研究[J]. 中国乳品工业,2013,41(11):23-26.
[2]呼斯楞,刘红新,于洁,等. 内蒙古呼伦贝尔地区传统发酵乳中乳酸菌的多样性分析[J]. 微生物学通报,2016,43(5):984-990.
[3]邵亚东,孟和毕力格.传统发酵乳制品中乳酸菌产双乙酰特性的研究[D]. 内蒙古:内蒙古农业大学,2007.
[4]李延华,王伟军,张兰威,等. 德氏乳杆菌保加利亚亚种发酵乳风味成分分析[J].食品科学,2009,30(4):257-259.
[5]徐成勇,吴昊,郑思聪,等. 弱后酸化酸奶发酵剂的筛选[J].中国乳品工业2013,35(3):12-16.
[6]Yu J,Wang WH,Menghe BLG,et al. Diversity of lactic acid bacteria associated with traditionalfermented dairy products in Mongolia[J]. Journal of Dairy Science,2011,94(7):3229-3241.
[7]杨洁彬,郭兴华.乳酸菌:生物学基础及应用[M]. 北京:中国轻工业出版社,1991:1-3.
[8]SUN Z,LIU W,GAO W,et al. Identification and characterization of the dominant lactic acid bacteria from kurut:The naturally fermented yak milk in Qinghai,China[J]. The Journal of General and Applied Microbiology,2010,56(1):1-10.
[9]孟令帅,张颖,邹婷婷,等.辣白菜中乳酸菌的分离鉴定[J].食品科学,2015,36(11):11-130.
[10]吕俊梅,李进波,黄艾祥.2011.牦牛“奶渣”中乳酸菌的分离鉴定[J].中国奶牛,20:57-60.
[11]HOLT J G,SNEATH P H. Bergey’s manual of systematic bacteriology(vol. 2)[M].4th ed. Baltimore:Williams & Wilkins,2008,35(8):129-301.
[12]李银聪,阚健全,杜木英.自然发酵酸耗牛奶的微生物区系及其抗氧化活性研究[D]. 重庆:西南大学,2011.
[13]南志强.西藏地区发酵牛乳的化学组成和微生物分析及乳酸菌的分离筛选[D].西藏:西藏大学,2010.
[14]庞会利,谈重芳,蔡义民,等.乳酸菌分类鉴定方法的研究进展[J].中国酿造,2009(6):1-5.
[15]IU W J,BAO Q H,JIRIMUTU,et al. Isolation and identi cation oflactic acid bacteria from Tarag in Mongolia of China by 16S rRNA sequences and DGGE analysis[J].Microbiological Research,2012(167):110-115.
[16]LIU W,GAO W. Identification and characterization ofthe dominant lactic acid bacteria from kurut:The naturally fermentedyak milk in Qinghai,China[J]. The Journal of General and Applied Microbiology,2010,56(1):1-10.
[17]FAYE T,TAMBURELLO A,BEGARUD G E,et al. Survival of lactic acid bacteria from fermented milks in aninvitrodigestion model exploiting sequential incubation in human gastric and duodenum juice[J]. Journal of Dairy Science,2012,95(2):558-567.
[18]WU R,WANG L P,MENGHE B,et al. Isolation and preliminary probiotic selection of Lactobacilli from koumiss in Inner Mongolia[J]. Journal of Basic Microbiology,2009,49(3):318-326.
[19]TAMURA K,DUDLEY J,NEI M,et al. MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J]. Molecular biology and evolution,2007,24(8):1596-1599.
[20]中华人民共和国卫生部. GB 5413.34-2010食品安全国家标准乳和乳制品酸度的测定[S]. 北京:中国标准出版社,2010.
[21]李妍,邢慧敏,邵亚东,等.发酵乳中丁二酮和乙醛含量检测方法探讨[J].食品与发酵工业,2008,34(3):157-159.
[22]NANDA D K,TOMAR S K,SINGH R,et al. Phenotypic and genotypic characterization of lactobacilli isolated from camel cheese produced in India[J]. International Journal of Dairy Technology,2011,64(3):437-443.
[23]中华人民共和国卫生部. GB 19302—2010食品安全国家标准发酵乳[S]. 北京:中国标准出版社,2010.
Isolation and identification of lactic acid bacteria from buffalo milk cakes in Dehong and analysis of fermentability
WANG Yu-jing1,HUANG Ai-xiang1,*,LIU Xue-ying1,WANG Xin-ling1,GUO Jie2
(1.College of Food Science and Technology,Yunnan Agricultural University,Kunming 650201,China;2.College of Pu-erh Tea,Yunnan Agricultural University,Kunming 650201,China)
Dehong buffalo milk cake is a specific dairy product in Yunnan,which contains abundant microbes and is the main source of lactic acid bacteria. Meanwhile,it is a basis for isolation and screening of qualified fermentation starter. In this study,the 15 samples were isolated and identified using pure culture and 16S rRNA gene sequence analysis. In order to select out lactic acid bacteria with excellent fermentation characteristics,the acidification,aroma and counts of these strains were compared. The result showed that 57 lactic acid bacteria(3genus,6 species and 1 subspecies)were separated from the 15 pieces of buffalo milk cakes,LactobacillusfermentumandLactobacillusoriswere thedominant species,held 36.84% and 24.56% of the total bacteria number respectively. Compared fermentation properties of the 57 lactic acid bacteria,MGR3-1 and MBR1-1 were defined as two dominant bacteria. So the research could be excellent fermentation starter to develop and use.
lactic acid bacteria;isolation and identification;16S rRNA gene sequences;fermentability
2016-06-30
王昱敬(1991-),男,硕士,研究方向:食品科学,E-mail:609948586@qq.com。
*通讯作者:黄艾祥(1963-),男,教授,研究方向:食品科学,E-mail:aixianghuang@126.com。
云南省高校食品加工与安全控制项目(云教科[2014]16号);云岭产业技术领军人才项目(云发改人事[2014]1782号);云南省现代奶牛产业技术体系项目(2016KJTX008)。
TS201.3
A
1002-0306(2017)02-0226-06
10.13386/j.issn1002-0306.2017.02.035
