阿克苏红富士苹果采后腐烂病原真菌的分离与鉴定
2017-03-08吴思雅张志东庞学群
吴思雅,张志东,庞学群,朱 璇,*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;2.新疆农业科学院微生物应用研究所,新疆乌鲁木齐 830091;3.华南农业大学生命科学学院,广东广州 510642)
阿克苏红富士苹果采后腐烂病原真菌的分离与鉴定
吴思雅1,张志东2,庞学群3,朱 璇1,*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;2.新疆农业科学院微生物应用研究所,新疆乌鲁木齐 830091;3.华南农业大学生命科学学院,广东广州 510642)
为了明确阿克苏红富士苹果采后腐烂的主要病原菌种类。通过对阿克苏红富士苹果采后常温和低温条件下自然发病的果实进行病原菌的分离筛选,采用经典微生物分离筛选方法,结合形态学观察、基因间隔序列(Internal transcribed spacer,ITS)、28S核糖体大亚基序列(large subunit rDNA,rDNA-LSU)及微管蛋白B(Beta tubulin,β-tubulin)序列的测定方法,并进行系统进化树的构建;同时,进行菌株的回接及病斑形态的验证。最终从腐烂的阿克苏红富士苹果病斑中分离出2类真菌,由形态学观察初步确定为链格孢霉(Alternariasp.)和青霉(Penicilliumsp.),通过进一步的多基因序列分析及菌株的回接及病斑的观察鉴定2种真菌分别为交链格孢霉(Alternariaalternata)和扩展青霉(Penicilliumexpansum)。本研究结果可为新疆阿克苏红富士采后病原真菌的快速鉴定及病害的防治提供理论依据。
苹果,采后病害,微管蛋白B,基因间隔序列,28S核糖体大亚基序列
新疆阿克苏位于新疆天山南麓,塔里木盆地北缘,土地肥沃,光线充足,该地区适合种植各种农作物和林果,且林果业种植面积已达到45万亩,享有“中国红富士之乡”之名,新疆阿克苏苹果已经通过有机果品基地认证,红富士苹果因果肉脆而多汁,味道芳香爽口,深受广大消费者的喜爱,是我国苹果的主要栽培和出口品种[1]。目前,我区阿克苏苹果的种植面积已达21.4万亩,年产量达5000万吨,但是由于采后保存方法的局限性,且随着采后贮藏期的延长,果实质地会不断变化,同时还伴随果实腐烂,据不完全统计,苹果烂果率达10%~18%,这严重影响了其经济效益,因此研究阿克苏红富士苹果的保鲜品质和预防腐烂在我国保鲜领域中具有重要意义[2]。
果蔬在采后贮藏期间,病原真菌侵染而造成的腐烂是导致其损失的主要原因。传统病原菌的鉴定方法主要是根据形态特征、分生孢子梗及菌落形态来进行分类,然而由于许多病原菌形态特征难以获得及其培养性状的可变性,此方法具有一定的局限性,存在着需要经验,耗时较长等问题。与传统的形态学鉴定相比,基因间隔序列(Internal transcribed spacer,ITS)是中度保守区域,其保守性基本上表现为种内相对一致,种间差异比较明显,ITS适合于真菌物种的分子鉴定以及属内物种间或种内差异较明显的菌群间的系统发育关系分析。由于ITS的序列分析能实质性地反映出属间、种间以及菌株间的碱基对差异,此外ITS序列片段较小、易于分析,目前已被广泛应用于真菌属内不同种间或近似属间的系统发育研究中[3-8]。早在1963年,Ledbetter和Porter最先报道在植物细胞中存在微管结构。微管蛋白是微管的组成单位,由α-tubulin蛋白和β-tubulin蛋白组成,其中β-tubulin蛋白由β-tubulin基因所编码[9]。由于β-tubulin基因既有保守的外显子又有许多内含子,已被用于真菌各级分类水平上的系统发育研究[10-11]。28S核糖体大亚基序列(large subunit rDNA,rDNA-LSU)主要由26S/28S rDNA组成,在生物体内含量较大且包括与核糖体功能密切相关的保守核心区段[12]。
由于ITS、LSU、β-tubulin基因序列在病原真菌的鉴定中具有简便快捷,准确性高等优点,故本研究采用形态学结合ITS、LSU及β-tubulin技术对新疆阿克苏红富士苹果采后病原菌进行鉴定,为病害的进一步防治提供理论基础。
1 材料和方法
1.1 材料与仪器
红富士苹果 于2015年11月采摘于新疆阿克苏红旗坡乡;马铃薯(PDA)培养基、察氏(CA)培养基 江莱生物;真菌基因组DNA提取试剂盒 上海生物工程;DNA纯化试剂盒 上海鼎国生物技术有限公司;磷酸氢二钾、硫酸镁、硝酸钠、硫酸亚铁、氯化钾、蔗糖、琼脂、葡萄糖、无水乙醇、其余试剂 均为化学纯。
超净工作台 苏州净化设备厂;YXQ-SG46-280S高压灭菌锅 上海博讯实业有限公司;生化培养箱 江苏南通五金电器厂;XSP-2CA显微镜 厦门Motic实业集团有限公司;PCRDL9700扩增仪。
1.2 实验方法
1.2.1 样品制备 挑取表面有腐烂症状的苹果分别放于常温和低温(4 ℃,RH95%)让其自然发病备用。对180个苹果进行了病原菌的分离,获得了两株菌种,通过菌落形态学观察初步确定为两类。
采集典型发病的红富士苹果果实,切取病健交界处组织放置于70%酒精溶液中约30 s,以杀灭所带杂菌,然后置于无菌水中冲洗3次,参考方中达所述方法[7],将冲洗干净的组织分别移置到PDA培养基和CA培养基上,于28 ℃恒温培养。待菌落生长到1 cm时用接种针刮取菌的边缘,移植在新的培养基上,划线培养,直到形成单一菌种。
采用涂布法培养,将腐烂的苹果组织用灭菌的生理盐水做10倍梯度的稀释,混合均匀后,用移液枪分别吸取10-1、10-2、10-3、10-4、10-5、10-6、10-7七个稀释梯度的样品稀释液各0.2 mL涂布于PDA培养基中,每个稀释梯度涂布3个平板,设3个重复,恒温培养箱中28 ℃的条件下培养5~7 d,使长出单菌落。
采用稀释纯化法,菌落平板内加20 μL灭菌水,轻轻摇晃,倒入灭菌烧杯内,加30 μL灭菌水稀释,取一滴于显微镜下观察,不断稀释到每一小滴悬液中只有一个孢子,用灭菌水冲洗到培养基上,静置10 min后,倒去多余的悬液,置于28 ℃恒温培养。
1.2.2 病原菌的鉴定
1.2.2.1 病原菌的形态学鉴定 根据病原菌在苹果果实上的发病症状,再结合病原菌在PDA和CA上的菌落特征,菌丝形态,分生孢子形态,大小和数量,分生孢子梗形态特征,厚垣孢子的有无、形态和大小等,参照魏景超[13]《真菌鉴定手册》和张天宇《中国真菌志》[14],对病原菌进行形态学鉴定。
1.2.2.2 病原菌的分子生物学鉴定 采用真菌基因组DNA提取试剂盒提取菌株的基因组DNA,作为PCR扩增的模板。采用真菌通用引物ITS1:5′-TCCGT AGGTGAACCTGCGG-3′,NL41:GGTCCGTGTTTCA AGACGG扩增菌株的rDNA ITS1区和LSU D1/D2区序列。PCR采用25 μL反应体系,通过Ex Taq(TaKaRa)进行。反应条件:95 ℃变性45 s,58 ℃复性30 s,72 ℃延伸1.5 min,共35个循环;采用真菌通用引物BT1819R:TTCCGTCCCGACAACTTCGT,BT2916F:CTCAGCCTCAGTGAACTCCAT扩增菌株的β-tubulin基因序列。反应条件:95 ℃变性45 s,55 ℃复性30 s,72 ℃延伸1.5 min,共35个循环。上述PCR产物经切胶纯化,交由北京鼎国昌盛生物技术有限责任公司进行测序。
将从实验菌株的所获得序列与GenBank数据库中的已知序列进行相似性序列比对,确定实验菌株亲缘关系最近的种属。并从数据库获得相关序列,利用MEGA 5.0软件包[15]进行聚类分析,并采用邻接法(Neighbor-joining,NJ)、最小进化法(Minimum Evolution,ME)和最大似然法(maximum likelihood,ML)构建系统进化树,分析各种树的稳定性,以确定菌种生物学分类地位。
1.2.3 回接侵染实验 分别配制链格孢霉和扩展青霉的孢子悬浮液,选取无病害的阿克苏苹果果实,采用针刺伤果实接种,分别对链格孢霉和扩展青霉进行苹果的回接侵染实验,以无菌水作对照。接种后的苹果果实放置于相对湿度约95%的塑料盒中,于20 ℃条件下贮藏,观察发病症状并统计发病率。发病率(%)=腐烂果个数/回接总果数。
2 结果与分析
2.1 新疆阿克苏红富士采后病原菌的筛选
从新疆阿克苏红旗乡采样,采样完成后,置于常温一周后,挑取表面有腐烂症状的苹果,主要发现病斑有两种形态,经过分离纯化获得观察菌落形态学初步确定为两类(A、B)。
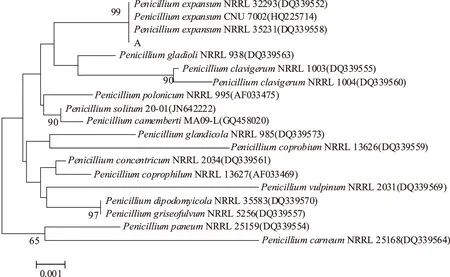
图3 基于菌株A rDNA ITS区和LSU D1/D2区序列的NJ进化树Fig.3 Neighbor-joining tree based on phylogenetic analysis of ITS and LSUD1/D2 regions sequences of isolate A
2.2 新疆阿克苏红富士采后病原菌形态学鉴定
2.2.1 病原菌A形态学鉴定 由图1可知,菌株A可在果实表面或内部发病,先形成褐色水渍斑,之后生出白色菌丝,然后长出青色或绿色霉层,最后导致全果腐烂。菌落在CA上25 ℃培养12 d,直径38~52 mm,有少量的放射状皱纹,近与平坦或有多道同心环纹;质地绒状,在菌落边缘或全部菌落面有粉末状、颗粒状;分生孢子结构大量产生,蓝绿色或微黄蓝绿色,近于白屈菜绿色、鼠尾草绿色(Celandine green,Sage green,R.RI.XLVII)、林肯绿色或叶绿素(Lincoln green,leafgreen,R.RI.XLVII);菌丝体白色;渗出液少量,淡黄色或近于无色,也有缺乏者;反面淡黄色、黄褐色或紫褐色;可溶性色素通常存在,近于较淡的反面颜色。参照魏景超[20]《真菌鉴定手册》和张天宇[21]《中国真菌志》初步鉴定为青霉属(Penicilliumsp.)。

图1 病原真菌A的形态及培养性状Fig.1 Form and culture character of pathogenic fungi A
2.2.2 病原菌B形态学鉴定 由图2可知病原菌B在苹果果实上的发病症状为病斑较硬,略凹陷,表面有褐色或者黑色孢子霉层。菌株在PDA平板上,初为灰白色,气生菌丝薄层絮状,产孢后为浅绿色至褐色,有明显的轮纹,培养一周的菌落直径为69~86.2 mm。分生孢子串生,孢子倒棍型或长卵型,具有柱状的喙。分生孢子梗单生,分枝或不分枝,浅褐色,有隔2~7个,长21.5~59.2 μm。参照魏景超[20]《真菌鉴定手册》和张天宇[21]《中国真菌志》初步鉴定为链格孢属(Alternariasp.)。

图2 病原真菌B的形态及培养性状Fig.2 Form and culture character of pathogenic fungi B
2.3 新疆阿克苏红富士采后病原菌分子学鉴定结果
2.3.1 病原菌A的分子鉴定 通过实验获得的病原菌A rDNA ITS区和LSU D1/D2区序列与GeneBank中序列比对,调取与之最为相近菌种相关序列,使用MEGA 5.0进行Clustal X多重比对,分别利用NJ、MP、ML法构建系统发育进化树,NJ法系统发育进化树如图3、图4所示。
结果表明,病原菌A归属于青霉属,其与PenicilliumexpansumNRRL 32293、CNU 7002和NRRL 35231有较高同源性,支持率为100%。进一步利用β-tubulin基因序列构建进化树表明,病原菌A与PenicilliumexpansumPSN396具有较高同源性,支持率为100%,确定病原菌A为扩展青霉(Penicilliumexpansum)。

图6 基于菌株B β-tubulin基因序列的NJ进化树Fig.6 Neighbor-joining tree based on phylogenetic analysis of β-tubulin regions sequences of isolate B

图4 基于菌株A β-tubulin基因序列的NJ进化树Fig.4 Neighbor-joining tree based on phylogeneticanalysis of β-tubulin regions sequences of isolate A
2.3.2 病原菌B的分子鉴定 将测序获得的病原菌B rDNA ITS区和LSU D1/D2区序列与GeneBank中序列比对,并调取与之最为相近菌种相关序列,使用MEGA 5.0进行Clustal X多重比对,分别利用NJ、MP、ML法构建系统发育进化树,NJ法系统发育进化树如图5、图6所示。

图5 基于菌株B rDNA ITS区和LSU D1/D2区序列的NJ进化树Fig.5 Neighbor-joining tree based on phylogeneticanalysis of ITS and LSUD1/D2 regions sequences of isolate B
结果表明,病原菌B归属于链格孢属(Alternaria),其与AlternariamaliAY154683,AlternariaalternataH02-747S-5和H02-781S-3b具有最高同源性,支持率为100%,与AlternariaburnsiiAB-03的同源较高,支持率为99.8%,无法确定具体归属。进一步利用β-tubulin基因序列构建进化树表明,病原菌B与已知Alternariaalternata单独形成一枝,支持率为100%,与已知菌株Alternariaalternata(HQ413316)、Alternariaalternata1E最高同源,支持率分别为100%和99.8%,且能很好的与Alternariamali,Alternariaburnsii分开。因此,确定病原菌B为链格孢霉(Alternariaalternata)。
2.4 回接侵染实验
通过潜在病原菌的回接,发现菌株A、菌株B均会引起苹果的发病(图7、图8),发病率统计见表1。菌株A主要会引起果实表面或内部发病,先形成褐色水渍斑,之后生出白色菌丝,然后长出青色或绿色霉层,最后导致全果腐烂,一旦发病后生长迅速,分生孢子面暗灰绿色或暗绿色、质地绒状;菌株B主要会引起苹果果实上的发病症状为病斑较硬,略凹陷,表面有褐色或者黑色孢子霉层,如图7、图8,其结果证明,菌株A、菌株B与上述形态学和分子生物学鉴定的菌种相同均为Penicilliumexpansum和Alternariaalternata。

表1 回接发病率统计Table 1 Incidence of tieback statistics
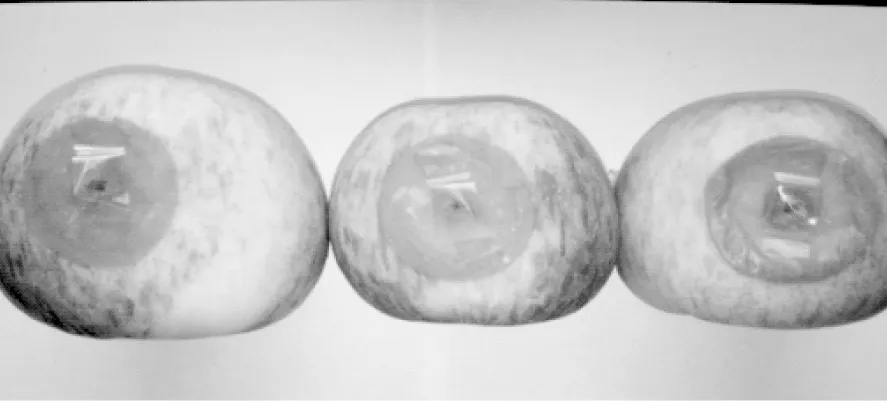
图7 菌株A病果Fig.7 Strain is A disease of fruit

图8 菌株B病果Fig.8 Strain is B disease of fruit
3 讨论与结论
阿克苏红富士苹果具有较高的经济价值,但在采后贮藏中,特别是贮藏条件不是很理想的情况下品质变化加快,并且有侵染型病害发生,降低、甚至失去商品价值,造成经济损失。通过形态学初步鉴定,采后引起苹果腐烂的病原菌主要有:链格孢霉(Alternariasp.)和青霉(Penicilliumsp.)。随着分子生物学的不断发展,基因间隔序列(Internal transcribed spacer,ITS)、28S核糖体大亚基序列(large subunit rDNA,rDNA-LSU)及微管蛋白B(Beta tubulin,β-tubulin)进行病原菌鉴定技术广泛应用于枣、甜瓜、芦笋、樱桃、李、香梨、杏等产品采后病原菌的鉴定中[16-21],此方法从分子水平上对病原菌进行了准确鉴定,为果蔬采后病害研究提供了理论依据。
本实验以新疆阿克苏红富士苹果为主要原料,通过形态学结合ITS、LSU、β-tubulin的方法,最后进行侵染回接实验对实验结果进行验证,引起红富士苹果果实采后腐烂的主要病原真菌有两种,分别为交孢链格孢霉(Alternariaalternata)和扩展青霉(Penicilliumexpansum);但是由于病原果实取材范围较窄,若想全面地揭示引起苹果果实采后病原菌的种类和优势菌株等问题,需要进一步扩大采样范围,且随着分子生物学的迅猛发展,对苹果果实主要病原菌更深入的研究将成为可能,对延长果实贮藏保鲜具有重要意义。
[1]新疆阿克苏地区苹果产业发展探讨.区域行业经济[M]. 新疆:新疆区域发展出版社,2015:25-26.
[2]新疆维吾尔自治区统计局. 新疆统计年鉴[M].北京:中国统计出版社,2014:335-336.
[3]姚子鹏,王友升,郭晓敏,等.桃果实贮藏期间病原真菌的ITS rDNA序列分析与鉴定[J]. 中国食品学报,2011,11(4):172-178.
[4]袁晖.腐烂苹果中真菌分离鉴定和PCR快速检测及条件优化[D].杨凌:西北农林科技大学,2009.
[5]WHITETJ,BRUNST,LEES.Analysis of phytogenetic relationship sbyam-plification and direct sequencing of ribosomal RNA genes[C]. INNIS MA.PCRProtocols:AGuidetoMethods and Applications.New York Academic,1990:315-322.
[6]Baldauf SL,Palmer JD. Animals and fungi are each other’s
closest relatives:congruent evidence from multiple proteins[J]. Proc Natl AcadSci USA,1993,90:11538-11562.
[7]O’Donnell KE,Cigelnik,Nirenberg HI. Molecular systematics and phylogeography of the Gibberellafujikumi species complex[J]. Mycologia,1998,90:465-493.
[8]Yli-Mattilat T,Mach RL,Alekhinaia IA. Phylogenetic relationship of Fusarium langsethiaeto Fusarium poae and Fusarium sporotrichioidesas and inferred by IGS,ITS,β-tubulin sequences and UP-PCR hybridization analysis[J]. International Journal of Food Microbiology,2004,95:267-285.
[9]Bichard. Penicilliumviticola,a new species isolated from a grape in Japan[J]. Mycoscience,2011,52(5):338-343.
[10]Erpenbeck D,Nichols SA,Voigt O,et al. Phylogenetic analysesunder secondary structure-specific substitution models outperform traditional approaches:case studies with diploblast LSU[J]. J Mol Evol,2007,64(5):543-557.
[11]Friedrich M,Tautz D. Ribosomal DNA phylogeny of the majorextant arthropod classes and the evolution of myriapods[J]. Nature,1995,376(6536):165-167.
[12]Pryor B M,Gilbertson R L. Molecular phylogenetic relationships amongst Alternaria species and related fungi based upon analysis of nuclear LSU and mt SSU rDNA sequences[J]. Mycological Research,2000,104(11):1312-1321.
[13]魏景超. 真菌鉴定手册[M].上海:上海科学技术出版,1979:130-133.
[14]张天宇.中国真菌志[M].北京:北京科学出版社,1883:136-139.
[15]Tamura K,Peterson D,Peterson N,et al. MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J]. Molecular Biology & Evolution,2011,28(10):2731-2739.
[16]柳涛,童军茂,马伟荣,等.哈密瓜采后冷藏中主要病原菌的分离鉴定[J].现代食品科技,2013,29(8):2030-2034.
[17]曹娜,湛东锐,李连强,等.分子生物学与形态学相结合鉴定盐生海芦笋内生真菌Salicorn15[J]. 食品科学,2012,33(23):180-183.
[18]杜小琴,李杰,秦文,等.甜樱桃果实采后病原菌的分离鉴定及其生物学特性研究[J].食品工业科技,2015,4(18):197-202.
[19]王友升,陈玉娟,张燕.李果实贮藏期间4株病原真菌的分离、鉴定及碳源代谢指纹图谱分析[J].食品科学,2012,33(13):235-239.
[20]Igual M,Garcia-Martinez E,Martin-Esparza M E,et al. Effect of processing on the drying kinetics and function value of dried apricot[J]. Food Research International,2012,47(2):284-290.
[21]吴思雅,阿衣木古丽·艾赛提,郑灿龙,等. 新疆赛买提杏采后主要病原真菌的鉴定[J]. 食品工业科技,2016,37(1):149-152.
Isolation and identification of main pathogenic fungus from post-harvest Akesu Fuji apple fruits
WU Si-ya1,ZHANG Zhi-dong2,PANG Xue-qun3,ZHU Xuan1,*
(1.Institute of Food Sciece,Xinjiag Agricultural University,Urumqi 830052,China;2.Institute of Microbiology,Xinjiang Academy of Agricultural Sciences,Urumqi 830091,China;3.College of Life Science,South China Agricultural University,Guangzhou 510642,China)
The objective of this project was to clarify the main pathogenic fungus on harvested Akesu Fuji apple after rotten. The harvested Akesu Fuji apple was used for the isolation and screening of pathogenic bacteria under the condition of room temperature and low temperature.The method was the classical microorganism of isolation and screening with the morphological observation,the internal transcribed spacer,(ITS)28S ribosomal(large subunit rDNA,rDNA-LSU)and testing the sequence of microtubulin B(Beta tubulin,β-tubulin)as well as the structure of phylogenetic tree. Meanwhile the verification of tie-back of bacterial strain and the lesion were conducted.The lesion was separated into two fungus from the storage of red Fuji apple,and also the two fungus were identified asAlternariasp. andPenicilliumsp. through the morphological observation. Further sequence analysis using the tie-back of bacterial train and lesion confirmed that,the two types of Fuji wereAlternariaalternataandPenicilliumexpansum.This study provided the theoretical basis for the research of rapid identification of pathogenic bacteria in harvested Akesu red Fuji apple in Xinjiang.
apple;pathogens after harvest;β-tubulin;ITS;LSU
2016-06-15
吴思雅(1993-),女,硕士研究生,研究方向:果蔬贮藏与保鲜,E-mail:wsy930218@sina.com。
*通讯作者:朱璇(1971-),女,博士,教授,研究方向:果蔬贮藏与保鲜,E-mail:zx9927@126.com。
国家科技支撑计划(2015BAD16B07)。
TS255
A
1002-0306(2017)02-0205-05
10.13386/j.issn1002-0306.2017.02.031
