高原肺水肿患者rs1193789、rs1516386、rs474096、rs566456、rs2322433单核苷酸位点的多态性分析*
2017-03-08韵海霞刘永年杨应忠
杜 慧,赵 婧,韵海霞,刘永年,杨应忠,3△
(1.青海大学研究生院,青海 西宁 810001;2.青海大学医学院,青海 西宁 810001;3.青海大学高原医学研究中心,青海 西宁 810001)
高原肺水肿(high altitude pulmonary edema,HAPE)发病机制迄今为止仍然不清楚,国内外研究者们提出HAPE的发生是遗传和环境双重因素作用的结果,具有遗传易感性[1]。与HAPE易感性相关的遗传基础研究多集中在eNOS、Hsp70、VEGF和血管紧张素及其受体、人白细胞抗原等基因的病例-对照关联分析[2-3],但是均未明确发现与HAPE发病机制密切相关的遗传基础。
自2012年以来,课题组通过Affymetrix SNP 6.0芯片进行全基因组关联分析,筛选出在对照组与病例组间有显著差异的SNP位点。本次研究选取其中5个SNPs位点,采用Sequenom MassARRAY®SNP分型技术检测这些多态性位点,并分析与HAPE的关系。
1 对象与方法
1.1 研究对象
本次研究的HAPE患者(HAPE patient,HAPE-p)共133例,均为汉族,男性,平均年龄为40.20±9.91岁,无亲缘关系。在青海省玉树州援建时发病,并在玉树州人民医院确诊为HAPE。这些患者平时体健,既往无高原病病史,无心血管疾病、糖尿病、先天性心脏病、基础肺部疾病、肺发育不良等干扰本研究结果的疾病。健康对照组(HAPE-control,HAPE-c)135例,选取汉族,男性,既往体健,平均年龄为40.92±5.15岁,对其行常规体检及有关生理指标检测。用统计表收集研究对象的一般情况。本研究经青海大学医学院伦理审查委员会审查并通过,并与所有研究对象签署知情同意书。
1.2 仪器与材料
UVP凝胶成像系统(UVP公司),DU800核酸检测仪、5415D高速离心机(德国Eppendorf公司),BIO-RAD PCR 扩增仪( 美国伯乐),DYY-6B型稳压稳流电泳仪(北京六一仪器厂)。Gentra Puregene Blood Kit血液基因组提取试剂盒(德国Qiagen158389),1.5 mL EP管、200 μL PCR 管(AXYGEN SCIENTIFIC公司) 。其他为国产分析纯试剂。
1.3 候选位点
前期GWAS结果提示这些基因与免疫调节炎症、脂质代谢、胞内能量代谢、葡萄糖转运、钾钙离子转运、血管内皮功能、肺脏发育、炎症损伤等相关[4]。因此,筛选出以下5个SNP位点(表1)进行分析。
表1候选SNPs信息表
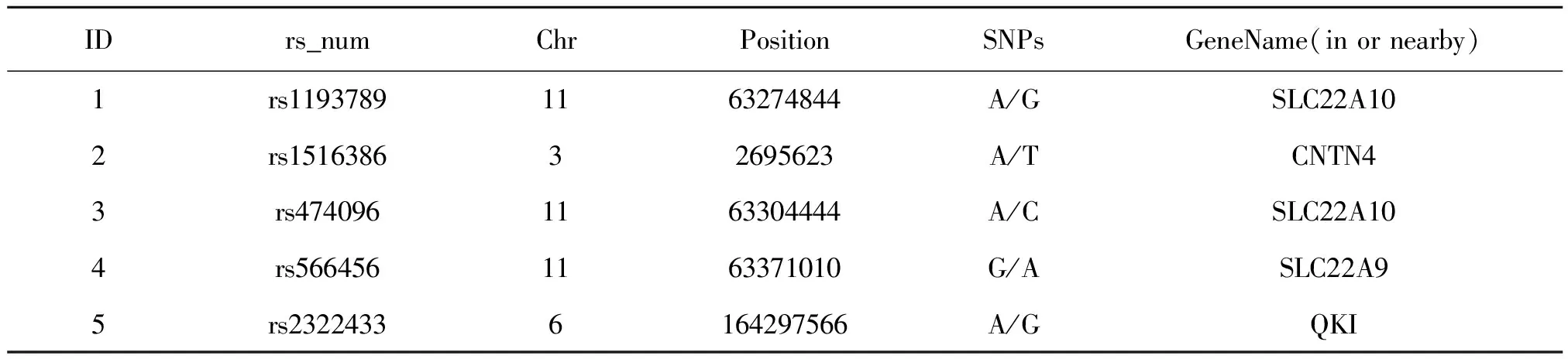
Table 1 Information about Candidate SNPs
1.4 实验方法
1.4.1 基因组DNA提取
分别抽取病例组和对照组外周静脉血各4 mL,用EDTA钾抗凝,离心(4000r/min)10 min,吸上层血浆至冻存管,置-80 ℃冰箱保存;吸取白细胞层至新的15 mL离心管,加入红细胞裂解液混匀,充分裂解后离心弃上清液,重复上述步骤至只有白细胞,加入白细胞裂解液混匀,室温保存。用Gentra Puregene Blood Kit基因组提取试剂盒,提取室温保存的样本中的白细胞基因组DNA,用核酸检测仪测定浓度,并将样本基因组DNA稀释到200 ng/μL,样本基因组DNA经1.5%琼脂糖凝胶电泳30 min后检测条带的完整性。置-20 ℃冻存备用。
1.4.2 基因分型
采用Sequenom MassARRAY®SNP分型检测方法,通过多重PCR技术、iPLEX单碱基延伸技术、基质辅助激光解吸附电离飞行时间质谱分析质谱技术(matrix-assisted laser desorption/ionization-time of flight,MALDI-TOF)进行分型检测。使用Sequenom 公司MassARRAY Assay Design及Genotyping Tools软件设计待测SNP位点的PCR扩增引物及单碱基延伸引物,并交给生物公司合成。
1.4.3 PCR扩增
利用多重PCR技术,反应体系总体积为5 L。反应体系(5μL)包含PCR master mix溶液、模板DNA 20-50 ng、Hotstar Taq 0.5 U,每条扩增引物0.5 pmol,0.1 μL的25 mM dNTPs。PCR反应条件:94 ℃ 4 min;94 ℃ 20 s,56 ℃ 30 s,72 ℃ 1 min,45 个循环;72 ℃ 3 min;4 ℃维持。为了去除体系中游离的dNTPs,在PCR反应结束后,把PCR产物用SAP处理。将SAP Mix加入PCR反应板,反应体系总体积为7 μL,其中PCR产物5 μL,SAP混合液2 μL。PCR反应条件:37 ℃ 40 min;85 ℃ 5 min;4 ℃维持。用碱性磷酸酶处理结束后,进行单碱基延伸反应,反应体系总体积 9 μL,包含EXTEND Mix 2 μL,SAP处理后PCR产物7 μL。PCR反应条件:94 ℃ 30 s,4个循环(52℃ 5 s,80℃ 5 s),39个循环(94℃ 5 s,52℃ 5 s,80℃ 5 s),72 ℃ 3 min,4 ℃维持。在单碱基延伸反应的结果中加入16 μL的水后将树脂倒入孔中进行纯化,用MassARRAY Nanodispenser RS1000点样仪进行芯片点样,最后使用MALDI-TOF分析,检测结果使用TYPER 4.0软件(sequenom)分型并输出结果。
1.5 统计学方法
采用Excel 2013软件行哈迪-温伯格遗传平衡检验;应用SPSS 17.0统计软件,各基因型及等位基因频率的比较采用卡方检验,显著性检验水准α=0.05。
2 结果
2.1 候选SNPs分型结果
本实验对268个样本的SNP进行分型(图1)。Sequenom MassARRAY®SNP检测是把SNP位点引起的碱基差异转化成分子量大小的差异来体现,通过MALDI-TOF技术检测延伸产物分子量的大小,应用专用的分析软件MassArray TYPER 4.0进行处理,通过判断分子量大小的差异来进行SNP分型。
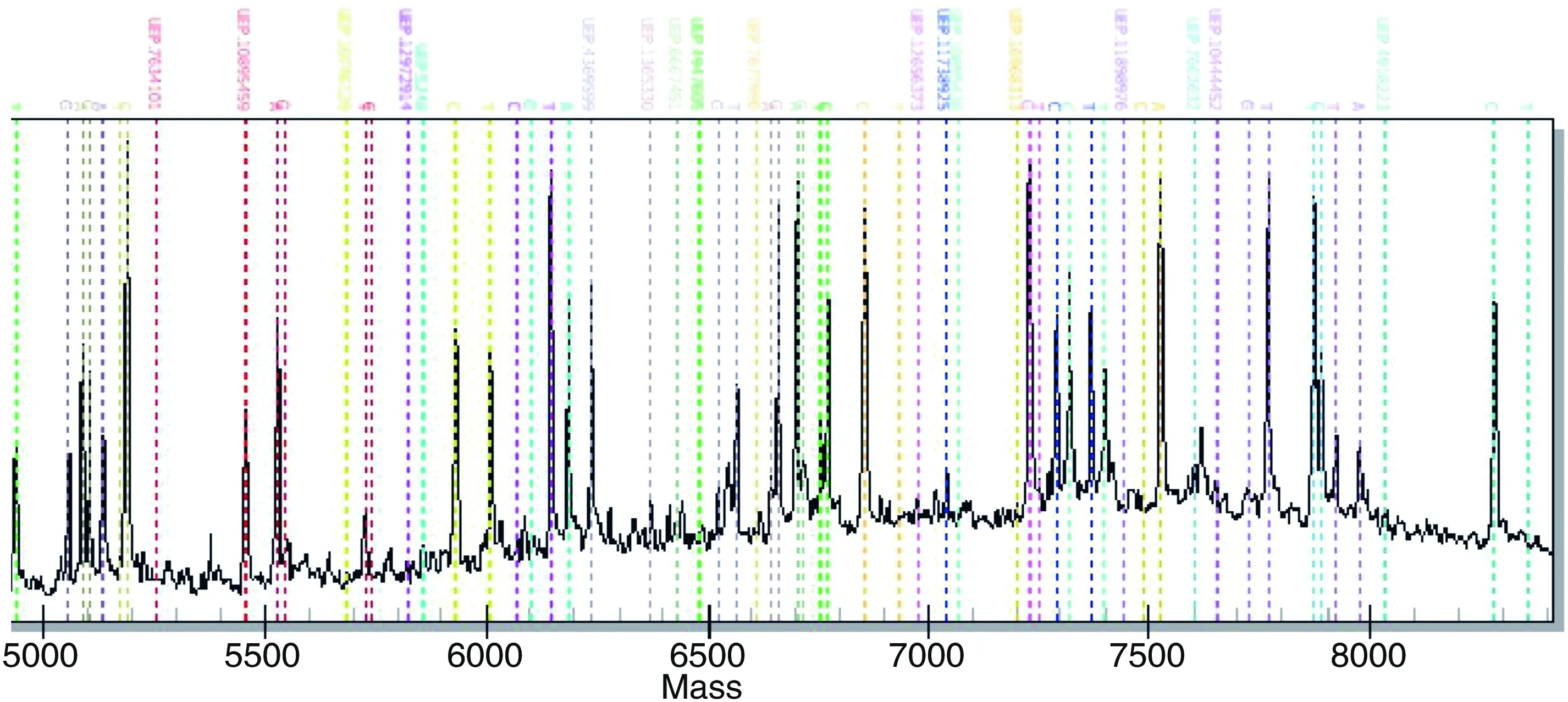
图1根据分子量的差异判断延伸产物分型结果
Figure1Thetypingresultoftheelongationproductdeterminesaccordingtothedifferenceofmolecularweight
2.2 Hardy-Weinberg检验结果
分别对HAPE-p组和HAPE-c组行哈迪-温伯格检验,检验结果显示所有SNP位点均符合Hardy-Weinberg检验平衡定律(P>0.05),说明群体基因遗传平衡(表2)。
表2 SNP哈迪-温伯格平衡检验表
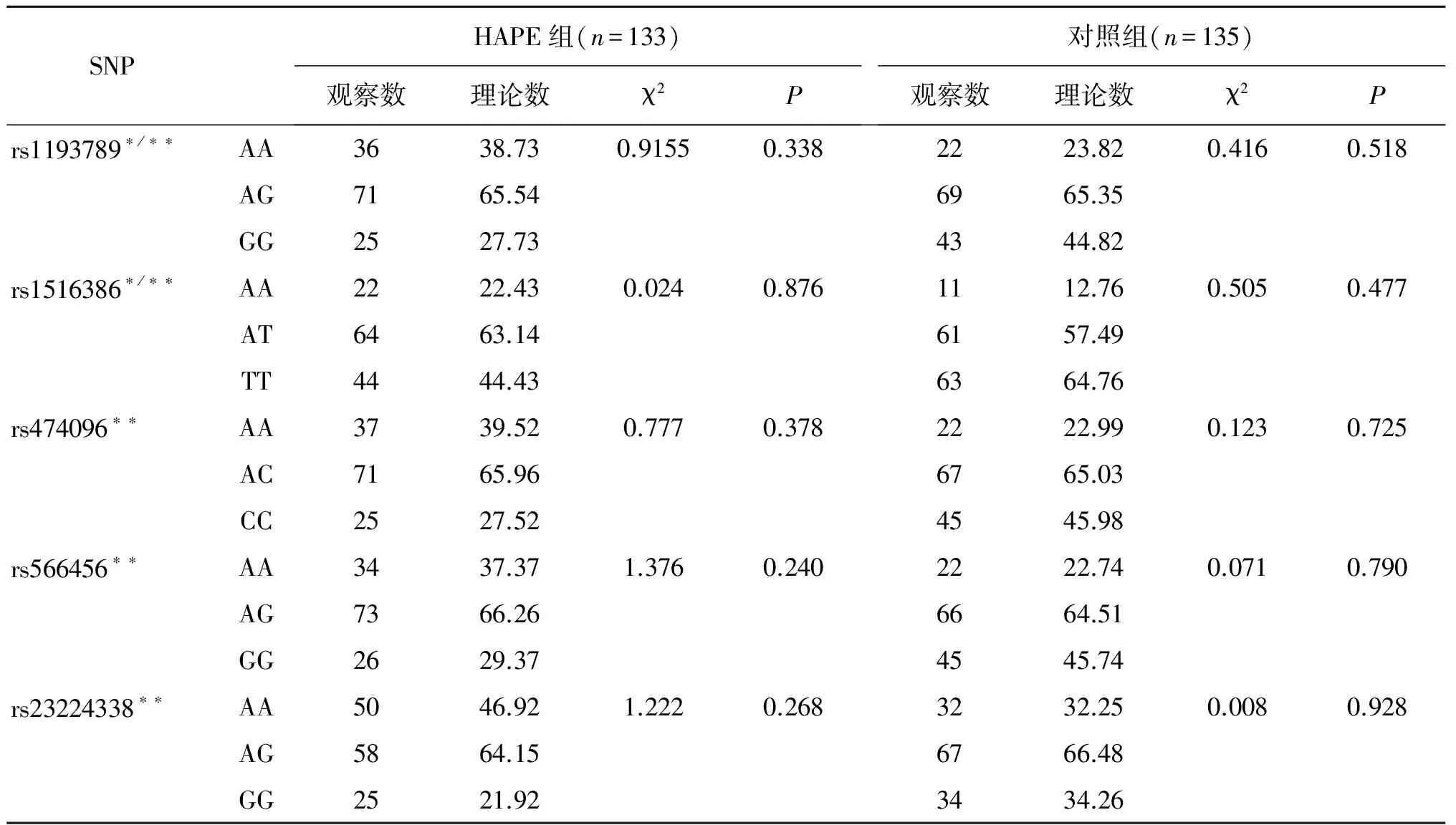
Table 2 SNP Hardy Weinberg equilibrium test
*:由于检测过程中部分样本检测失败导致表中HAPE组的两个位点的实际检测总数小于研究总例数;**:由于检测过程中部分样本检测失败导致表中对照组各位点的实际检测总数小于研究总例数.
2.3 候选SNPs基因型与等位基因频率
rs1193789、rs1516386、rs474096、rs566456、rs2322433的基因型AA在HAPE组和对照组之间的差异均有统计学意义(表3)。同时,等位基因A在HAPE组中的频率明显高于对照组。rs1193789、rs1516386、rs474096、rs566456的隐性遗传基因型AA+AG、AA+AT、AA+AC和AA+AG在HAPE组中的基因型频率明显高于对照组[OR(95%)为2.022(1.148-3.564),P=0.014]、[OR(95%)为1.710(1.041-2.809),P=0.033]、[OR(95%)为2.184(1.243-3.838),P=0.006]、[OR(95%)为2.104(1.203-3.681),P=0.008]。但是,rs2322433的隐性基因型AA+AG在HAPE组和对照组之间的差异无统计学意义(P=0.184)。
表3候选SNPs位点在HAPE组与对照组中基因型及等位基因频率分布表
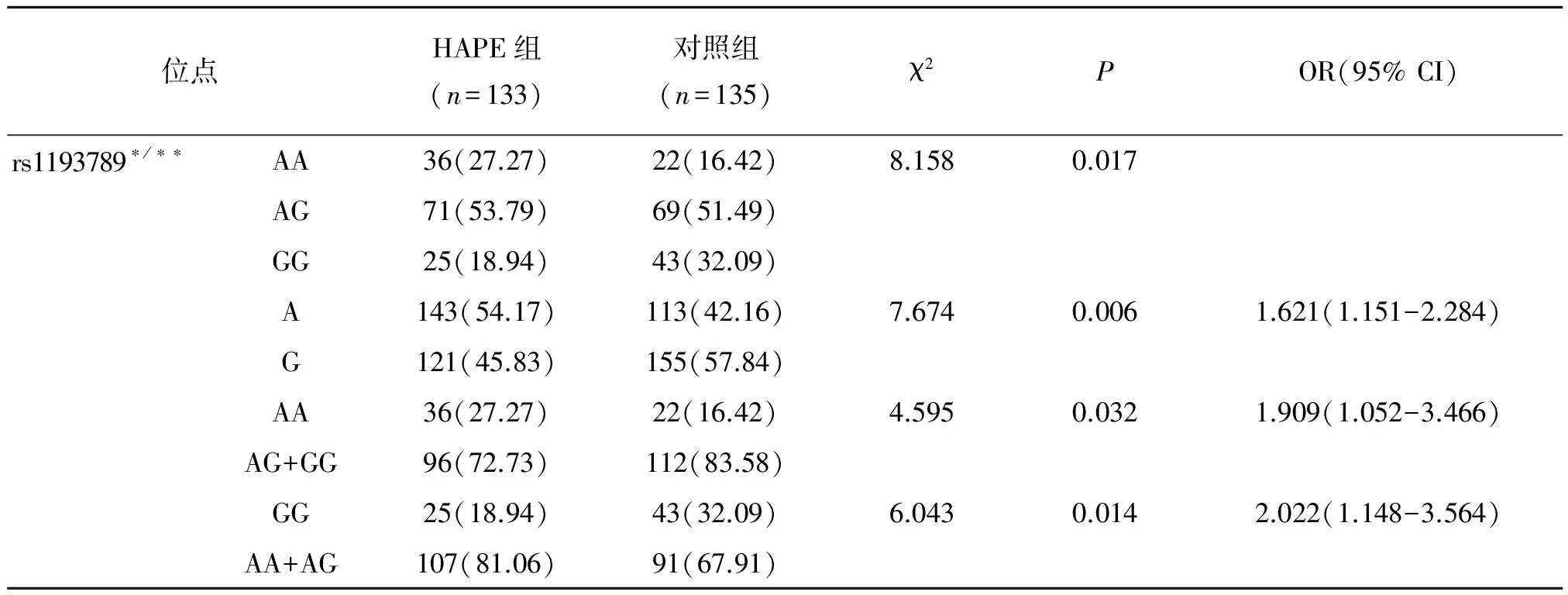
Table 3Distribution of the Genotypic and Allelic Frequencies of the Candidate SNPs between HAPE and Healthy Groups
续表:
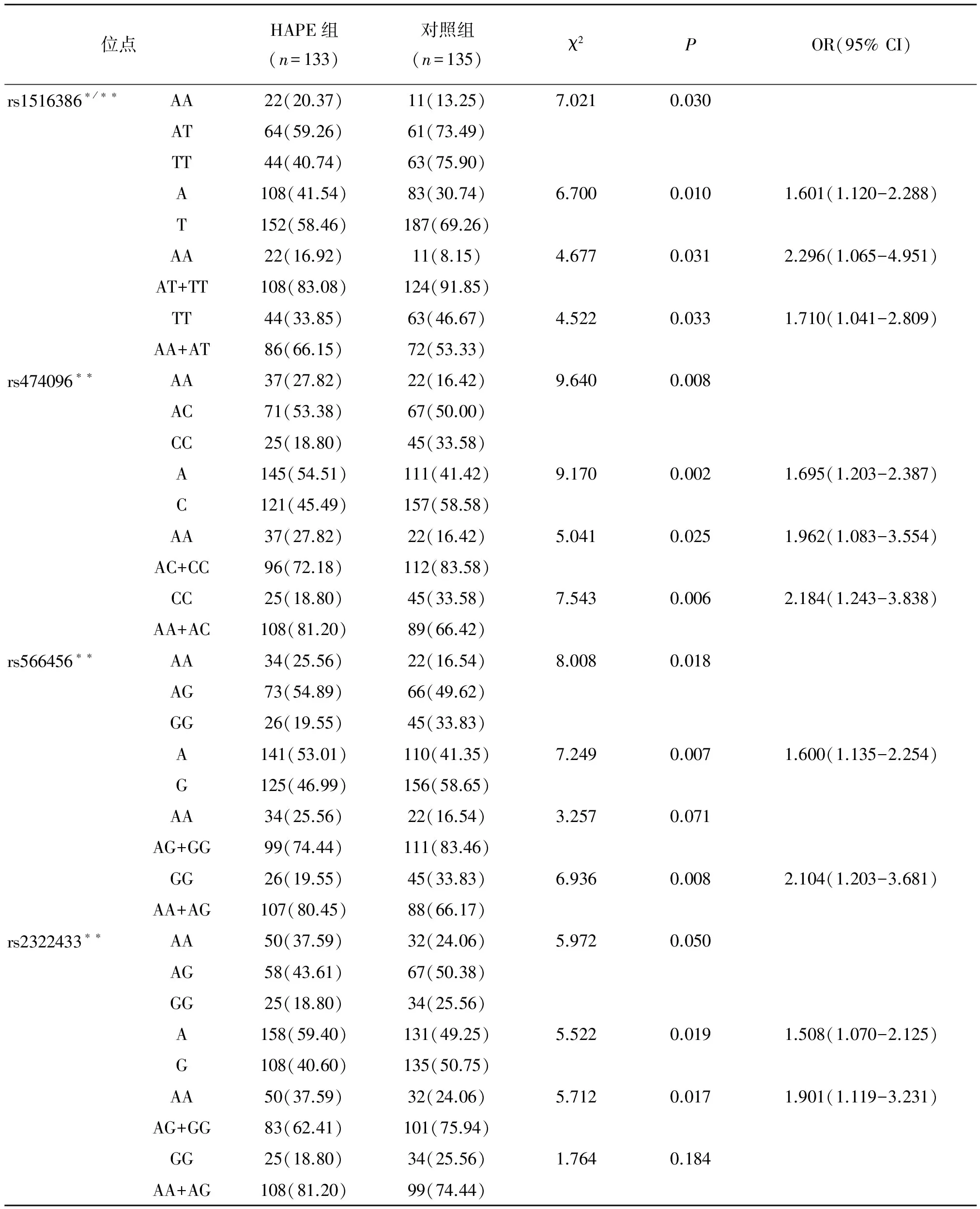
位点HAPE组(n=133)对照组(n=135)χ2POR(95%CI)rs1516386∗/∗∗AA22(20.37)11(13.25)7.0210.030AT64(59.26)61(73.49)TT44(40.74)63(75.90)A108(41.54)83(30.74)6.7000.0101.601(1.120-2.288)T152(58.46)187(69.26)AA22(16.92)11(8.15)4.6770.0312.296(1.065-4.951)AT+TT108(83.08)124(91.85)TT44(33.85)63(46.67)4.5220.0331.710(1.041-2.809)AA+AT86(66.15)72(53.33)rs474096∗∗AA37(27.82)22(16.42)9.6400.008AC71(53.38)67(50.00)CC25(18.80)45(33.58)A145(54.51)111(41.42)9.1700.0021.695(1.203-2.387)C121(45.49)157(58.58)AA37(27.82)22(16.42)5.0410.0251.962(1.083-3.554)AC+CC96(72.18)112(83.58)CC25(18.80)45(33.58)7.5430.0062.184(1.243-3.838)AA+AC108(81.20)89(66.42)rs566456∗∗AA34(25.56)22(16.54)8.0080.018AG73(54.89)66(49.62)GG26(19.55)45(33.83)A141(53.01)110(41.35)7.2490.0071.600(1.135-2.254)G125(46.99)156(58.65)AA34(25.56)22(16.54)3.2570.071AG+GG99(74.44)111(83.46)GG26(19.55)45(33.83)6.9360.0082.104(1.203-3.681)AA+AG107(80.45)88(66.17)rs2322433∗∗AA50(37.59)32(24.06)5.9720.050AG58(43.61)67(50.38)GG25(18.80)34(25.56)A158(59.40)131(49.25)5.5220.0191.508(1.070-2.125)G108(40.60)135(50.75)AA50(37.59)32(24.06)5.7120.0171.901(1.119-3.231)AG+GG83(62.41)101(75.94)GG25(18.80)34(25.56)1.7640.184AA+AG108(81.20)99(74.44)
*:由于检测过程中部分样本检测失败导致表中HAPE组的两个位点的实际检测总数小于研究总例数;**:由于检测过程中部分样本检测失败导致表中对照组各位点的实际检测总数小于研究总例数.
3 讨论
现有文献报道,急进高原后在调节血管通透性和血管舒缩功能及血管内稳态的多基因通路上发生了基因的异常表达,这些基因共同促进肺动脉收缩效应的放大和HAPE的发生发展,说明HAPE的发生是多基因调控的疾病[4]。然而,对于这些基因在不同学者的研究结果中的重复性并不一致,许多基因仍然需要进一步的验证。本研究针对前期工作选出的5个SNP位点,发现rs1193789、rs1516386、rs474096、rs566456、rs2322433的基因型频率在HAPE组和对照组之间的差异均有统计学意义。
rs1193789、rs474096、rs566456位点位于11号染色体,分别位于编码有机阴离子转运蛋白超家族中的SLC22A9和SLC22A10。SLC22A9在肝脏中高表达,是溶质载体家族的一员,能被肝细胞核因子HNF-1α激活[5]。HNF-1α是细胞中肝细胞核因子(HNF)的一个亚型,HNF-1α在胰腺β细胞和肝细胞中高表达,参与体内葡萄糖及脂肪代谢的调节过程,是一种转录调节因子,在转录水平参与包括葡萄糖激酶在内的多种蛋白质的表达过程。
人类运输体溶质载体家族,是基于序列的同源性和底物的专一性形成的有机阳离子交换器,及两性离子协同转运蛋白、有机阴离子转运蛋白,由23个成员组成。他们在各种有机化合物肾脏的排泄中起着关键作用,这些有机化合物包括药物、毒素和内源性代谢物。药物遗传学研究清楚地表明,SLC22A转运蛋白在吸收、分发和消除各种内源性化合物和药物中扮演重要的角色。在溶质载体蛋白中,SLC22A9对内源性和外源性带负电荷的阴离子化合物的消除或再吸收起着重要的作用[6-9]。
rs1193789位点的下游是葡萄糖易化转运蛋白9基因(GLUT9/SLC2A9),它与尿酸代谢密切相关,在尿酸重吸收中发挥重要的作用。目前,推测GLUT9的功能是将被吸收入肾小管上皮细胞内的尿酸转运到肾间质中,这一过程主要由位于基底膜侧的GLU9L完成[10]。rs566456的下游基因是RTN3,它是RTN家族的成员之一,RTNs可参与转运蛋白、调节细胞凋亡、调节β分泌酶活性及抑制神经再生等过程。RTN3定位于内质网膜上,通常被认为是一个诱导细胞凋亡的蛋白,HAPE的发病中最主要的因素是缺氧,缺氧可以引起一系列生理病理过程,如凋亡、信号转导、蛋白代谢、心脏兴奋-收缩偶联等。内质网调节蛋白质合成、折叠和转运,并且可以调节细胞应激反应和细胞内钙离子水平,细胞内钙离子浓度对维持细胞正常功能非常重要[11]。在哺乳动物细胞中,RTN3与Bcl-2结合在内质网上,BCL-2家族蛋白对细胞内Ca2+的调节可能通过以下两种机制来实现:(1)调控细胞凋亡过程中Ca2+的重新分布;(2)调控细胞凋亡中内质网钙库Ca2+的排空,所以在HAPE的发病过程中不均一性的离子通道的激活,如细胞膜的钙离子通透性增加,均可导致肺动脉收缩及肺动脉压力增高[11-12]。rs1516386位于3号染色体上,编码细胞黏附分子CNTN4基因,是轴突相关黏附分子TAG-1/F3的亚组的一员,在神经网络的形成、维持和可塑性中起重要作用。全纵长由6个免疫蛋白域和4个纤维蛋白(FNIII)域组成,通过糖基磷脂酰肌醇连接[12]。研究还发现,CNTN4在大肠直肠癌的生成和发展中具有抑癌的作用。rs1516386位点的下游基因为IL-5。研究显示,IL-5诱导嗜酸性粒细胞具有特异性,主要调节嗜酸性粒细胞生长、分化。炎症反应过程中的T淋巴细胞刺激支气管黏膜产生的IL-5能选择性作用于嗜酸性粒细胞,IL-5可引起肺嗜酸性粒细胞明显增多及支气管收缩介质反应性增加,从而引起一系列肺部疾病[13]。人体快速进入高原后,在低压缺氧环境下,各种诱因引起的肺动脉压力骤然升高,肺毛细血管静水压升高,血管收缩不平衡,收缩较弱的区域灌注增强,造成区域水肿,液体通过靠近阻力血管的动脉壁漏出、转移和潴留,引起肺间质和肺泡疾病。由此可见,炎性因子在HAPE的发生发展过程中扮演重要的角色。
rs2322433位点的上游基因为QKI,QKI基因属于STAR(signal transduction and activation of RNA)家族的一种RNA结合蛋白,它能与一些炎症有关的靶分子,如VCAM,COX-2等结合。QKI基因含有9个外显子,由于在进化过程中高度保守,所以有一定的特异性,在神经系统发育和在胚胎发育中分别参与髓鞘发育和心血管系统发育,故大多数与QKI基因有关的研究集中在髓鞘发育的分子水平上;进一步研究发现,胚胎心血管系统严重的发育障碍,是由QKI基因特定部位的突变导致的。对QKI基因启动子序列分析发现其具有NF-κB的结合位点。NF-κB是一种对氧化还原敏感的转录因子,可以调节许多与炎症有关的基因表达,来启动炎症的发生,在胚胎的发育过程中也扮演着不可或缺的角色。因此,NF-κB可在与炎症有关疾病的发生发展转归过程中发挥重要的作用[14]。由此可见,基因改变在HAPE的发病机制中扮演重要角色,主要表现为,在低氧环境下与个体易感性密切相关。这些基因可能会成为一种重要的分子标志物。
本次研究通过对HAPE患者rs1193789、rs1516386、rs474096、rs566456、rs2322433这5个多态性位点的分析,发现基因型AA和等位基因A可能是HAPE发生的一个重要危险因素。在接下来的工作中,我们将继续分析HAPE患者其他的多态性位点,探讨研究与HAPE发病有关的其他危险因素。
[1]高钰琪.高原军事医学[M].重庆:重庆出版社,2005:1-4.
[2]段瑞峰,刘卫,龙超良,等.高原肺水肿易感基因多态性的全基因组关联分析[J].中国应用生理学志,2014,30(02):101-105+195.
[3]罗勇军,高钰琪.高原肺水肿遗传易感性机制的研究进展.中华结核和呼吸杂志,2011,34(2)135-137.
[4]杨应忠,王亚平,胥瑾,等.九个候选SNP位点与汉族HAPE相关性分析[J].青海医学院学报,2014,35(03):153-159.
[5]Klein K,Jngst C,Mwinyi J,et al.The human organic anion transporter genes OAT5 and OAT7 are transactivated by hepatocyte nuclear factor-1α(HNF-1α)[J].Molecular Pharmacology,2010,78(6):1079.
[6]Ahn S K,Suh C K,Cha S H.Polymorphisms of SLC22A9(hOAT7)in Korean Females with Osteoporosis[J].Korean Journal of Physiology & Pharmacology,2015,19(4):319-325.
[7]Ogasawara K,Terada T,Motohashi H,et al.Analysis of regulatory polymorphisms in organic ion transporter genes(SLC22A)in the kidney[J].Journal of Human Genetics,2008,53(7):607-614.
[8]Yokoyama H,Anzai N,Ljubojevic M,et al.Functional and Immunochemical Characterization of a Novel Organic Anion Transporter Oat8(Slc22a9)in Rat Renal Collecting Duct[J].Cellular Physiology & Biochemistry International Journal of Experimental Cellular Physiology Biochemistry & Pharmacology,2008,21(4):269.
[9]杜建财.SLC22A12和SLC2A9基因多态性与高尿酸血症关联性研究[D].宁夏医科大学,2016.
[10]项荣.RTN3/HAP与几种蛋白的相互作用及其功能研究[D].武汉大学,2006.
[11]周金武,程肖蕊,周文霞,等.Reticulons家族蛋白研究进展[J].生命科学,2009,21(04):517-523.
[12]Fernandez T,Morgan T,Davis N,et al.Disruption of contactin 4(CNTN4)results in developmental delay and other features of 3p deletion syndrome[J].American Journal of Human Genetics,2004,74(6):1286-1293.
[13]李学良,许朝霞,王忆勤.支气管哮喘发病机制的研究进展[J].中华中医药学刊,2012,30(09):1960-1963.
[14]黄博.人qki基因启动子克隆及TNF对qki基因转录调控的初步研究[D].第四军医大学,2007.
