饥饿对不同性别大黄鱼肌肉营养成分的影响研究
2017-03-08刘阳阳吕小康
刘阳阳,刘 峰,楼 宝,吕小康,马 涛
(1.浙江海洋大学海洋科学与技术学院,浙江舟山 316022;2.浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江省海水增养殖重点实验室,浙江舟山 316021)
大黄鱼Larimichthys crocea,隶属于鲈形目Perciformes、石首鱼科Sciaenide,分布于黄海、东海、南海等区域[1],是我国“四大海产”之一,具有非常重要的经济价值。大黄鱼营养丰富,深受人们的喜爱。随着大黄鱼人工养殖业的快速发展,大黄鱼肌肉品质急剧下降,出现肉质松软、口感差以及脂肪含量过高等不良性状[2],因此,改善大黄鱼肉质成为推进大黄鱼养殖业发展的重要途径。投喂策略作为改善鱼类肉质的一个重要手段,已经在生产实践中得到积极而广泛的应用[3],其中一个重要的措施是在养殖鱼上市前,对其进行一段时间的禁食处理,促使其清空肠道,获得更高新鲜度的鱼产品[4-5],以其优质的品质赢得消费者青睐。通过适当的禁食处理,可以切断外源性营养物质的补充,有效减少机体内脂肪积累,从而缓解因脂肪过高而呈现的出肉率低、质地松软等症状[6-7]。此外,通过禁食实现饥饿胁迫会影响鱼类生理生化过程及行为特征等,如银鲳Pampus argenteus幼鱼受到饥饿胁迫时,体质量和肥满度会显著下降[8];海拟鲤Rutilus rutilus caspicus在饥饿胁迫条件下体内蛋白酶、淀粉酶以及脂肪酶的活性降低[9];太平洋鲑Oncorhynchus spp[10]、吉富罗非鱼Oreochromis niloticus[11]、虹鳟Oncorhynchus mykiss[12]受到饥饿胁迫时,其体内脂肪和蛋白质含量均出现一定程度的降低。肌肉中各营养成分的组成及含量与肌肉品质密切相关,因此,探究饥饿胁迫对鱼类肌肉营养成分的影响对于通过适当的禁食处理提高鱼类的肌肉品质有重要指导意义。
目前,对于大黄鱼的研究主要集中在基础生物学和种质资源状况[13-14]等方面,饥饿对大黄鱼的影响虽然已有一些报道,如徐浩等[15]研究发现低温和饥饿会显著提高大黄鱼血清中蛋白质产物和脂类物质;张振宇等[16]研究发现大黄鱼粗脂肪含量随着禁食时间的延长而持续降低。但是,关于禁食对达到上市规格的不同性别大黄鱼肌肉品质的影响尚未见报道。因此,本研究以即将上市的不同性别大黄鱼为研究对象,在自然海区养殖条件下,通过不同程度的禁食处理,探讨饥饿对不同性别大黄鱼的影响,为获得高品质大黄鱼提供更加详实的数据资料。
1 材料与方法
1.1 实验时间和条件
实验于2016年10月中旬在舟山登步岛近岸海水养殖网箱中进行,所用网箱为3 m×3 m×3 m规格2.5目的尼龙材质无结网箱。实验过程中海区水温从27℃逐渐降低到15℃,海水盐度26~28,水流速度约1.5~2.0 m/s。
1.2 实验鱼及实验设计
实验大黄鱼为同一海区网箱养殖群体,随机选取400 g左右体质健壮的养殖大黄鱼600尾,随机分为2组,每组3个平行,每个平行100尾,养殖于6个相邻的网箱中,实验开始前暂养7 d,每天2次饱食投喂。所用配合颗粒饲料为鱼宝7#(产自日本林兼产业株式会社),主要组成为:粗蛋白56%、粗灰分18%、粗脂肪9.0%、粗纤维4.0%、总磷1.0%、钙1.5%。。实验开始时,对照组正常投喂,实验组停止投喂,实验持续60 d。分别于实验开始的0、20、40、60 d对实验组和对照组各取样60尾,每个平行20尾,测量体质量,解剖观察性腺判定其性别后取其背部肌肉,-80℃低温保存,备用。
1.3 营养成分测定
肌肉常规营养成分采用AOAC(1995)中的方法测定。粗蛋白含量测定采用凯氏定氮法;粗脂肪含量测定采用索氏抽提法;粗灰分含量测定采用550℃马弗炉灼烧法;氨基酸测定采用氨基酸自动分析仪;脂肪酸含量测定采用气相色谱法。
1.4 数据分析
按照如下公式计算各营养成分含量在实验组与同期对照组之间的变化率:
变化率(%)=(实验组含量-对照组含量)/对照组含量×100
实验数据用SPSS19.0软件进行统计分析,采用独立样本T检验方法分析雌雄样本之间、实验组与对照组之间差异显著性,对不同取样时间营养成分含量进行单因素方差分析(One-way ANOVA),多重比较采用Duncan’s法。实验结果用平均值±标准误(Mean±SE)表示。
2 结果
2.1 实验鱼取样数量及生长指标
对各取样时期,对照组和实验组中取样数量进行了计数,结果列于表1。实验过程中实验鱼体质量的分析结果列于表2。由表2可知,随着禁食时间的延长,雌性和雄性大黄鱼体质量均显著降低(雌鱼从467.25±26.35 g 下降至 330.58±15.90 g,雄鱼从 363.23±17.82 g 下降至 310.67±13.52 g)。禁食 0~40 d,雌性大黄鱼体质量与其对照组差异不显著,禁食至60 d时显著小于对照组(变化率-17.66%);雄性大黄鱼在禁食20 d时,其体质量已经显著小于同期对照组(变化率-18.64%),由此得知,禁食过程中,雌性大黄鱼体质量下降速度小于雄性。

表1 各个时间点取样数量汇总Tab.1 Summarized of the number at each sampling time point

表2 禁食对大黄鱼体质量的影响分析1)Tab.2 Effective analysis of fasting on body weight of large yellow croaker
2.2 常规营养成分分析
大黄鱼背肌的常规营养成分分析结果见表3。由表3可知,禁食对雌性和雄性大黄鱼肌肉中粗脂肪、粗蛋白及粗灰分含量具有较大影响。其中,随着禁食时间的延长,雌性和雄性大黄鱼粗脂肪含量均发生了显著变化。雌性大黄鱼背肌中粗脂肪含量禁食20 d显著降低16.39%,继续禁食至40 d降低19.98%;雄性的粗脂肪含量在禁食早期与对照组差异不显著,经过60 d的禁食后显著降低29.35%。由此可知,在不同禁食时期雌性大黄鱼粗脂肪含量的变化幅度大于雄性。此外,粗脂肪含量在实验开始时未表现出显著的雌雄差异,但是禁食后差异显著。
粗蛋白含量随着禁食时间的延长在雌性和雄性大黄鱼中均发生显著变化。与同期对照组相比,雌鱼禁食20、40、60 d粗蛋白含量显著升高8.34%,5.17%和8.49%;雄鱼在禁食至60 d时粗蛋白含量显著升高19.44%,而在此之前变化不显著。与同期对照组相比,雌性大黄鱼粗灰分含量在禁食40 d时显著降低24.17%,而雄性中在禁食60 d时显著升高40.38%。同样,粗灰分含量在实验初始即表现出显著的雌雄差异,但是在禁食20 d的和60 d时雌雄之间差异不显著。
粗脂肪和粗蛋白的比较发现,雌性禁食20 d和40 d时粗脂肪含量显著降低,而粗蛋白含量显著升高;雄性在禁食早期粗脂肪和粗蛋白含量均未发生显著变化,直到60 d时粗脂肪含量显著降低、粗蛋白含量显著升高,由此可知,禁食过程中,大黄鱼首先分解利用体内脂肪,在脂肪消耗到一定程度后开始利用蛋白质供能。
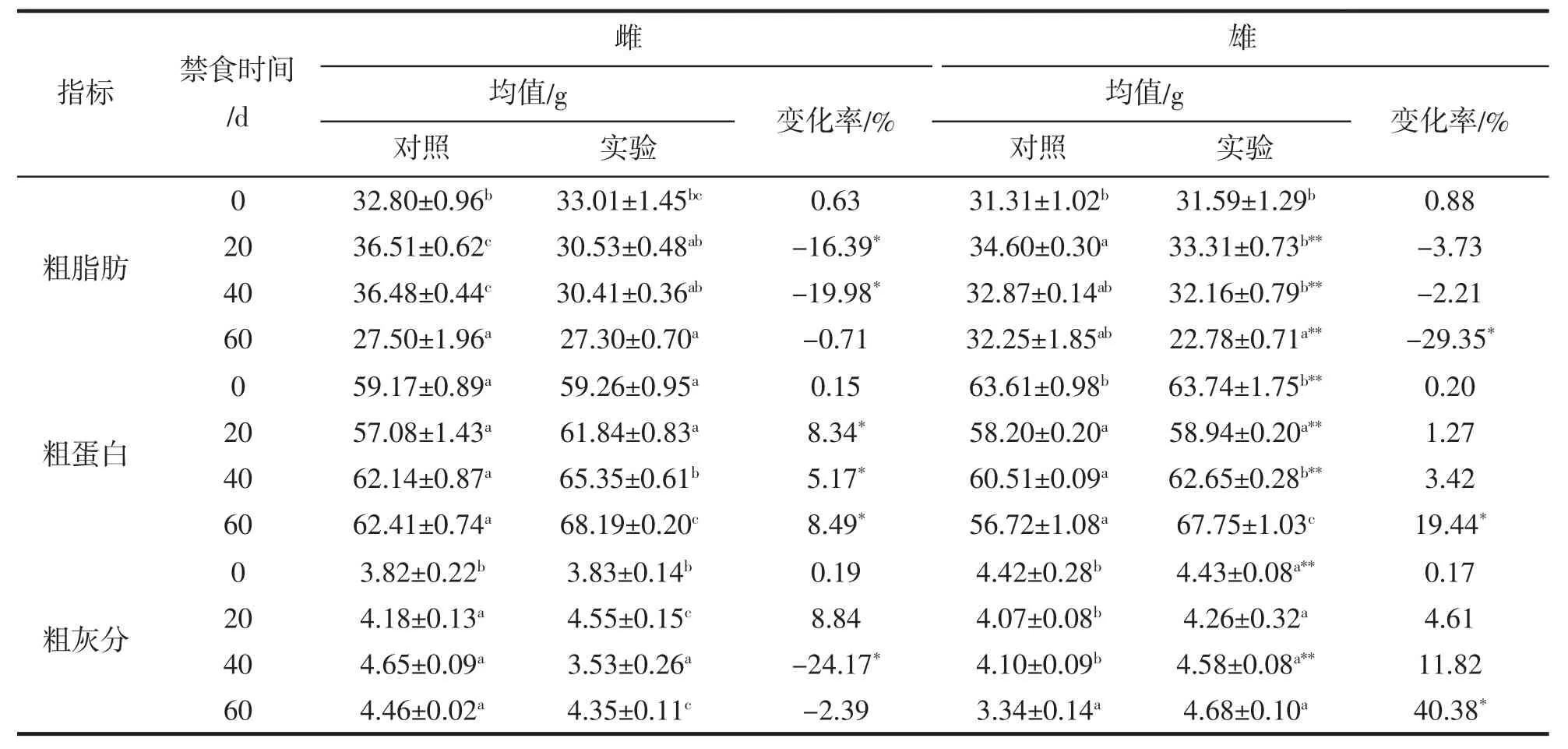
表3 禁食对大黄鱼肌肉中生化组成成分的影响(干物质基础)%Tab.3 Effects of fasting on the biochemical composition of muscle in L.crocea (based on dry matter)%
2.3 氨基酸组成
本研究分析了7种必需氨基酸(苏氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸和赖氨酸),结果列于表4。由表4可知,雌性和雄性大黄鱼肌肉中必需氨基酸含量在不同禁食处理组之间差异显著,说明禁食对大黄鱼背肌中必需氨基酸含量同样具有较大影响。禁食20 d时,雌性中除蛋氨酸之外的6种必需氨基酸含量均显著低于其同期对照组,变化率在-16.17%~-17.58%之间;而雄性中,除了蛋氨酸之外的6种必需氨基酸含量虽然出现一定程度的降低(变化率:-2.54~-5.44%),但是与对照组差异不显著。禁食40 d时,雌性和雄性大黄鱼中所有必需氨基酸含量与对照组差异不显著。禁食60 d时,除了雌性中的蛋氨酸,其余必需氨基酸含量在雌性和雄性大黄鱼中均显著增加。
蛋氨酸与其他氨基酸含量变化情况存在较大差异,雌性的6种必需氨基酸在经过禁食20 d时的显著降低之后,缓慢回升,至40 d时其含量稍微高于同期对照组,而蛋氨酸在禁食20 d时并没有显著降低,与其余必需氨基酸变化不同,禁食至40 d时仍然表现为低于同期对照组,同样与其他必需氨基酸不同,推测可能是雌鱼中蛋氨酸含量变化滞后于其他几种必需氨基酸。雄性中蛋氨酸含量变化情况与雌鱼存在一定差异,禁食20 d蛋氨酸含量表现为增加(35.44%),与其他必需氨基酸含量变化正好相反,推测可能是在20 d的禁食过程中,雄鱼背肌中蛋氨酸含量迅速下降并进行缓慢回升,到20 d时已经回升到高于其同期对照组的水平。雌雄差异性分析得知,实验初始时,雌性大黄鱼背肌中必需氨基酸含量显著高于雄性,禁食处理后必需氨基酸含量在雌雄鱼之间发生了较大变化:禁食20 d时,雌性中只有亮氨酸含量显著高于雄性;禁食40 d时,雌性中有苏氨酸、异亮氨酸和赖氨酸含量均显著高于雄性;禁食60 d时,雌雄之间所有必需氨基酸含量差异不显著。
对非必需氨基酸含量的分析表明,9种非必需氨基酸含量在不同禁食处理组中存在显著差异(雌性中的组氨酸除外),其变化情况与必需氨基酸类似(表5)。雌性中9种非必需氨基酸含量在禁食20 d时均表现为显著降低(14.80%~17.59%),禁食40 d时变化不显著,而禁食60 d时显著增加(42.22%~64.89%)。雄鱼的9种非必需氨基酸含量在禁食20 d和40 d时,均未发生显著变化;禁食60 d时,显著增加(33.51%~79.75%)。雌雄比较得知,实验初始时9种非必需氨基酸在雌性中的含量显著高于雄性,禁食40 d后,仅有丝氨酸含量仍然显著高于雄性,其余非必需氨基酸在雌雄性之间均无显著差异。
2.4 脂肪酸组成
本研究还进行了禁食对脂肪酸含量的影响分析,结果列于表6。与同期对照组相比,禁食20 d时,雌性中SFA和MUFA含量轻微升高,而PUFA含量显著降低6.28%,说明PUFA被消耗利用;雄性中SFA和PUFA含量轻微升高,而MUFA含量一定程度降低,说明此时利用MUFA。禁食40 d时,雌性中SFA和MUFA含量轻微下降,而PUFA含量有所升高;雄性中SFA含量显著增加4.44%,而MUFA和PUFA含量稍有降低。禁食60 d时,雌性中SFA和MUFA含量降低,其中MUFA变化显著(-4.52%),PUFA含量显著增加11.91%,说明此时MUFA被消耗利用,导致PUFA含量相对增加;雄性中SFA含量有所增加,MUFA和PUFA含量均有不同程度降低。
禁食20 d时,雌性大黄鱼背肌中∑n-3PUFA、∑n-6PUFA和∑n-9PUFA含量均降低,其中∑n-6PUFA变化显著(-19.26%);雄性中,∑n-3PUFA含量增加,而∑n-6PUFA和∑n-9PUFA含量稍有下降。禁食40 d时,雌性和雄性中∑n-3PUFA含量均增加,而∑n-6PUFA和∑n-9PUFA含量降低。禁食60 d时,雌性中SFA和∑n-6PUFA含量增加,而∑n-9PUFA含量稍有降低;雄鱼中∑n-3PUFA和∑n-9PUFA含量降低,而∑n-6PUFA含量增加。上述结果表明,雌雄大黄鱼饥饿条件下利用PUFA组分的先后顺序均为:∑n-6PUFA>∑n-9PUFA>∑n-3PUFA。此外,雌性和雄性大黄鱼中的DHA含量在禁食20 d时分别显著增加3.65%和7.97%,由此可知,一定程度的禁食处理可以增加DHA的含量,获得高品质的大黄鱼。
脂肪酸组分含量的比较发现,禁食早期(0~20 d)EPA、DHA和∑n-3PUFA含量在雌雄鱼之间差异显著,表现为雄性高于雌性,但是随着禁食时间的延长,雌雄之间的差异变为不显著。PUFA和∑n-6PUFA含量在实验初始(0 d)时,雌雄之间差异不显著,但是分别在禁食20 d和40 d时,表现出显著差异,继续禁食再次变为差异不显著。∑n-9MUFA含量在实验初始(0 d)时表现出显著的雌雄差异,但是禁食开始后,变为差异不显著,由此可知,不同脂肪酸组分在雌雄之间的差异性因禁食时间的不同而发生变化。

表4 禁食对大黄鱼肌肉中必须氨基酸组分含量的影响(干物质基础)%Tab.4 Effects of fasting on the essential amino acids of muscle in L.crocea (based on dry matter)%

表5 禁食对大黄鱼肌肉中非必须氨基酸组分含量的影响(干物质基础)%Tab.5 Effects of fasting on the non-essential amino acids of muscle in L.crocea (based on dry matter)%

表6 禁食对大黄鱼肌肉中脂肪酸组分含量的影响(干物质基础)%Tab.6 Effects of fasting on the fatty acids of muscle in L.crocea (based on dry matter)%
3 讨论
3.1 不同处理组大黄鱼肌肉常规营养成分分析
饥饿状态下的鱼类,通过内源性代谢消耗自身的营养成分满足生长代谢所需[17],不同的鱼类利用自身营养成分的先后顺序有一定差异,常见的为首先利用脂肪,待脂肪大量消耗之后开始利用蛋白质,如南方鲇 Silurus meridionalis[18]、泥鳅 Misgurnus anguillillcaudatu[19]、刀鲚 Coilia nasus[20]和美国红鱼 Sciaenops ocel latus[21];另外一种是先利用蛋白质,然后利用脂肪,如鲑鳟鱼类[22]。本次研究中,禁食20 d的大黄鱼粗脂肪含量下降,禁食40 d时粗蛋白含量下降,继续禁食达到60 d时,脂肪含量又出现明显降低。由此可知,大黄鱼成鱼在饥饿早期主要分解利用脂肪提供能量,随着脂肪大量消耗,开始利用蛋白质供能,随后由于一些蛋白质作为功能性物质需要保留,此时将再次分解利用脂肪。此结果与上述的第一类相符合,即鱼类在禁食初期主要以脂肪作为能量来源,只有在脂肪被大量消耗后,蛋白质才作为能源物质[23-24]。
3.2 饥饿对大黄鱼肌肉氨基酸的影响
饥饿对鱼体内氨基酸的影响研究已有一些报道,如点带石斑鱼Epinephelus malabaricus饥饿10 d后肌肉中氨基酸总量和必需氨基酸总量显著降低[25];鮸鱼Miichthys miiuy饥饿期间氨基酸总量和必需氨基酸总量均呈一定的下降趋势[26];遮目鱼Chanos chanos在饥饿60 d时,组氨酸、天冬氨酸、脯氨酸含量和氨基酸总量显著下降[27]。说明鱼类受到饥饿胁迫时,可以将氨基酸转化成其他物质提供能量[28]。本研究分析的16种氨基酸中,除了蛋氨酸之外,雌性和雄性大黄鱼中15种氨基酸含量及氨基酸总量在禁食20 d时均降低,其中雌性降低显著,表明雌性在禁食早期体内氨基酸被大量消耗利用,相比较而言雄性被利用较少,说明氨基酸的利用在雌雄鱼之间存在一定差异。本次研究结果与上述已有报道相类似,即在饥饿条件下,氨基酸被分解供能。本次研究还得出,禁食60 d的雌性和雄性大黄鱼肌肉中氨基酸组分含量均显著升高,所以通过一定强度的禁食处理可以改变氨基酸组分的含量,进而改善大黄鱼肌肉品质。
3.3 饥饿对大黄鱼肌肉脂肪酸的影响
已有报道指出不同鱼类在饥饿期间对脂肪酸的利用情况不同,如虹鳟Oncorhynchus mykiss[29]、锦鲤Cyprinus carpio[30]、匙吻鲟Polyodon spathula[31]以及斑点叉尾鮰Ictalurus punctatus[32]等在饥饿期间SFA和MUFA含量显著下降,PUFA含量上升。在饥饿状态下,非洲胡子鲇Clarias gariepinus体内SFA含量下降,MUFA和PUFA含量均上升[33];瓦氏黄颡鱼Pelteobagrus vachelli肌肉中的MUFA含量显著下降,而PUFA含量显著上升[34]。本次研究中,大黄鱼在饥饿状态下,雌性体内PUFA最先被利用,而SFA最后利用,此结果与张振宇等[16]研究大黄鱼的报道结果相似,但是雄性个体内MUFA最先被利用,由此表明,区分性别进行研究非常有必要。饥饿状态下,机体利用PUFA组分的先后顺序也因鱼种而异,鮸鱼[26]、金头鲷Sparus aurata[37]和胭脂鱼Myxocyprinus asiaticus[38]等在饥饿状态下对体内PUFA的利用顺序为:∑n-6PUFA>∑n-9MUFA>∑n-3PUFA;而大鳍鱯为:∑n-9PUFA>∑n-3 PUFA>∑n-6 PUFA[39]。本次研究得出,饥饿期间,大黄鱼雌性和雄性利用PUFA的顺序基本一致,均为:∑n-6PUFA>∑n-9MUFA>∑n-3PUFA,此研究结果与鮸鱼和金头鲷相一致,但是与张振宇等关于∑n-3PUFA的报道结果有所差异,可能原因是禁食时间不同及采用的实验鱼规格不同。
此外,雌雄鱼肌肉中DHA含量在禁食20 d时显著高于同期对照组,而EPA变化不显著,此结果与林黑着等[40]研究斜带石斑鱼Epinephelus coioides所得结果有一定差异,可能是由鱼种、规格及养殖环境差异所致。DHA具有软化血管、健脑益智、改善视力的功效,因此通过一定程度的禁食处理获得高DHA含量的大黄鱼将带来更大的经济价值。本研究发现EPA、DHA和∑n-3PUFA含量在禁食早期(0~20 d)有显著的雌雄差异,但是随着禁食时间的延长,雌雄差异变为不显著。∑n-6PUFA和PUFA含量在实验初始(0 d)时,雌雄差异不显著,但是经过禁食之后变为差异显著。由此可知,适当的饥饿处理可以改变脂肪酸在雌雄大黄鱼肌肉中的相对含量,因此,对大黄鱼进行禁食处理时,需要对雌鱼和雄鱼进行区别对待,这一研究结果对于通过适当的禁食处理改善大黄鱼肌肉品质具有较大的指导意义。
[1]朱元鼎,伍汉霖.福建鱼类志(下卷)[M].福州:福建科技出版社,1985:101-136.
[2]颜孙安,姚清华,林香信,等.不同养殖模式大黄鱼肌肉营养成分比较[J].福建农业学报,2015,30(8):736-744.
[3]ANDERSEN H J,OKSBJERG N,YOUNG J F,et al.Feeding and meat quality-A future approach[J].Meat Science,2005,70(3):543-554.
[4]GINÉS R,PALICIO M,ZAMORANO M J,et al.Starvation before slaughtering as a tool to keep freshness attributes in gilthead sea bream (Sparus aurata)[J].Aquaculture International,2002,10(5):379-389.
[5]李海燕,朱晓鸣,韩 冬,等.上市前限喂对池塘养殖异育银鲫生长及品质的影响[J].水生生物学报,2014,38(3):525-532.
[6]THAKUR DP,MORIOKA K,ITOH Y,et al.Influence of muscle biochemical constituents on the meat texture of cultured yellowtail(Seriola quinqueradiata)at different anatomical locations[J].Journal of the Science of Food and Agriculture,2002,82(13):1 541-1 550.
[7]THAKUR D P,MORIOKA K,ITOH Y,et al.Lipid composition and deposition of cultured yellowtail Seriola quinqueradiata muscle at different anatomical locations in relation to meat texture[J].Fisheries Science,2003,69(3):487-494.
[8]王腾飞,郭晓鸽,谷江稳,等.饥饿及过量投喂下银鲳幼鱼形态学指标及体成分变化[J].海洋学研究,2015,33(4):83-89.
[9]ABOLFATHI M,HAJIMORADLOO A,GHORBANI R,et al.Effect of starvation and refeeding on digestive enzyme activities in juvenile roach,Rutilus rutilus caspicus[J].Comp Biochem Physiol A Mol Integr Physiol,2012,161(2):166-173.
[10]陈 斌,冯 健,吴 彬,等.饥饿对太平洋鲑(Oncorhynchus spp.)鱼体脂肪与脂肪酸的影响[J].海洋与湖沼,2012,43(6):1 247-1 253.
[11]田 娟,涂 玮,曾令兵,等.饥饿和再投喂期间尼罗罗非鱼生长、血清生化指标和肝胰脏生长激素、类胰岛素生长因子-I和胰岛素mRNA表达丰度的变化[J].水产学报,2012,36(6):900-907.
[12]BASTROP R,JÜRSS K,WACKE R.Biochemical parameters as a measure of food availability and growth in immature rainbow trout(Oncorhynchus mykiss)[J].Comparative Biochemistry and Physiology,1992,102(1):151-161.
[13]姜建湖,闫家强,竺俊全,等.大黄鱼精子的超低温冻存及细胞结构损伤的检测[J].农业生物技术学报,2011,19(4):725-733.
[14]张其永,洪万树,杨圣云,等.大黄鱼地理种群划分的探讨[J].渔业信息与战略,2011,26(2):3-8.
[15]徐 浩,张东玲,陈庆凯,等.低温下饥饿胁迫对大黄鱼血清生化指标的影响[J].生物技术通报,2015,31(6):195-199.
[16]张振宇,王秋荣,叶 坤,等.禁食对养殖大黄鱼体成分、肌肉脂肪酸组成和血清生化指标的影响[J].水产学报,2016,40(9):1 440-1 450.
[17]龙章强,彭士明,陈立侨,等.饥饿与再投喂对黑鲷幼鱼体质量变化、生化组成及肝脏消化酶活性的影响[J].中国水产科学,2008,15(4):606-614.
[18]谢小军,邓 利,张 波.饥饿对鱼类生理生态学影响的研究进展[J].水生生物学报,1998,22(2):181-188.
[19]吴立新,蔡 勋,陈 炜.饥饿和再喂食对泥鳅生化组成的影响[J].生态学杂志,2006,25(1):101-104.
[20]金 鑫,徐钢春,杜富宽,等.饥饿胁迫对刀鲚形体、体成分及血液生化指标的影响[J].动物学杂志,2014,49(6):897-903.
[21]姜志强,贾泽梅,韩延波.美国红鱼继饥饿后的补偿生长及其机制[J].水产学报,2002,26(1):67-72.
[22]MOMMSEN T P,FRENCH C J,HOCHACHKA P W.Sites and patterns of protein and amino acid utilization during the spawning migration of salmon[J].Canadian Journal of Zoology,2011,58(10):1 785-1 799.
[23]WHYTE J N C,ENGLAR J R,CARSWELL B L,et al.Influence of starvation and subsequent feeding on body composition and energy reserves in the Prawn Pandalus platyceros[J].Canadian Journal of Fisheries&Aquatic Sciences,1986,43(43):1 142-1 148.
[24]CALOW P.On the regulatory nature of individual growth:some observations from freshwater snails[J].Journal of Zoology,1973,170(4):415-428.
[25]陈 波,柳敏海,施兆鸿,等.饥饿和再投饲对点带石斑鱼幼鱼脂肪酸和氨基酸组成的影响[J].上海海洋大学学报,2008,17(6):674-679.
[26]柳敏海,罗海忠,傅荣兵,等.短期饥饿胁迫对鮸鱼生化组成、脂肪酸和氨基酸组成的影响[J].水生生物学报,2009,33(2):230-235.
[27]SHIAU C Y,PONG Y P,CHIOU T K,et al.Effect of starvation on free histidine and amino acids in white muscle of milkfish Chanos chanos[J].Comp Biochem Physiol B Biochem Mol Biol,2001,128(3):501-506.
[28]张 涛,平洪领,史会来,等.周期性饥饿再投喂对曼氏无针乌贼(Sepiella japonica)幼体生长、体组成及氨基酸和脂肪酸的影响[J].海洋与湖沼,2017,48(1):190-197.
[29]KIESSLING A,JOHANSSON L,STOREBAKKEN T.Effects of reduced feed ration levels on fat content and fatty acid composition in white and red muscle from rainbow trout[J].Aquaculture,1989,79(1/4):169-175.
[30]MURATA H,Higashi T.Selective utilization of fatty acid as energy source in carp[J].Nihon Suisan Gakkaishi,1980,46(11):1 333-1 338.
[31]聂文强,李 婧,吉 红,等.匙吻鲟稚鱼摄食节律与饥饿对其体脂肪酸组成的影响[J].水产科学,2017,36(1):36-41.
[32]谭肖英,罗 智,王为民,等.饥饿对小规格斑点叉尾鮰体重及鱼体生化组成的影响[J].水生生物学报,2009,33(1):39-45.
[33]ZAMAL H,OLLEVIER F.Effect of feeding and lack of food on the growth,gross biochemical and fatty acid composition of juvenile catfish[J].Journal of Fish Biology,1995,46(3):404-414.
[34]覃川杰,邵 婷,杨洁萍,等.饥饿胁迫对瓦氏黄颡鱼脂肪代谢的影响[J].水生生物学报,2015,39(1):58-65.
[35]DOBSON S H,HOLMES R M.Compensatory growth in the rainbow trout,Salmo gairdneri Richardson[J].Journal of Fish Biology,1984,25(6):649-656.
[36]KIM M K,LOVELL R T.Effect of restricted feeding regimens on compensatory weight gain and body tissue changes in channel catfish Ictalurus punctatus in ponds[J].Aquaculture,1995,135(4):285-293.
[37]KOVEN W M,KISSIL G W,TANDLER A.Lipid and n-3 requirement of Sparus aurata,larvae during starvation and feeding[J].Aquaculture,1989,79(1/4):185-191.
[38]王 川,郭海燕,李秀明,等.延迟首次投喂对胭脂鱼仔鱼氨基酸和脂肪酸的影响[J].水产学报,2015,39(1):75-87.
[39]马 珊,姜海波,姚俊杰.短期饥饿对大鳍鱯生化组成、氨基酸和脂肪酸组成的影响[J].水生态学杂志,2010,31(2):61-65.
[40]林黑着,刘永坚,何建国,等.饥饿对斜带石斑鱼肝脏和肌肉脂肪酸组成的影响[J].南方水产科学,2006,2(4):1-6.
