不同浓度尿酸对体外培养肾小管上皮细胞氧化应激及凋亡的影响
2017-03-07丁红杨琦李慧敏
丁红,杨琦,李慧敏
(中国医科大学附属第四医院肾内科,辽宁 沈阳110032)
不同浓度尿酸对体外培养肾小管上皮细胞氧化应激及凋亡的影响
丁红,杨琦,李慧敏
(中国医科大学附属第四医院肾内科,辽宁 沈阳110032)
目的 探讨不同浓度尿酸对肾小管上皮细胞氧化应激及凋亡的影响。方法 将人近曲小管上皮细胞株(HKC⁃8)随机分为对照组和尿酸A组、尿酸B组和尿酸C组,每组15例,对照组加入培养液,尿酸A组、尿酸B组和尿酸C组分别加入0.1 mmol/L、0.4 mmol/L和0.8 mmol/L尿酸,培养24 h,光泽精化学发光法检测各组肾小管上皮细胞内超氧阴离子生成量,紫外分光光度法检测还原型辅酶ⅡNADPH酶蛋白水平,脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)检测肾小管上皮细胞凋亡率。结果 尿酸A组、B组和C组肾小管上皮细胞内超氧阴离子生成量和NADPH酶蛋白水平高于对照组,且呈剂量依赖,差异均有统计学意义(P<0.05);尿酸A组、B组和C组肾小管上皮细胞凋亡率高于对照组,亦呈剂量依赖,差异均有统计学意义(P<0.05);尿酸A组、B组和C组肾小管上皮细胞凋亡率分别为(73.4±11.7)%、(322.6±23.2)%、(432.7±34.1)%,均高于对照组的(16.9±1.2)%,差异均有统计学意义(P<0.05)。结论 尿酸干预能够影响肾小管上皮细胞内超氧阴离子生成量、NADPH酶蛋白水平和肾小管上皮细胞凋亡率,尿酸浓度越高,超氧阴离子生成量、NADPH酶蛋白水平和肾小管上皮细胞凋亡率越高。
尿酸;肾小管上皮细胞;超氧阴离子;NADPH酶蛋白;凋亡
高尿酸血症和各种肾脏疾病关系密切,任何原因引起的肾脏损害都会使血尿酸水平升高,肾脏损害和高尿酸血症之间为恶性循环[1-2]。NADPH氧化酶的催化产物活性氧参与信息传递和机体防御等多种生理过程[3],NADPH氧化酶激活后,产生过多的活性氧,介导机体发生应激损伤[4-5]。肾小管上皮细胞为尿酸的直接靶器官之一,尿酸是否参与肾脏的氧化应激反应,损伤肾小管上皮细胞本研究在体外将不同浓度尿酸和肾小管上皮细胞共同培养,探讨不同浓度尿酸对体外培养肾小管上皮细胞的影响。
1 材料与方法
1.1 材料 人近曲小管上皮细胞株(HKC-8)由美国匹兹堡大学刘友华教授惠赠,DMEM-F12培养液、胎牛血清(杭州科易生物技术有限公司)。
1.2 方法HKC-8细胞用含5%胎牛血清(FBS)及抗生素的DMEM-F12培养液传代培养,HKC接种于六孔板中,细胞融合到70%时无血清同步24 h,进入实验。随机将其分为对照组、尿酸A组、尿酸B组和尿酸C组各5例。对照组加入培养液,尿酸A组、尿酸B组和尿酸C组分别加入0.1 mmol/L、0.4 mmol/L和0.8 mmol/L尿酸,培养24 h。
1.2.1 超氧阴离子生成量测定 收集每组细胞,采用光泽精化学发光法进行超氧阴离子生成量测定:加入Krebs-Hepes液中孵育,再加入光泽精,在化学发光检测仪上测定,测定结果以相对发光单位表示。
1.2.2 肾小管上皮细胞内NADPH酶蛋白水平测定 将培养的细胞加入裂解液进行裂解,收集上清液检测,用缓冲液把NADPH配制成不同浓度溶液进行孵育后,紫外分光光度计测定相应吸光度值。
1.2.3 肾小管上皮细胞凋亡测定 采用TUNEL法测定肾小管上皮细胞的凋亡情况。收集上述培养的细胞,进行涂片,丙酮固定,Triton X-100进行破膜,胃蛋白酶消化,磷酸盐缓冲液(PBS)洗涤,切片上加入TdT酶缓冲液,再加入碱性磷酸酶反应液反应半小时,色缸内加入含过氧化氢的PBS液反应,将切片放置到色缸中,加入缓冲液保温半小时,PBS洗涤切片,切片上加入过氧化物酶标记的抗体反应半小时,加入NBT/BCIP显色,二甲苯脱水,显微镜下观察并计数每个视野内1 000个肾小管细胞内凋亡细胞的数量,计算肾小管上皮细胞的凋亡率。
1.3 观察指标 观察各组肾小管上皮细胞内超氧阴离子生成量、NADPH酶蛋白水平和肾小管上皮细胞凋亡率。
1.4 统计学方法 应用SPSS20.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,多组均数比较采用单因素方差分析,两两均数比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组肾小管上皮细胞内超氧阴离子生成量比较 由表1看出,尿酸A组、尿酸B组和尿酸C组肾小管上皮细胞内超氧阴离子生成量高于对照组,且随着尿酸浓度增加肾小管上皮细胞内超氧阴离子生成量明显增加,呈剂量依赖,差异均有统计学意义(P<0.05),表明尿酸干预能够增加肾小管上皮细胞内超氧阴离子生成量。
表1 各组肾小管上皮细胞内超氧阴离子生成量比较(±s)
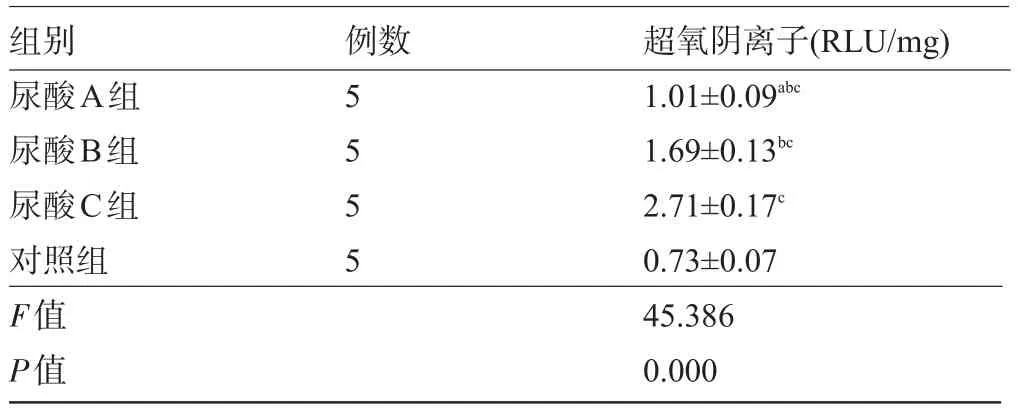
表1 各组肾小管上皮细胞内超氧阴离子生成量比较(±s)
注:与尿酸B组比较,aP<0.05;与尿酸C组比较,bP<0.05;与对照组比较,cP<0.05。
组别尿酸A组尿酸B组尿酸C组对照组F值P值例数5 5 5 5超氧阴离子(RLU/mg) 1.01±0.09abc1.69±0.13bc2.71±0.17c0.73±0.07 45.386 0.000
2.2 各组肾小管上皮细胞内NADPH酶蛋白比较 由表2看出,尿酸A组、尿酸B组和尿酸C组肾小管上皮细胞内NADPH酶蛋白水平高于对照组,随着尿酸浓度增加肾小管上皮细胞内NADPH酶蛋白水平亦明显升高,呈剂量依赖,差异均有统计学意义(P<0.05)。
表2 各组肾小管上皮细胞内NADPH酶蛋白比较()

表2 各组肾小管上皮细胞内NADPH酶蛋白比较()
注:与尿酸B组比较,aP<0.05;与尿酸C组比较,bP<0.05;与对照组比较,cP<0.05。
组别 例数NADPH酶蛋白(µmol/mg)尿酸A组尿酸B组尿酸C组对照组F值P值5 5 5 5 1.02±0.1abc1.91±0.15bc2.69±0.22c0.88±0.10 52.981 0.000
2.3 各组肾小管上皮细胞凋亡率比较 由表3看出,尿酸A组、尿酸B组和尿酸C组肾小管上皮细胞凋亡率高于对照组,随尿酸浓度增加肾小管上皮细胞凋亡率增高,呈剂量依赖,差异均有统计学意义(P<0.05),表明尿酸干预能够增加肾小管上皮细胞凋亡。
表3 各组肾小管上皮细胞凋亡率比较(±s)

表3 各组肾小管上皮细胞凋亡率比较(±s)
注:与尿酸B组比较,aP<0.05;与尿酸C组比较,bP<0.05;与对照组比较,cP<0.05。
组别凋亡率(‰)例数尿酸A组尿酸B组尿酸C组对照组F值P值73.4±11.7abc332.6±23.2bc432.7±34.1c16.9±1.2 53.427 0.000 5 5 5 5
3 讨论
长期高尿酸血症是肾脏疾病的主要致病原因[6-7],高尿酸血症和各种肾脏疾病关系密切,任何原因引起的肾脏损害,会导致肾小管的尿酸排泄功能障碍,尿酸的排泄异常,加重高尿酸血症,两者形成恶性循环,最终引起肾脏功能衰竭[8-9]。高尿酸血症通过损伤肾脏血管的途径加重肾脏损伤,高尿酸血症早期引起血管内皮细胞的功能异常,激活肾素-血管紧张素系统,引起肾小球动脉硬化和血管周围炎,降低血中尿酸的浓度,用血管紧张素拮抗剂等能够改善肾脏血管病变,降低高尿酸性高血压,高尿酸血症引起肾脏损害的关键环节是肾脏血管病变,干预肾脏血管病变,能够预防肾脏损伤的发生发展[10]。
高尿酸血症引起肾小动脉损害的机制和氧化应激增加等多种因素有关,氧化应激在多种疾病的发病机制中发挥主要作用,各种因素引起机体氧化还原平衡失调是始动原因,参与氧化应激反应的血管内皮细胞酶体主要有黄嘌呤氧化酶、NADPH氧化酶等。NADPH氧化酶催化的活性氧参与机体的多种生理过程[11],激活NADPH氧化酶能产生过多活性氧,介导氧化应激引起机体损伤,尿酸引起血管内皮损害和NADPH氧化酶引起的氧化应激关系密切[12-13]。肾小管上皮细胞和肾血管的关系密切,肾血管收缩导致肾小管上皮细胞缺血坏死,分泌促纤维化因子和促炎症因子,发生炎症反应,加重肾脏缺血,尿酸经肾小球滤过,经肾小管上皮细胞转运,肾小管上皮细胞尿酸转移障碍,引起血清中尿酸的排泄异常,导致血中尿酸水平升高,引起高尿酸血症。为探讨尿酸对肾小管上皮细胞的影响,本文体外培养肾小管上皮细胞,将其分为对照组和尿酸A组、B组和C组,观察各组肾小管上皮细胞内超氧阴离子生成量、NADPH酶蛋白水平和肾小管上皮细胞凋亡率。结果发现:尿酸A组、尿酸B组和尿酸C组肾小管上皮细胞内超氧阴离子生成量和NADPH酶蛋白水平高于对照组,且呈剂量依赖。尿酸A组、B组和C组肾小管上皮细胞凋亡率高于对照组,亦呈剂量依赖。表明尿酸干预能够增加肾小管上皮细胞内超氧阴离子生成量、NADPH酶蛋白水平和肾小管上皮细胞凋亡率,尿酸浓度越高,超氧阴离子生成量、NADPH酶蛋白水平和肾小管上皮细胞凋亡率越高。尿酸能够使肾小管上皮细胞中NADPH酶蛋白水平增加,NADPH酶蛋白水平促进超阴阳离子生成增加,发生氧化应激,导致肾小管上皮细胞凋亡,尿酸转运体数量变少,引起尿酸转运障碍,引起高尿酸血症,高尿酸血症加重肾小管上皮细胞损害,增加肾小管上皮细胞的凋亡。
综上所述,不同浓度尿酸对体外培养肾小管上皮细胞氧化应激及凋亡有不同的影响,高浓度尿酸会加重肾小管上皮细胞的受损程度,加重肾小管上皮细胞的凋亡。
[1]Yamada A,Sato KK,Kinuhata S,et al.Association of visceral fat and liver fat with hyperuricemia[J].Arthritis Care Res(Hoboken),2016, 68(4):553-561.
[2]Wang YL,Zeng C,Wei J,et al.Association between dietary magnesium intake and hyperuricemia[J].PLoS One,2015,10(11): e0141079.
[3]Wang X,Zhang MM,Wang YJ,et al.The plasma membrane NADPH oxidase OsRbohA plays a crucial role in developmental regulation and drought-stress response in rice[J].Physiol Plant,2016,156(4): 421-443.
[4]Baker JL,Derr AM,Faustoferri RC,et al.Loss of NADH oxidase activity in streptococcus mutans leads to rex-Mediated overcompensation in NAD+Regeneration by lactate dehydrogenase[J].J Bacteriol, 2015,197(23):3645-3657.
[5]Cao YJ,Zhang YM,Qi JP,et al.Ferulic acid inhibits H2O2-induced oxidative stress and inflammation in rat vascular smooth muscle cells via inhibition of the NADPH oxidase and NF-κB pathway[J].Int Immunopharmacol,2015,28(2):1018-1025.
[6]Fernández-Llama P,Calero F.Hyperuricemia and cardiovascular risk: myth or fact?[J].Hipertens Riesgo Vasc,2015,32(4):131-132.
[7]Castillo-Durán C,Sepúlveda AC,Espinoza GA,et al.Hyperuricaemia and metabolic syndrome in obese children and adolescents[J]. Rev Chil Pediatr,2016,87(1):18-23.
[8]Xie DX,Xiong YL,Zeng C,et al.Association between low dietary zinc and hyperuricaemia in middle-aged and older males in China:a cross-sectional study[J].BMJ Open,2015,5(10):e008637.
[9]Guo M,Niu JY,Li SR,et al.Gender differences in the association between hyperuricemia and diabetic kidney disease in community elderly patients[J].J Diabetes Complications,2015,29(8):1042-1049.
[10]陈星华,丁国华.高尿酸血症与肾脏疾病的关系研究进展[J].中国全科医学,2012,15(26):3083-3086.
[11]Almenara CC,Mill JG,Vassallo DV,et al.In vitro fructose exposure overactivates NADPH oxidase and causes oxidative stress in the isolated rat aorta[J].Toxicol In Vitro,2015,29(8):2030-2037.
[12]Madrigal-Matute J,Fernandez-Laso V,Sastre C,et al.TWEAK/Fn14 interaction promotes oxidative stress through NADPH oxidase activation in macrophages[J].Cardiovasc Res,2015,108(1):139-147.
[13]Gang C,Qiang C,Xiangli C,et al.Puerarin suppresses angiotensin II-Induced cardiac hypertrophy by inhibiting NADPH oxidase activation and oxidative stress-Triggered AP-1 signaling pathways[J].J Pharm Pharm Sci,2015,18(2):235-248.
Effects of different concentrations of uric acid on oxidative stress and apoptosis of renal tubular epithelial cells invitro.
DING Hong,YANG Qi,LI Hui-min.Department of Nephrology,the Fourth Affiliated Hospital of China Medical University,Shenyang 110032,Liaoning,CHINA
ObjectiveTo investigate the effects of different concentrations of uric acid on oxidative stress and apoptosis of renal tubular epithelial cells in vitro.MethodsHuman proximal convoluted tubule epithelial cell lines (HKC-8)were divided into control group and uric acid group A,uric acid group B and uric acid group C,each of 15 cases,which were cultured with culture medium,0.1 mmol/L,0.4 mmol/L and 0.8 mmol/L uric acid for 24 hours.Lucigenin-enhanced chemiluminescence was used to detect superoxide anion levels in renal tubular epithelial cells,and ultraviolet spectrophotometry was used to measure NADPH levels.Terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling(TUNEL)was applied to detect the apoptosis of renal tubular epithelial cell.ResultsThe superoxide anion and NADPH levels in renal tubular epithelial cells in uric acid group A,uric acid group B and uric acid group C were significantly higher than those in the control group,in a dose-dependent manner,P<0.05.The apoptosis rates of renal tubular epithelial cells in uric acid group A,uric acid group B,uric acid group C were(73.4±11.7)%, (322.6±23.2)%,(432.7±34.1)%,significantly higher than(16.9±1.2)%in the control group,P<0.05.ConclusionUric acid exerts effects on superoxide anion generation,NADPH levels and apoptosis rate in renal tubular epithelial cells, and the higher the uric acid concentration,the higher the superoxide anion generation,NADPH protein levels and the apoptosis rate.
Uric acid;Renal tubular epithelial cells;Superoxide anion;NADPH;Apoptosis
R334+.1
A
1003—6350(2017)02—0177—03
2016-07-08)
辽宁省科技厅科学技术计划项目(编号:2012225021)
丁红。E-mail:dinghong1230123@sina.com
