饮食管理对胃癌患者术后康复的影响
2017-03-06王艳丽
王艳丽
内蒙古通辽市奈曼旗东明镇得胜卫生院,内蒙古通辽 028000
胃癌是我国第二大常见肿瘤,其致死率位居各种恶性肿瘤的第三位。手术、放疗、化疗为目前主要的胃癌治疗手段[1]。在我国,胃癌发病率和死亡率仍居恶性肿瘤前列,且新发患者有年轻化的趋势。手术是目前胃癌治疗主要手段之一[2]。术后患者常并发营养不良,导致一系列严重临床后果。该次对术后胃癌患者实施饮食管理,观察对术后康复的影响。
1 资料与方法
1.1 临床资料
选择2015年2月—2017年2月该院收治的胃癌患者120例,均经病理检查确诊,均接受手术治疗。排除肝肾功能异常患者、合并糖尿病患者。将患者根据入院顺序随机分为对照组与观察组各60例。对照组60例中男性37例、女性23例;年龄37~69岁,平均(54.07±10.42)岁;腺癌 59 例,印戒细胞癌 1 例;远端胃大部切除47例,全胃切除9例,近端胃切除4例;TNM分期Ⅰ期15例,Ⅱ期17例,Ⅲ期28例。观察组60例中男性35例、女性25例;年龄35~71岁,平均(54.81±9.75)岁;腺癌 58 例,印戒细胞癌 2 例;远端胃大部切除48例,全胃切除10例,近端胃切除2例;TNM分期Ⅰ期17例,Ⅱ期16例,Ⅲ期27例。两组以上资料比较均差异无统计学意义,具有临床可比性。
1.2 干预方法
对照组术后给予常规饮食指导。观察组在对照组基础上给予饮食管理。首先采用欧洲营养风险筛查评估患者术后营养状况,根据患者存在的营养不良风险进行合理饮食管理。制订患者参与饮食管理手册,包括胃癌术后饮食指导、常见饮食相关症状、防治措施、症状自我管理指导、用药指导等。为便于患者阅读、理解和记忆,手册语言尽量通俗易懂。出院前由经过培训的护士患者发放饮食管理手册,并对内容给予详细的讲解[1]。
1.3 观察指标
①干预前及出院4、8周测量患者身高、体质量,计算BMI。②干预前及出院4、8周采用整体营养主观评估量表(Patient—Generated Subjective Global Assessment,PG-SGA)评估患者的营养情况。评分分为3部分,A:近期体质量变化、膳食摄入、症状体征、活动和功能;B:疾病年龄;C:代谢应激状态;D:体格检查。总分0~35分,得分越高营养状况越差[1]。③干预前及出院1、8周采用中文版欧洲癌症研究和治疗组织的生活质量核心量表QLQ-C30评估患者生活质量。选取QLQC30量表中的功能量表(躯体功能、角色功能、情绪功能、认知功能、社会功能)与症状量表(疲倦、恶心呕吐、疼痛)。功能量表得分越高生活质量越高,症状量表得分越高生活质量越差[3]。
1.4 统计方法
采用SPSS 22.0统计学软件分析数据。BMI、PG-SGA评分及QLQ-C30评分用(±s)表示,不同时间间比较采用重复测量方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组干预前后BMI比较
两组干预前BMI比较差异无统计学意义(P>0.05),出院4、8周两组BMI与干预前比较差异无统计学意义(P>0.05),两组间比较差异无统计学意义(P>0.05)。见表1。
表1 两组干预前后 BMI比较[(±s),kg/m2]
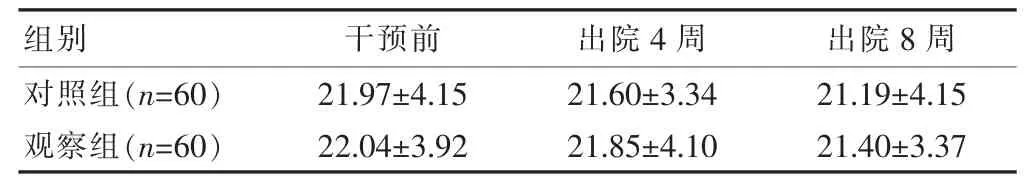
表1 两组干预前后 BMI比较[(±s),kg/m2]
组别 干预前 出院4周 出院8周对照组(n=60)观察组(n=60)21.97±4.15 22.04±3.92 21.60±3.34 21.85±4.10 21.19±4.15 21.40±3.37
2.2 两组干预前后PG-SGA评分比较
两组干预前PG-SGA评分比较差异无统计学意义(P>0.05),出院 4、8 周两组 PG-SGA 评分与干预前比较降低,差异有统计学意义(P<0.05),两组间比较差异有统计学意义(P<0.05)。 见表2。
表2 两组干预前后 PG-SGA评分比较[(±s),分]
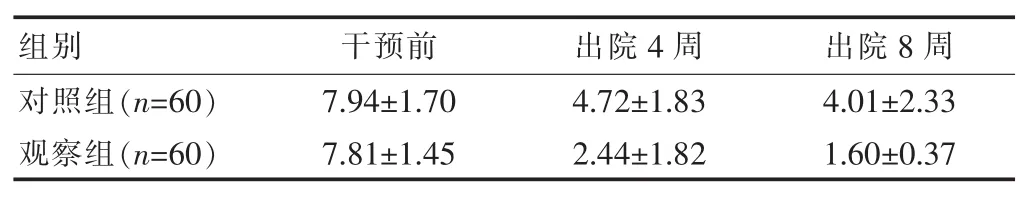
表2 两组干预前后 PG-SGA评分比较[(±s),分]
组别 干预前 出院4周 出院8周对照组(n=60)观察组(n=60)7.94±1.70 7.81±1.45 4.72±1.83 2.44±1.82 4.01±2.33 1.60±0.37
表3 两组干预前后 QLQ-C30评分比较[(±s),分]

表3 两组干预前后 QLQ-C30评分比较[(±s),分]
组别功能量表评分症状量表评分干预前 出院4周 出院8周 干预前 出院4周 出院8周对照组(n=60)观察组(n=60)80.72±10.24 81.06±9.57 81.17±7.08 82.37±9.15 81.50±7.15 84.77±8.06 16.07±3.38 16.52±4.13 15.73±3.36 13.05±4.16 14.17±5.10 12.09±4.47
2.3 两组干预前后QLQ-C30评分比较
两组干预前QLQ-C30评分比较差异无统计学意义(P>0.05)。出院 4、8周功能量表评分逐渐升高、症状量表评分逐渐降低,两组间功能量表评分、症状量表评分比较差异有统计学意义(P<0.05)。见表3。
3 讨论
胃癌是消化系统常见的恶性肿瘤,手术切除是其首选治疗方法。入院时大部分胃癌患者伴有明显的营养不良[4]。癌症患者免疫功能障碍的主要因素是营养不良,而非肿瘤本身。营养不良损害机体组织、器官的生理功能,降低机体的免疫力以及对疾病和应激反应的抵抗力,增加手术并发症的发生率,延长住院时间,增加住院费用,影响患者的预后[5]。胃癌患者术后由于消化道重建、应激等因素,导致胃肠功能紊乱,进食量严重减少,加重其营养不良。营养不良是导致胃癌患者并发症发生、发展和住院时间延长的一个重要原因[6]。因此,术后对患者采取饮食管理,以改善患者的预后。以往对胃癌患者术后的饮食干预主要以饮食指导为主,多注重形式,可操作性不强。国外对癌症术后患者进行患者参与式饮食干预发现,其显著改善了患者的营养状况。患者参与式饮食干预基础方法是患者参与,其结构遵循谈话、评估、营养计划、并发症、再评估、确认的原则,在国外指导癌症患者营养状况评估和饮食管理中广泛应用[7-9]。
该研究对照组术后给予常规饮食指导,观察组在对照组基础上给予饮食管理。结果出院4、8周两组BMI与干预前比较差异无统计学意义(P>0.05),两组间比较差异无统计学意义(P>0.05)。而出院4、8周两组PG-SGA评分与干预前比较降低,差异有统计学意义(P<0.05),两组间比较差异有统计学意义(P<0.05)。 出院4、8周功能量表评分逐渐升高、症状量表评分逐渐降低,两组间功能量表评分、症状量表评分比较差异有统计学意义(P<0.05)。可见饮食管理可改善胃癌患者术后营养状况,从而提高其生活质量。
综上所述,饮食管理帮助患者建立积极的自我饮食管理行为,改善其营养状况,从而促进患者尽快康复。
[1]汪丹丹,郑蔚,乔婷婷,等.胃癌术后患者参与饮食管理对其营养状况影响的研究[J].中华护理杂志,2017,52(4):389-394.
[2]王亚明,张桂东,温桂海,等.术后早期肠内营养对胃癌术后胃肠功能恢复和营养状况的影响[J].实用癌症杂志,2017,32(5):767-769.
[3]任春霞,黄维明.胃癌患者术前营养筛查对其围手术期营养状况及术后恢复的作用[J].肿瘤学杂志,2017,23(5):452-454.
[4]尤久红,陈琦,蔡飞燕,等.规范化营养治疗在胃癌围手术期病人中的应用效果观察[J].肠外与肠内营养,2017,24(1):24-27.
[5]耿鸿昌,王茜,戴荣军,等.分析连续饮食干预对胃癌术后患者营养状况的影响[J].世界最新医学信息文摘,2017,17(43):261-262.
[6]王丹,张丽莉,程晓娜,等.早期肠内营养或肠外营养治疗对胃癌根治术后患者免疫功能和营养状况的影响[J].临床肿瘤学杂志,2017,22(5):423-426.
[7]崔广飞.根治性全胃切除空肠间置代胃术对胃癌患者营养状况及生存质量的影响[J].白求恩医学杂志,2017,15(3):293-295.
[8]周海燕,卫子然.胃癌根治术后早期肠内营养引入结构性营养护理管理理念的临床效果[J].中国临床研究,2017,30(6):855-857.
[9]易春蓉,匡雪春.胃癌手术后营养风险评估与肠内肠外营养干预效果评价[J].中国医药导报,2017,14(20):109-112.
