丙泊酚改善电休克后学习记忆与强直后增强研究☆
2017-03-06邓婕任力闵苏
邓婕任力闵苏○☆
电休克治疗(electroconvulsive therapy,ECT)是目前抑郁症最为快速有效的方式,但有损伤学习记忆功能等副作用[1];丙泊酚复合ECT能够减轻抑郁患者的认知功能损害。既往研究发现,海马长时程突触可塑性的改变在丙泊酚改善抑郁大鼠ECT后学习记忆受损的机制中发挥重要作用[2-3]。然而短时程突触可塑性作为突触可塑性的另外一种重要形式,由于持续时间较短,其生理作用往往被忽略。强直后增强(post-tetanic potential,PTP)是一种普遍的短时程突触可塑性,其机制与突触前膜待释放的谷氨酸数量有关。最新研究发现,PTP相关的短时程突触可塑性参与学习记忆的形成[4-7],其是否参与丙泊酚对抑郁大鼠ECT后学习记忆保护的机制,尚无研究。本研究通过对大鼠进行行为学评估、记录离体脑片PTP和基础场兴奋性突触后电位(field excitatory postsynaptic poten tial,fEPSP)及检测海马谷氨酸浓度,评价PTP在丙泊酚改善抑郁大鼠ECT后学习记忆功能的作用。
1 材料和方法
1.1 研究对象本研究遵守《实验动物使用和管理指南》,研究方案通过重庆医科大学附属第一医院伦理委员会审查批准后实施。由重庆医科大学实验动物中心提供清洁级健康成年雄性Sprague-Dawley(SD)大鼠(体质量200~250 g,2~3月龄),于标准实验环境(自由采食摄水,12 h/12 h昼夜规律交替,温度22℃±2℃)中适应性饲养7 d后。本实验参照文献方法进行[3],采用孤养与慢性不可预见性应激法(chronic unpredictable mild stress,CUMS)建立抑郁大鼠模型,以糖水偏好百分比下降30%为建模成功标准[8],随机选择建模成功的SD雄性大鼠72只,另选取18只健康大鼠作为对照组进行实验。
1.2 分组与处理建模成功的大鼠随机分为抑郁组(D组)、ECT组(DE组)、ECT复合丙泊酚组(DPE组),丙泊酚组(DP组),对照组(C组)不做任何处理;D、DE组均腹腔注射生理盐水8 mL/kg后,D组给予伪ECT处理,即两耳夹电极但不予通电;DE组直接行ECT处DPE、DP组均采用腹腔注射丙泊酚80 mg/kg,分别行ECT和伪ECT处理。ECT采用电休克治疗仪实施,将电极夹于大鼠双耳,电荷量为120 mC,以诱发大鼠强直-阵挛抽搐发作为ECT成功标准。上述处理每天1次,连续7 d。
1.3 行为学评价
1.3.1 糖水偏好实验评价抑郁状况CUMS建模和ECT处理后24 h行糖水偏好实验评价大鼠抑郁状态。参照HAO等[3]方法进行糖水偏好实验,糖水偏好百分比(sucrose preference percentage,SPP)计算公式如下:SPP=糖水消耗量/(糖水消耗量+纯水消耗量)×100%。
1.3.2 Morris水迷宫(Morris water maze,MWM)评估学习记忆能力CUMS建模和ECT处理后各进行一次MWM评估大鼠学习记忆功能,具体方法参照文献[3]。实验的第1~5天进行定位巡航实验,每天随机从东、南、西和北4个象限将大鼠放入水中,记录大鼠自下水到登上平台的时间为逃避潜伏期,取第3~5天逃避潜伏期的平均值作为学习成绩,第6天进行空间探索实验,撤去平台,将大鼠于原平台所在的相反象限(西北象限)中央处投入水中,记录60 s内大鼠在原平台所在象限的游泳时间,即空间探索时间。
1.4 海马脑片PTP检测本研究参照文献方法进行[9]。大鼠在2%苯巴比妥钠麻醉后断头并快速取出全脑,制备厚度为400 μm的海马脑片。在海马SC-CA1区记录基础fEPSP,然后给予强直刺激(tetanic stimulation)(1串频率为400 Hz,400个刺激)诱导PTP,间隔5 s记录一次,总共记录100 s。实验选取fEPSP斜率为记录指标(用Clampex10采集数据,以6次斜率的平均值记为基础fEPSP);PTP以强直刺激后第一个5 s斜率计算,以基础fEPSP幅度100%进行标准化分析,Origin 7.0作图。
1.5 谷氨酸浓度定量分析利用高效液相色谱检测海马样本中的谷氨酸浓度。大鼠海马经取材后,加入甲醇200 mg/mL匀浆,离心(4000 r/min)10 min,取上清液按1:1加入乙腈,离心(15000 r/min)后取上清液280 μL,再加巯基乙醇和领苯二甲醛(OPA)做柱前衍生化,摇匀,避光取0.5 mL备HPLC分析。色谱柱流动相A 50 mmol/L乙酸钠(pH5.48),流动相B甲醇-四氢呋喃(97.5/2.5,v/v)。梯度洗脱,流速1.0 mL/min,加入氨基酸标准品进样检测波长,绘制标准曲线计算谷氨酸浓度。参照如下计算公式:谷氨酸(μmol/g)=[样品浓度(μmol/μL)×样本容积(μL)]/海马重量(g)。
1.6 统计学方法采用SPSS 22.0进行统计分析。数据以均数±标准差(x±s)描述。糖水偏好百分比、PTP和海马谷氨酸浓度均采用单因素方差分析。逃避潜伏期采用球形检验,若球形对称采用单因素方差分析;若球形不对称,采用重复测量方差分析。均数组间两两比较采用SNK-q检验,检验水准α=0.05,双侧检验。
2 结果
2.1 行为学结果大鼠糖水偏好实验中,CUMS建模后,各组SPP有统计学差异(F=98.77,P<0.01)。其中,与C组相比,其余4组SPP均降低(P<0.05)。ECT处理后,各组SPP有统计学差异(F=154.23,P<0.01),其中,DE、DPE组SPP高于D组(P<0.05),DP组与D组无统计学差异(P>0.05)。见表1。
大鼠Morris水迷宫学习记忆成绩比较,CUMS建模后,各组大鼠逃避潜伏期和空间探索时间均有统计学差异(F=8.58,P<0.01;F=8.229,P<0.01)。其中,与C组相比,其余4组逃避潜伏期延长、空间探索时间缩短(均P<0.05)。ECT处理后,各组逃避潜伏期和空间探索时间均有统计学差异(F=31.77,P<0.01;F=63.98,P<0.01)。其中,与D组比较,DE、DPE组逃避潜伏期延长,空间探索时间缩短(均P<0.05),DPE组较DE组逃避潜伏期缩短,空间探索时间延长(均P<0.05),DP组与D组无统计学差异(P>0.05)。见表1。
2.2 海马脑片PTP各组海马脑片PTP差异有统计学意义(F=16.371,P<0.01)。与C组比较,其余4组PTP降低(P<0.05),DE、DPE组PTP低于D组,DPE组PTP高于DE组(P<0.05),D组和DP组差异无统计学意义(P>0.05)。各组大鼠海马基础fEPSP差异有统计学意义(F=8.97,P<0.05),其中,与D组比较,DE组和DPE组基础fEPSP升高(P<0.05);DPE组基础fEPSP显著低于DE组(P<0.05);D、DP组与C组均无统计学差异(P<0.05)。见表2、图1。
2.3 海马谷氨酸浓度ECT处理后,各组大鼠海马内谷氨酸浓度差异有统计学意义(F=24.101,P<0.01)。与C组比较,其余4组海马谷氨酸浓度升高(P<0.05)。其中,DE组谷氨酸浓度高于D组(P<0.05),DPE组谷氨酸浓度低于DE组(P<0.05),但DPE、D组和DP组两两比较无统计学差异(P>0.05)。见表2。
表1 CUMS建模后和ECT处理后各组大鼠糖水偏好实验与Morris水迷宫实验结果(±s)
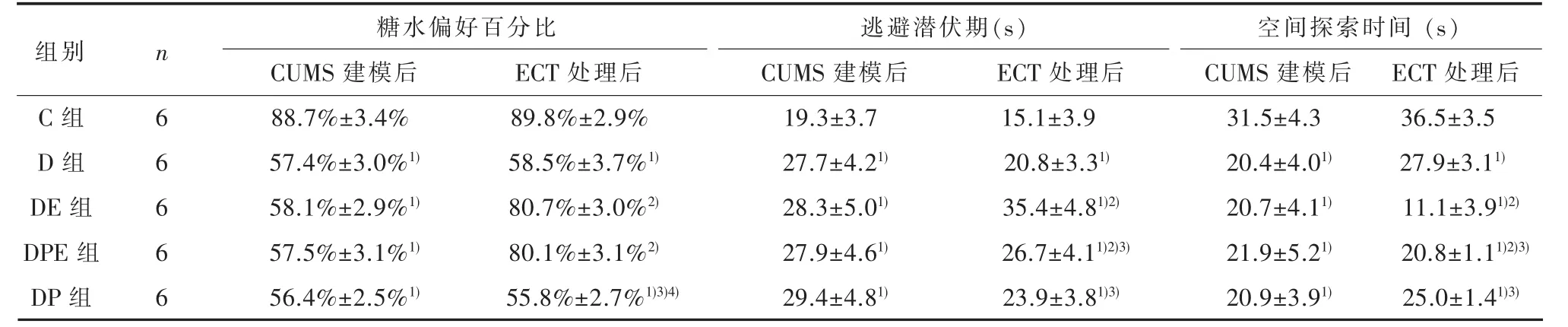
表1 CUMS建模后和ECT处理后各组大鼠糖水偏好实验与Morris水迷宫实验结果(±s)
1)与C组比较,经SNK-q检验,P<0.05;2)与D组比较,经SNK-q检验,P<0.05;3)与DE组比较,经SNK-q检验,P<0.05;4)与DEP组比较,经SNK-q检验,P<0.05
ECT处理后36.5±3.5 27.9±3.11)11.1±3.91)2)20.8±1.11)2)3)25.0±1.41)3)糖水偏好百分比逃避潜伏期(s)空间探索时间(s)组别n C组D组DE组DPE组DP组6 6 6 6 6 CUMS建模后88.7%±3.4%57.4%±3.0%1)58.1%±2.9%1)57.5%±3.1%1)56.4%±2.5%1)ECT处理后89.8%±2.9%58.5%±3.7%1)80.7%±3.0%2)80.1%±3.1%2)55.8%±2.7%1)3)4)CUMS建模后19.3±3.7 27.7±4.21)28.3±5.01)27.9±4.61)29.4±4.81)ECT处理后15.1±3.9 20.8±3.31)35.4±4.81)2)26.7±4.11)2)3)23.9±3.81)3)CUMS建模后31.5±4.3 20.4±4.01)20.7±4.11)21.9±5.21)20.9±3.91)
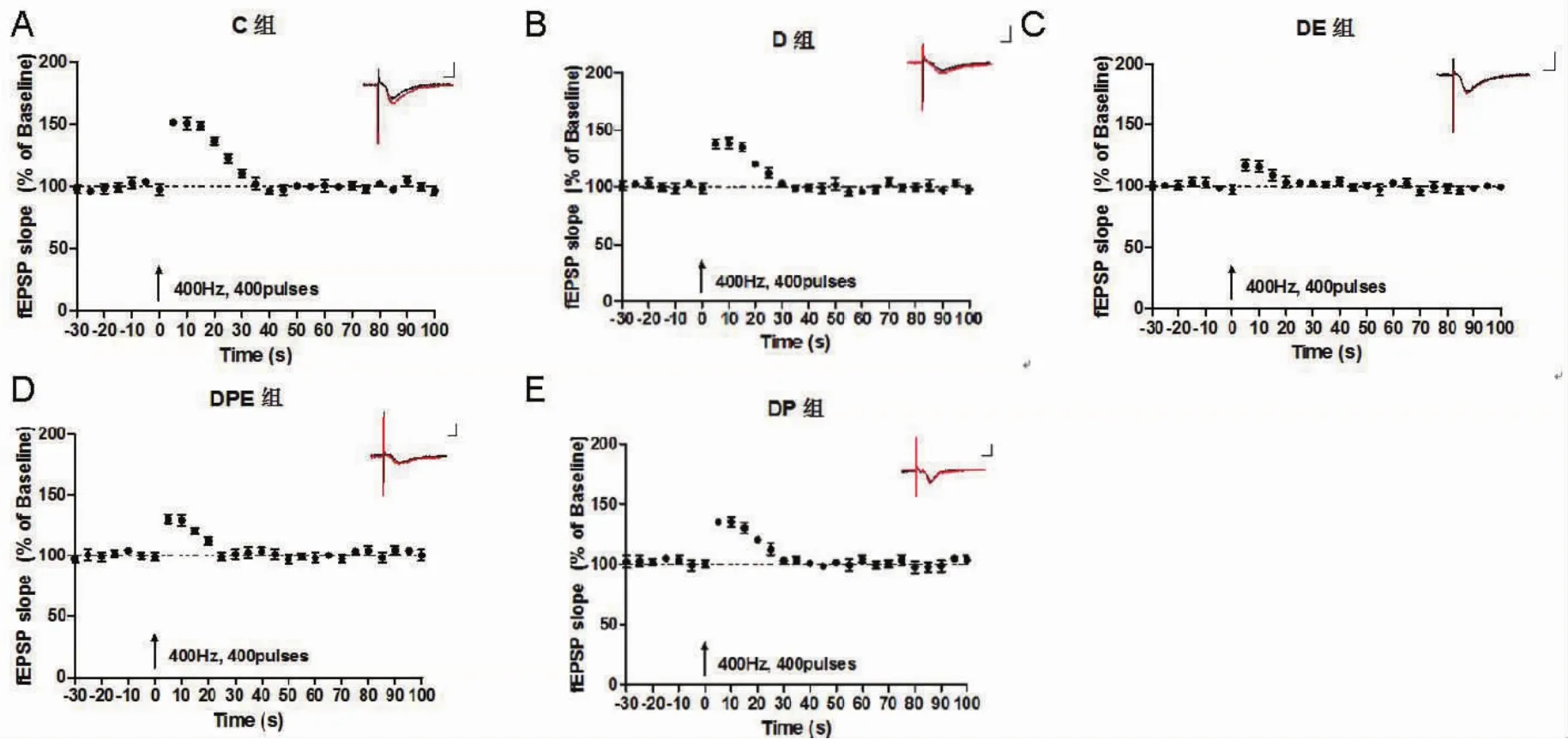
图1 各组大鼠离体脑片海马SC-CA1区PTP结果。以400 Hz,400 Pulse刺激方案诱导PTP,隔5 s记录一次,总共记录100s,PTP以强直刺激后第一个5 s斜率计算,以基础fEPSP幅度100%进行标准化分析(黑色为基础fEPSP原始轨迹,红色为诱导PTP的原始轨迹,测量标尺:1 mv纵轴,5 ms横轴)
表2 各组海马脑片PTP检测和海马谷氨酸浓度(±s)
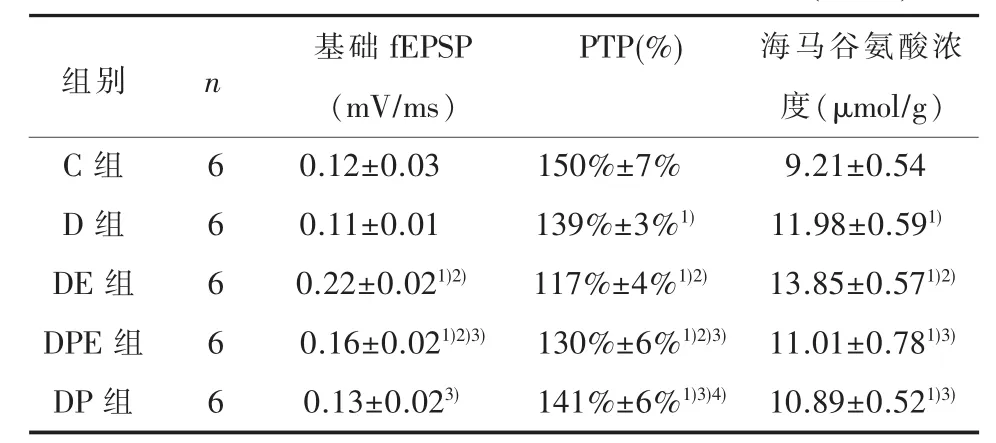
表2 各组海马脑片PTP检测和海马谷氨酸浓度(±s)
1)与C组比较,经SNK-q检验,P<0.05;2)与D组比较,经SNK-q检验,P<0.05;3)与DE组比较,经SNK-q检验,P<0.05;4)与DPE组比较,经SNK-q检验,P<0.05
PTP(%)组别n C组D组DE组DPE组DP组6 6 6 6 6基础fEPSP(mV/ms)0.12±0.03 0.11±0.01 0.22±0.021)2)0.16±0.021)2)3)0.13±0.023)150%±7%139%±3%1)117%±4%1)2)130%±6%1)2)3)141%±6%1)3)4)海马谷氨酸浓度(μmol/g)9.21±0.54 11.98±0.591)13.85±0.571)2)11.01±0.781)3)10.89±0.521)3)
3 讨论
CUMS方法建立抑郁模型广泛应用于抑郁症机制的研究,其慢性低水平应激源能够有效模拟人类环境应激所导致的抑郁症[10]。本研究采用糖水偏好实验评价大鼠抑郁状态,CUMS建模后大鼠较对照组SPP下降30%以上,提示建模成功[8]。Morris水迷宫实验是评价动物学习记忆能力的经典方法,主要反映动物的空间学习记忆能力。本研究结果显示,CUMS建模组学习记忆能力低于对照组,提示抑郁可引起大鼠的学习记忆能力下降;ECT治疗后,DE组与DPE组的学习记忆能力明显低于D组,提示ECT加重了抑郁大鼠学习记忆能力的损害;而DPE组学习记忆能力明显高于DE组,提示复合丙泊酚可减轻抑郁大鼠ECT后的学习记忆损害。
突触可塑性是指突触传递功能的改变,而突触传递的稳态是学习记忆的生物学基础之一。突触传递稳态的维持受其基础传递效能及接受刺激后传递能力变化的影响。PTP是一种短时程突触可塑性,反映突触接受刺激后传递能力增强的水平,参与突触功能的稳定和学习记忆的形成[5-6]。本研究通过离体海马脑片电生理技术发现,CUMS建模组的PTP受损,提示抑郁影响大鼠海马突触传递效能增强的水平,表现出学习记忆功能降低;ECT处理后抑的郁大鼠,DE组和DPE组PTP均明显低于D组,提示ECT可进一步影响抑郁大鼠海马突触传递功能,加重学习记忆功能的损害。值得注意的是,DPE组PTP明显高于DE组,提示丙泊酚可减轻单纯ECT对PTP的损害,稳定突触功能,改善学习记忆功能。既往研究表明,PTP的产生与突触前膜待释放的谷氨酸相关,而待释放的谷氨酸主要来源于突触对谷氨酸的重吸收,各种原因引起的重吸收能力障碍可导致谷氨酸蓄积及突触前膜待释放谷氨酸数量的降低[11-12]。针对于此,本研究进一步检测了海马内谷氨酸的浓度,结果显示,D组海马谷氨酸浓度高于C组,DE组海马谷氨酸浓度进一步升高,而DPE组谷氨酸浓度低于DE组,提示抑郁及单纯ECT处理均可引起海马谷氨酸的蓄积,而丙泊酚能够减少ECT后谷氨酸的蓄积。鉴于PTP的水平主要与待释放谷氨酸的数量相关,推测丙泊酚改善ECT后抑郁大鼠学习记忆的功能,可能与抑制谷氨酸蓄积,增加待释放谷氨酸水平有关。
相关研究显示,突触基础传递效能的改变也是损伤学习记忆功能的原因之一[4,13]。LIM等发现,干扰突触前膜基因LSD的表达,引起突触基础传递效能的异常增加,损伤了动物的短时程突触可塑性和空间学习记忆能力。有意思的是,本研究通过检测基础fEPSP观察海马突触的基础传递效能发现,抑郁状态及丙泊酚处理并不能影响海马突触的基础传递效能,ECT处理可使抑郁大鼠的基础传递效能明显增加,而丙泊酚能够有效抑制ECT所致的上述效应。结合PTP检测结果,我们推测抑郁症与ECT损害学习记忆的机制可能存在差异。抑郁症对学习记忆功能的影响可能与干扰海马突触接受刺激后的传递能力相关,ECT则可影响海马突触基础传递效能及刺激后传递能力损伤学习记忆功能,这可能是丙泊酚仅能改善ECT所致学习记忆损害的原因之一。
本研究主要不足之处在于仅从谷氨酸蓄积这一方面探讨PTP损伤的机制,未直接揭示其与突触前膜待释放谷氨酸的内在分子联系。其次,尽管本研究观察到抑郁状态及ECT对于大鼠海马突触基础传递效能存在不同影响,但其机制尚不明确,仍需要进一步研究。
综上所述,丙泊酚改善抑郁大鼠ECT处理后学习记忆功能的机制,可能与下调海马谷氨酸浓度,减轻PTP损伤有关。
[1]LISANBY SH.Electroconvulsive therapy for depression[J].N Engl J Med,2007,357(19):1939-1945.
[2]郝学超,闵苏,朱贤林,等.电休克和氯胺酮对抑郁模型大鼠海马区谷氨酸受体NR1及GluR1的影响[J].中国神经精神疾病杂志,2014,40(9):555-559.
[3]HAO XC,ZHU XL,LI P,et al.NMDA receptor antagonist enhances antidepressant efficacy and alleviates learning-memory function impairment induced by electroconvulsive shock with regulating glutamate receptors expression in hippocampus[J].J Affective Disord,2016,190:819-827.
[4]LIM CS,NAM HJ,LEE J,et al.PKCalpha-mediated phosphorylation of LSD1 is required for presynaptic plasticity and hippocampal learning and memory[J].Sci Rep,2017,7(1):4912.
[5]ANWAR H,LI X,BUCHER D,et al.Functional roles of shortterm synaptic plasticity with an emphasis on inhibition[J].Curr Opin Neurobiol,2017,43:71-78.
[6]WATABE AM,NAGASE M,HAGIWARA A,et al.SAD-B kinase regulates pre-synaptic vesicular dynamics at hippocampal Schaffer collateral synapses and affects contextual fear memory[J].J Neurochem,2016,136(1):36-47.
[7]PARK AJ,HAVEKES R,CHOI JH,et al.A presynaptic role for PKA in synaptic tagging and memory[J].Neurobiol Learn Mem,2014,114:101-112.
[8]MATTHEWS K,FORBES N,REID IC.Sucrose consumption as an hedonic measure following chronic unpredictable mild stress[J].Physiol Behav.1995,57(2):241-248.
[9]Wang CC,Weyrer C,Paturu M,et al.Calcium-Dependent Protein Kinase C Is Not Required for Post-Tetanic Potentiation at the Hippocampal CA3 to CA1 Synapse[J].J Neurosci.2016,36(24):6393-6402.
[10]BAKER SL,KENTNER AC,KONKLE AT,et al.Behavioral and physiological effects of chronic mild stress in female rats[J].Physiol Behav.2006,87(2):314-322.
[11]ZHU X,HAO X,LUO J,et al.Propofol inhibits inflammatory cytokine-mediated glutamate uptake dysfunction to alleviate learning/memory impairment in depressed rats undergoing electroconvulsive shock[J].Brain Res,2015,1595:101-109.
[12]ZUCKER R S,REGEHR W G.Short-term synaptic plasticity[J].Annu Rev Physiol,2002,64:355-405.
[13]REN L,ZHANG F,MIN S,et al.Propofol ameliorates electroconvulsive shock-induced learning and memory impairment by regulation of synaptic metaplasticity via autophosphorylation of CaMKIIa at Thr 305 in stressed rats[J].Psychiatry Res,2016,240:123-130.
